LOX-1和OX-LDL水平与中重度创伤性颅脑损伤患者病情及神经功能预后的相关性*
曹清清,葛建彬
江苏省南通市第二人民医院药剂科,江苏南通 226001
创伤性颅脑损伤(TBI)是临床上的急危重症,病死率、致残率高。调查显示,美国每年约有30万人因TBI住院治疗,约43%的患者出院后遗留不同程度的神经躯体功能障碍,极大影响患者的生活质量和生命安全[1]。目前TBI严重程度与最终功能障碍结果之间存在较大差异,无法做到准确性预测。近年的研究结果表明,患者因血管内皮损伤所致的脑血管痉挛而加重神经功能障碍在TBI病情进展及功能预后方面起着重要作用[2-3]。导致血管内皮损伤的因素众多,其中氧化低密度脂蛋白(OX-LDL)对血管内皮的损伤是目前业内研究的热点。研究表明,OX-LDL通过其特异性受体氧化型低密度脂蛋白受体-1(LOX-1)诱导血管内皮细胞表达一些相关因子,介导血管内皮损伤[4]。有研究显示,OX-LDL和LOX-1可作为蛛网膜下腔出血后的迟发性出血的生物学标志物,二者在脑血管痉挛中也发挥着重要作用[5]。本研究旨在探讨OX-LDL和LOX-1与TBI患者病情严重程度及神经功能预后的相关性,现报道如下。
1 资料与方法
1.1一般资料 纳入本院2018年9月至2020年4月收治的90例中重度TBI患者作为研究对象。纳入标准:(1)符合《重型颅脑损伤救治指南第四版》[6]中的诊断标准;(2)格拉斯哥昏迷评分(GCS)为4~12分;(3)均经颅脑MRI或CT检查证实,并行开颅去骨瓣减压术;(4)年龄18~65岁;(5)临床资料完整。排除标准:(1)GCS≤3分或GCS≥13分者;(2)临床资料不完整者;(3)住院期间死亡无法获得本研究需要的结果者。收集中重度TBI患者的性别、年龄、受伤至入院时间、基础疾病(高血压、糖尿病、冠心病、脑卒中)、颅脑损伤部位、入院时GCS、创伤严重度评分(ISS)等一般临床资料。患者入院后完善血常规、肝肾功能、头部MRI或CT等相关检查,并予以纠正电解质紊乱、甘露醇降低颅内压、急诊开颅去骨瓣减压术等处理措施。本研究获得患者及家属知情同意并上报本院医学伦理委员会获批。
1.2方法
1.2.1OX-LDL和LOX-1检测 于入院第3天清晨空腹抽取患者静脉血5 mL,离心后取上层血清,采用抗体酶联免疫法检测LOX-1和OX-LDL水平。试剂盒购自上海科瑞生物科技有限公司,严格按照说明书进行操作。
1.2.2神经功能评估 采用功能性独立评定量表(FIM)[7]对患者出院后3个月时的神经功能进行评价,该量表共18项(13个运动任务和5个认知任务),每项评分1~7分,总评分18~126分,得分越高说明神经功能越好。评判标准:126分为完全独立,80~125分为基本上独立(或极轻度依赖或有条件的独立),72~79分为轻度依赖,54~71分为中度依赖,36~53分为重度依赖,19~35分为极重度依赖,18分为完全依赖。并根据FIM评分的中位数将患者分为功能良好组和功能不良组。
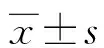
2 结 果
2.1中重度TBI患者FIM评分情况及分组后一般资料比较 90例患者均完成随访,出院后3个月时FIM评分为31~87分,中位数为49分,据此将患者分为功能良好组(45例)和功能不良组(45例)。2组患者一般临床资料比较,功能良好组GCS高于功能不良组,年龄、ISS低于功能不良组,差异均有统计学意义(P<0.05),见表1。
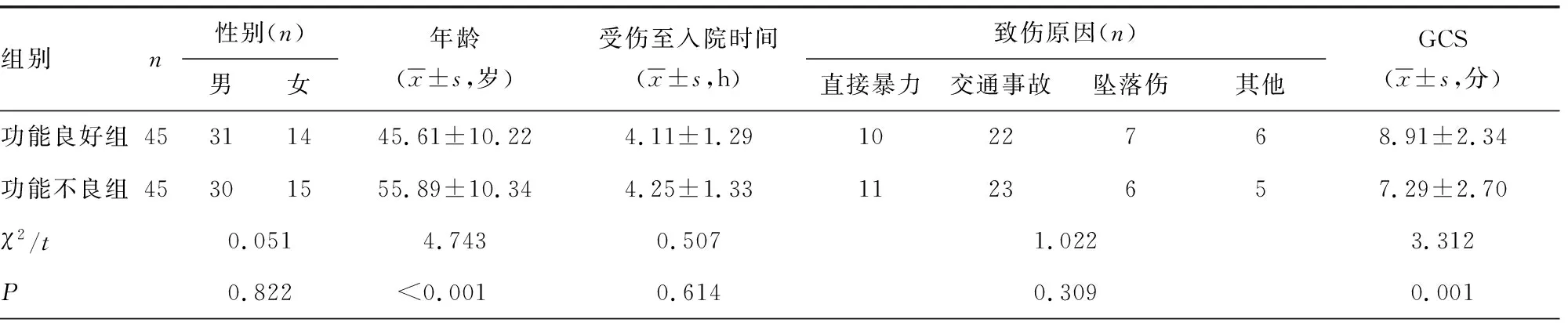
表1 不同神经功能预后患者一般临床资料比较
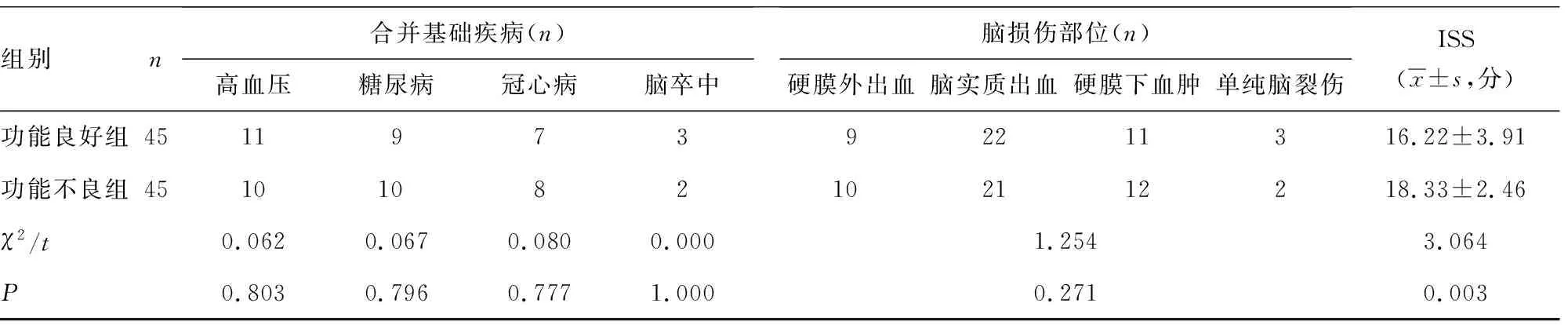
组别n合并基础疾病(n)高血压糖尿病冠心病脑卒中脑损伤部位(n)硬膜外出血脑实质出血硬膜下血肿单纯脑裂伤ISS(x±s,分)功能良好组451197392211316.22±3.91功能不良组45101082102112218.33±2.46χ2/t0.0620.0670.0800.0001.2543.064P0.8030.7960.7771.0000.2710.003
2.2不同神经功能预后患者OX-LDL、LOX-1水平比较 功能良好组OX-LDL、LOX-1水平低于功能不良组,差异均有统计学意义(P<0.05),见表2。
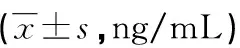
表2 不同神经功能预后患者OX-LDL、LOX-1水平比较
2.3OX-LDL、LOX-1水平与ISS及FIM评分的相关性 Pearson线性相关性分析显示,OX-LDL、LOX-1水平与ISS呈正相关(r=0.469、0.524,P<0.05),与FIM评分呈负相关(r=-0.729、-0.755,P<0.05),见图1。
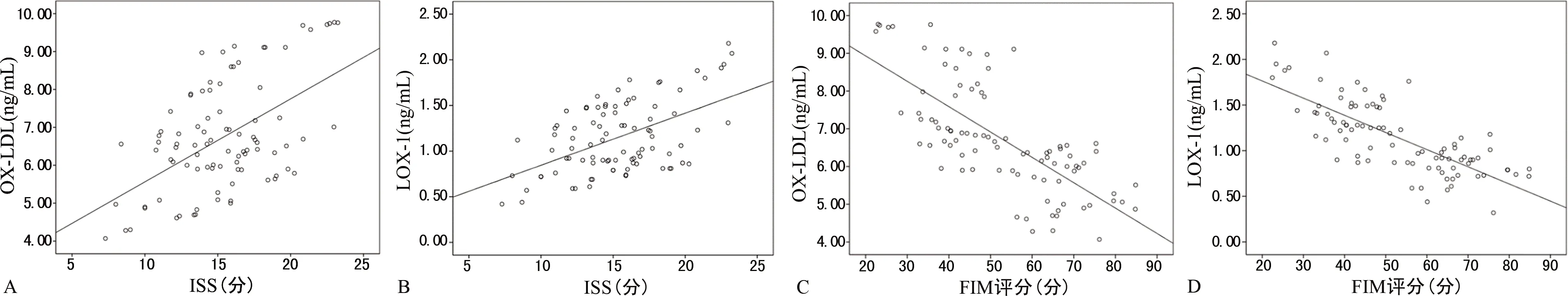
注:A、B、C、D分别表示OX-LDL、LOX-1水平与ISS,OX-LDL、LOX-1水平与FIM评分的相关性。图1 OX-LDL、LOX-1水平与ISS及FIM评分的相关性
2.4TBI患者神经功能预后不良的多因素线性回归分析 以FIM评分为因变量,将有统计学意义的指标作为自变量,进行多因素线性回归分析,结果显示,GCS低与血清OX-LDL、LXO-1水平高是TBI患者神经功能预后不良的独立危险因素(P<0.05),见表3。
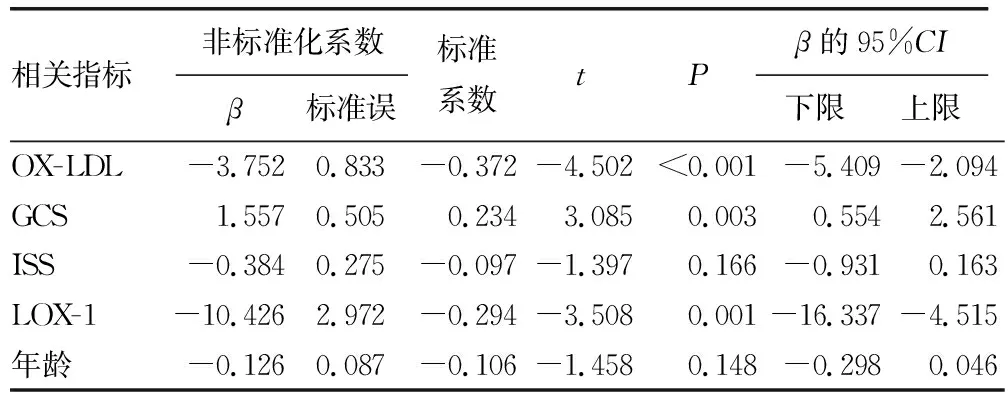
表3 影响TBI患者神经功能预后不良的多因素线性回归分析
3 讨 论
TBI后会引起脑血管痉挛,而脑血管痉挛则会延长脑缺血时间,最终导致神经功能出现严重的障碍。多项研究证据表明,微血管、纤溶以及凝血系统参与了脑血管痉挛后脑缺血的病理生理过程[8-9]。OX-LDL通过与LOX-1结合,增加细胞内活性氧的数量及种类,导致一氧化氮的利用率降低,并下调内皮型一氧化氮合酶起到抑制血管舒张作用,进而引起脑血管痉挛。已有研究证实,OX-LDL和LOX-1通过介导各种反应参与了动脉粥样硬化的发病机制[10]。动物实验表明,蛛网膜下腔出血的兔模型的脑基底动脉壁中OX-LDL和LOX-1水平升高[11]。但关于OX-LDL和LOX-1水平与TBI患者神经功能预后的关系国内鲜有报道。脑血管痉挛所致的脑缺血时间延长对于患者创伤急性期严重程度及神经功能预后均会产生严重的影响,早期识别脑血管痉挛对于指导临床干预是有益的。
本研究结果显示,功能良好组的患者GCS高于功能不良组(P<0.05),年龄、ISS评分、OX-LDL、LOX-1水平低于功能不良组(P<0.05);进一步对存在统计学意义的指标进行线性回归分析显示,GCS低与血清OX-LDL、LXO-1水平高是TBI患者神经功能预后不良的独立危险因素(P<0.05)。GCS在临床上常用于评估患者颅脑损伤严重程度,GCS越低,表示患者颅脑损伤越严重,患者长期存活的可能性更低;另外,许多研究表明,ISS越高以及年龄越大也是TBI患者神经功能预后不良的危险因素[12-13],但本研究并未得出此结论,考虑可能与样本量较小有关。关于OX-LDL和LOX-1对TBI患者神经功能预后的关系方面,LOX-1可以与OX-LDL特异性结合在内皮细胞中,并在血管功能障碍中发挥关键作用,包括凋亡和抑制血管舒张。OX-LDL能够引起细胞损伤,导致内皮功能障碍,引起血管内皮舒张功能减弱,收缩增强,特别是在颅脑创伤的患者中会加剧脑血管痉挛并延长痉挛时间[14]。其可能作用机制:(1)OX-LDL可增加细胞内活性氧的产生,激活细胞凋亡系统引起细胞凋亡;(2)其还可以通过上调LOX-1在血管内皮的表达来增强其自身的细胞损伤的作用[15];(3)血管内皮经过OX-LDL刺激后可以释放出多种黏附因子、趋化因子,致使白细胞滚动、黏附,触发炎性反应而损伤血管内皮[16]。
进一步分析血清OX-LDL、LOX-1水平与ISS及FIM评分的相关性得出,OX-LDL、LOX-1水平与ISS呈正相关,与FIM评分呈负相关,说明了二者在早期就能够反映TBI患者病情严重程度,并可用于评估神经功能损伤情况;目前关于TBI脑出血后所致的血清LOX-1水平升高原因难以确定,笔者分析认为可能是由于LOX-1作为一种“清道夫”受体,主要存在于血管内皮上,颅脑损伤后所引发的机体一系列氧化应激反应导致体内活性氧增加,而由活性氧所进一步导致的OX-LDL通过与LOX-1结合而发挥作用[17],在发挥作用的过程中还会进一步介导一系列反应导致LOX-1表达增加,由此达到使自身发挥更大作用的目的。有研究表明,蛛网膜下腔出血患者中OX-LDL和LOX-1水平与患者后期迟发性出血有关[18]。
综上所述,TBI患者病情越严重,其血清LOX-1、OX-LDL水平越高,且2种指标的水平变化与患者神经功能预后高度相关。但限于本研究样本量较小,后期还需要增大样本量,进行多中心研究来进一步论证。

