妊娠期间宫颈癌20例临床分析
李明宝 杨 洲 陈忠绍 张 露
(山东大学齐鲁医院妇产科,山东 济南 250063)
妊娠合并肿瘤的发病率约为1/1 000,宫颈癌是其中最常见的妇科肿瘤,其发病率为(0.1~120/100 000)。妊娠期宫颈癌包括妊娠期间宫颈癌和产后6个月以内的宫颈癌,占全部宫颈癌的比例约3%[1]。随着宫颈癌发病的年轻化,以及高龄产妇的增多,对妊娠期间异常流血流液的孕产妇,我们应该注重宫颈癌的筛查[2]。对于妊娠期间特别是中孕期的宫颈癌患者,需充分考虑患者肿瘤分期、分化、孕周、保胎意愿、新辅助化疗及其可能潜在的对母胎的损害、延长孕周对母体疾病进展及心理状况的影响等因素多学科协作制定个体化治疗方案。本文旨在分析我院妊娠期间宫颈癌患者的临床特征及母胎结局,为妊娠期间宫颈癌的诊治提供参考。
1 资料与方法
1.1 一般资料 本文收集了2010年5月至2020年12月就诊于山东大学齐鲁医院,经病理诊断为宫颈癌的妊娠期患者,有完整病例资料的患者20例。平均发病年龄(32.7±4.13)岁。根据FIGO 2018宫颈癌分期,ⅠB1~ⅠB3期13例;ⅡA1~ⅡB期2例;ⅢB期1例;ⅢC1p期4例。
1.2 方法 分析患者的临床资料,包括年龄、孕产次、症状、孕周、肿瘤分期、治疗方案、新生儿体质量及Apgar评分、病理、术后是否放化疗、影像学资料、SCC、疾病复发、新生儿发育及是否合并肿瘤等。
1.3 统计学方法 采用SPSS 25.0处理数据,连续型变量采用()表示,计数资料用百分比表示,P<0.05提示数据差异有显著性。
2 结果
2.1 20例妊娠期间宫颈癌患者临床资料,中早孕期(≤13.00+6周)6例(30.00%),中孕期(14周~27+6周)7例(35.00%),晚孕期(≥28周)7例(35.00%)。见表1。

表1 妊娠期间宫颈癌患者临床资料
2.2 2例中孕期合并宫颈癌患者行新辅助化疗延长孕周临床资料及结局 6例早孕期宫颈癌患者均选择终止妊娠并行根治性手术,1例12+2周患者因分期较晚先行新辅助化疗2周期后再行经腹宫颈癌根治术;另外5例直接手术患者中3例为经腹手术,2例先行负压吸宫后再行腹腔镜宫颈癌根治术,术中均保留双侧卵巢并行卵巢高位悬吊术。术后病理5例为鳞癌,根据Sedlis标准,3例予以同步放化疗,2例术后随访,1例ⅠB1期患者术后病理为高级别神经内分泌癌伴小灶鳞状细胞癌,患者及其家属拒绝辅助治疗并自动出院。见表2。

表2 2例中孕期合并宫颈癌患者行新辅助化疗延长孕周临床资料及结局
2.3 7例晚孕期宫颈癌患者临床资料及母胎结局 7例中孕期患者中2例继续妊娠,其中1例予以新辅助化疗1次后于2018年9月16日行剖宫产+宫颈癌根治术,分娩孕周35+4周,新生儿体质量2 600 g,Apgar评分1 min 9分,5 min 10分,患者术后病理为鳞癌,盆腔淋巴结1枚转移,随访至2019年8月患者因宫颈癌复发死亡,其幼儿发育无明显异常。另一例新辅助化疗3周期后行剖宫产+根治性手术+术后同步放化疗,随访至今母婴结局良好。其余5例均放弃妊娠并行宫颈癌根治术。7例晚孕期患者均行剖宫产±宫颈癌根治术,3例患者初次手术仅行剖宫产,其中1例患者因ⅢB期引发肾功能衰竭,仅行剖宫产娩一胎儿体质量1 700 g,新生儿重度窒息,家属放弃抢救。另外2例因其他产科指征入院查体发现宫颈病变,取活检后等待病理过程中分别因“HELLP综合征、胎儿宫内窘迫”行剖宫产术。见表3。
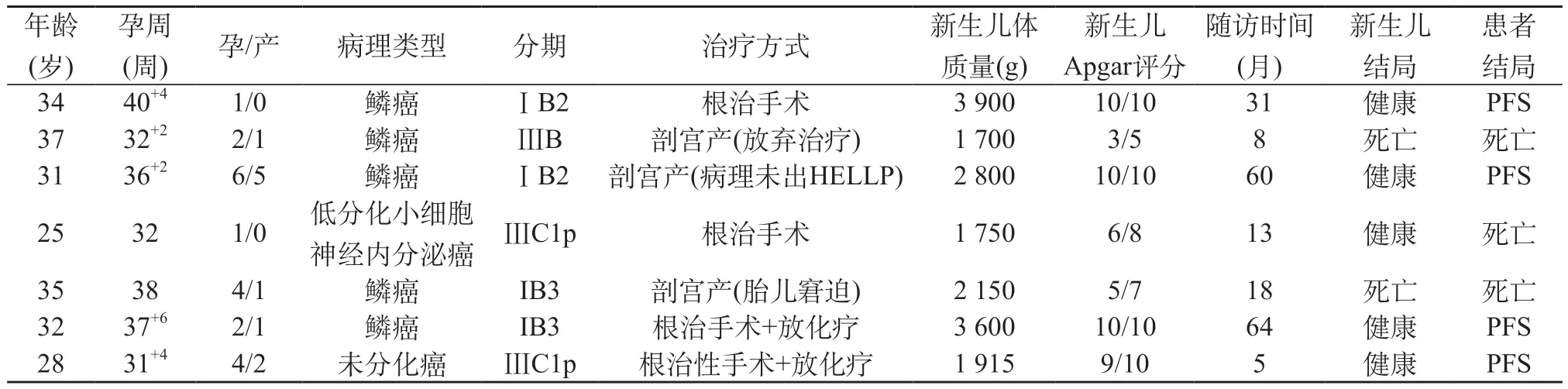
表3 7例晚孕期宫颈癌患者临床资料及母胎结局
3 讨论
3.1 妊娠期间宫颈癌的影像学检查 对于妊娠期宫颈癌,超声和MRI是首选的影像学检查。超声具有廉价、方便、对母胎无不良影响等优点,可以随访胎儿的大小,监测肿瘤进展。一项回顾性分析报道超声在判断病灶大小及宫旁组织是否侵犯上更有优势[3]。MRI已被证实在整个孕期是安全的,对癌灶的大小位置、正常组织界限、宫旁组织侵润、淋巴转移等具有较高的诊断价值[4]。造影剂钆在FDA药物分级为C类,虽然没有明确证据对胎儿有害,但轧可穿透胎盘,并经胎儿肾脏代谢进入羊水,需充分权衡利弊。
3.2 化疗在妊娠期的有效性及安全性 手术和放化疗是宫颈癌的主要治疗手段,但妊娠期放疗及手术均可导致自发流产、胎儿畸形等不良胎儿结局,这就使得化疗成为唯一可能延长孕周的治疗方案。一份近期的Meta分析[5]共筛选出88例通过新辅助化疗延长孕周从而获得活产的病例。对化疗药物的担忧主要是其致畸作用及可能引发的流产风险。药物的致畸作用主要依赖于药物的作用时间、累计剂量、代谢物毒性、是否穿透胎盘等因素决定。胚胎器官形成期,也就是受孕后2~8周是最容易受影响的时期。这意味着早孕期使用化疗药容易引起流产、胎儿畸形等风险,有报道其致畸率高达20%[6]。在中晚孕期应用化疗药可能引起3%~5%的畸形以及25%的胎儿宫内发育迟缓,但长期随访研究发现胎儿娩出后很快能恢复同龄儿体质量,且未发现远期血液、免疫系统异常,并具备正常的学习能力[7]。De Vincenzo等[8]报道1例新辅助化疗后行剖宫产及根治性手术的病例,术中娩出1例新生儿体质量2 450 g,生后22个月确诊急性髓系白血病(M7)行骨髓移植。但因病例资料较少,仍没有足够的证据表明妊娠期间化疗与胎儿出生后恶性肿瘤存在相关关系。
3.3 顺铂是妊娠期宫颈癌最常用的化疗药物 尽管有文献数据支持珀类药物的安全性[9-10],但妊娠期间这些药物的药物动力学仍不明确,妊娠期特殊的生理学改变影响药物的吸收、分布、代谢,从而影响药物效力和不良反应,这些改变在晚孕期更加明显。尽管妊娠期血流动力学的改变,顺铂及紫杉醇的用量仍推荐同非孕期一致[11]。考虑化疗药物对母胎骨髓的抑制,孕34周以后再应用化疗药物,以避免发生严重的母胎败血症及出血可能。化疗药物穿透胎盘屏障的研究非常有限。Köhler等[9]对21例妊娠期宫颈癌使用珀类化疗的患者进行研究,分别于剖宫产时取母体静脉血、脐带血、羊水并测量其中珀类药物浓度,发现脐带血中珀类药物浓度占母体血液中的23%~65%,羊水中药物浓度占母体血液中的11%~42%,在一定程度上验证了化疗的安全性。
目前研究发现妊娠并不会加快宫颈癌的进展,对其分期较早的妊娠期宫颈癌新辅助化疗在控制肿瘤进展同时延长孕期至胎儿可存活。同时新辅助化疗也可以减小肿瘤负荷,以便必要时行保留生育的宫颈癌手术,如宫颈锥形切除术、宫颈切除术。
3.4 妊娠期间宫颈癌的治疗方式 2019年欧洲瘤内科学会第3次国际共识根据不同的分期及孕周对妊娠期间宫颈癌的治疗有以下推荐[11]:
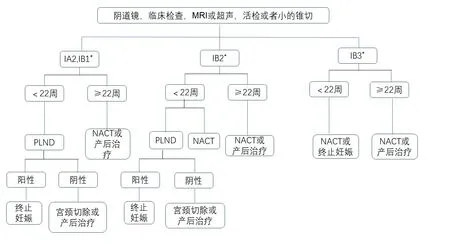
图1 妊娠期间宫颈癌治疗流程
对于ⅠA2-ⅠB2期早中孕期的患者,行经腹或者经阴道的广泛宫颈切除一直是有争议的,Cplna等[12]回顾了10例经阴道和11例经腹广泛宫颈切除术的患者临床资料,所有患者在5~22周接受手术,术中出血量及手术时长较宫颈切除术明显增加,其中2例经阴道手术和4例经腹手术的患者出现了自发性流产,提示经阴道手术可能更安全。鉴于上述风险以及宫颈癌较低的宫旁转移率,2014年及2019年的国际妇科肿瘤会议指南对于该分期的宫颈癌仍推荐扩大锥切手术或者单纯宫颈切除术,对于较大肿瘤根据肿瘤大小形态及位置行适形切除术。
妊娠期行淋巴分期仍有争议,目前只推荐在孕22周之前施行该术式。中晚孕期的全身麻醉是安全的,但孕期增大的子宫和充血的盆腔增加了手术难度[13]。随着前哨淋巴结的运用,越来越多的研究证明了其可行性及安全性,Papadia等[14]报道了2例宫颈注射吲哚菁绿后完成前哨淋巴结活检的患者,相较盆腔淋巴结清扫,减少了手术时间及手术相关风险。虽然有研究报道吲哚菁绿<5 mg/kg体质量静脉注射并不穿透胎盘[15],但吲哚菁绿FDA妊娠期药物分级为C类,妊娠期应用时应权衡利弊并充分告知患者及家属。
3.5 推荐剖宫产终止妊娠 建议剖宫产作为妊娠期间宫颈癌患者终止妊娠的方式,经阴道分娩可能会导致大出血、产道梗阻、感染、子宫颈裂伤、会阴切开或裂伤部位肿瘤种植以及新生儿的继发肿瘤等风险。目前为止,至少有20例会阴裂伤口或切口宫颈癌转移或复发的报道[16]。Arakawa等[17]报道了2例妊娠期宫颈癌患者经阴道分娩的男婴生后肺部转移的病例,经肿瘤组织次代测序证实为母体来源。
建议在34周左右行剖宫产终止妊娠,可同时行宫颈癌的手术治疗。对于接受新辅助化疗的患者,终止妊娠的时机应该选择在末次化疗3周后,根据患者对化疗的反应及孕周综合考虑,本研究1例患者行新辅助化疗后肿瘤直径从7 cm×6 cm×6 cm缩小到3 cm×3 cm×3 cm,并在末次化疗3周后行剖宫产+根治性手术。剖宫产切口建议纵切口或高位横切口,避免取下段切口引起肿瘤播散或影响肿瘤边缘的判断。术中仔细检查胎盘是否发生转移,必要时送病理检查。目前为止,仅Can等[18]报道1例胎盘转移的妊娠期宫颈癌患者,提示胎盘转移风险极低。产妇可以考虑在产后行母乳喂养。
3.6 妊娠期间肿瘤的生物学改变 妊娠期特殊的生理变化是否影响肿瘤的进展一直是近年讨论热点。理论上妊娠期特殊的免疫系统、较高的激素水平以及新生血管都有可能加快恶性肿瘤的进展。但基于广泛人群的研究发现妊娠期雌激素相关的一些肿瘤,如乳腺癌、黑色素瘤等与非孕期相比其总体生存率相似[19]。一项大型队列研究对比了516例妊娠期恶性肿瘤与42 511例非妊娠期恶性肿瘤的结局,发现两组在肿瘤相关性死亡方面无明显区别[20]。
综上所述,妊娠期间宫颈癌的治疗需要多学科会诊制定个体化治疗方案,建议患者就诊于含高水平妇科肿瘤专业及新生儿专业的综合性医院,以获得更好的母婴结局。新辅助化疗在妊娠期间宫颈癌的治疗中是相对安全有效的,但证据主要来自有限的个案报道及回顾性分析,需要更多的病例及更长时间的随访进一步验证新辅助化疗对妊娠期间宫颈癌母胎结局的改善。

