非洲辣木种子无菌萌发与组培再生体系的建立
覃玉凤,钟连香,魏秋兰,肖玉菲,覃子海
(广西壮族自治区林业科学研究院,广西 南宁 530002)
非洲辣木(Moringastenopetala)为辣木科(Moringaceae)辣木属(Moringa)植物,在热带、亚热带国家和地区广泛种植[1]。由于辣木含有丰富的氨基酸、维生素、蛋白质、活性酶类物质以及人体必需的矿物质元素,同时具有抗癌、消炎、降血压等功效,是良好的药食同源植物,也常被誉为“生命之树、奇迹之树”,其营养价值和药用价值已被广泛证实并被开发利用[2-4]。辣木又因其速生、耐旱、抗病性强以及经济效益好等特点成为世界上热门的多用途树种之一,使辣木日益受到重视[5]。
随着辣木的神奇功效和潜在市场价值的发现,对辣木的研究和开发日益增多,其化学成分的药理作用和营养成分研究均取得了较好进展。例如,辣木叶乙酸乙酯部位(M2)在浓度较低时对细胞氧化损伤有较好的保护作用[6];饶体宁等[7]报道了饲料中添加辣木叶提取物可以有效改善血清和蛋黄抗氧化性能、增加蛋鸭免疫球蛋白。同时,基于辣木良好的经济效益,辣木育苗技术[8]和栽培技术[9]也日益成为研究热点。目前,辣木的种子较为昂贵,传统的种子育苗已不能满足市场需要。为此,开展辣木组培快繁实验,建立植株再生体系是解决引种初期种苗缺乏问题的主要途径,可为推广辣木提供优质的种质资源。本研究通过对非洲辣木种子无菌萌发、不定芽诱导、增殖、生根培养基配方的研究,全面、系统地探讨适合非洲辣木组织培养的各项因素,以期建立一套非洲辣木组培快繁技术体系,为实现辣木组培工厂化育苗奠定技术基础。
1 试验材料与方法
1.1 试验材料
本试验以饱满、健康的非洲辣木种子为供试材料,种子原产于印度。
1.2 试验方法
1.2.1无菌苗的获得
选择饱满的非洲辣木种子,用清水洗净后,分别采用4种不同的处理方法进行消毒处理,然后用无菌水冲洗5次,将种子横卧接种于MS培养基(每升附加蔗糖30 g、琼脂3 g,pH为5.8)中,接种后置于培养室(自然光照、28 ℃)中培养,观察种子的污染率和发芽率。
1.2.2无菌苗诱导培养
当种子生长成为无菌苗时进行切断处理,将切好的无菌苗(2~2.5 cm)接种至培养基中,然后置于24 ℃暗室进行暗培养10 d,再转入正常光照培养,15 d后统计植株生长状况并计算诱导系数。基本培养基为MS、WPM、B5培养基,植物生长调节剂为6-BA(0.5、1.0、1.5 mg/L)、KT(0.2、0.4、0.6 mg/L),各试验因素构成L9(34)正交试验(表2),培养基中蔗糖浓度为30 g/L,琼脂浓度为3 g/L,pH 5.8。
1.2.3增殖培养
将诱导产生的不定芽切断处理(2 cm左右),转接到MS培养基中,植物生长调节剂为6-BA(0.4、0.6、1.2 mg/L)、KT(0.3、0.5 mg/L)(表3),蔗糖浓度为30 g/L,琼脂浓度为3 g/L,pH 5.8。接种后,先暗培养10 d,再转入正常光照培养。30 d后统计每个处理芽总数,计算增殖系数。
1.2.4生根培养
将增殖得到的无菌苗切成2 cm左右带顶尖的茎段,转接入以基本培养基1/2 MS的培养基上,添加NAA(0.5、1.0、1.5 mg/L)和IBA(0.4、0.5 mg/L)进行培养(表4),其中蔗糖浓度为30 g/L,琼脂浓度为3 g/L,pH 5.8。培养30 d后记录每瓶生根株数、每株生根条数和平均根长,计算生根率、株均根数和平均根长。
1.2.5炼苗及移栽
生根培养30 d后,将生根的试管苗移入大棚,拧松瓶盖,在自然光下炼苗1周后,取出生长健壮的生根苗,将基部的培养基洗干净,移至基质(泥炭土)中,每日淋足水分,30 d后统计移栽成活苗株数。
1.3 培养条件
培养温度为24 ℃,光照强度为6 000 lx,每天光照时间为14 h。
1.4 数据统计
利用Excel 2016对数据进行整理,采用SPSS 21.0对增殖系数、生根率、平均生根数和平均根长进行方差分析并采用邓肯新复极差法进行多重比较。
2 结果分析
2.1 外植体的消毒
不同消毒方法对种子萌发的影响效果见表1。

表1 不同消毒方法对种子萌发的影响
从表1可以看出,剥壳处理(处理3和处理4)辣木种子发芽率显著高于未剥壳处理(处理1和处理2),剥壳处理发芽率在70%以上,其中以处理3发芽率最高,达81.11%;未剥壳处理发芽率显著降低,发芽率均在50%以下。从污染率指标看,未剥壳处理污染率显著高于剥壳处理,污染率在40%以上。75%酒精和0.1%升汞不同消毒时间对辣木种子发芽率和污染率亦产生影响。消毒时间过短会出现大量霉菌,而消毒时间过长会影响种子活力,从而影响萌发率。从发芽率指标和污染率指标看,处理3(剥壳+清水0.5 h+75%酒精60 s+0.1%升汞10 min)更适用于辣木种子消毒,种子发芽率达81.11%,污染率仅为17.41%,既达到良好的消毒效果,又能避免种子活力受到损害。
2.2 不同培养基对不定芽诱导的影响
不同培养基与激素配比试验中辣木诱导系数存在差异,如表2所示。
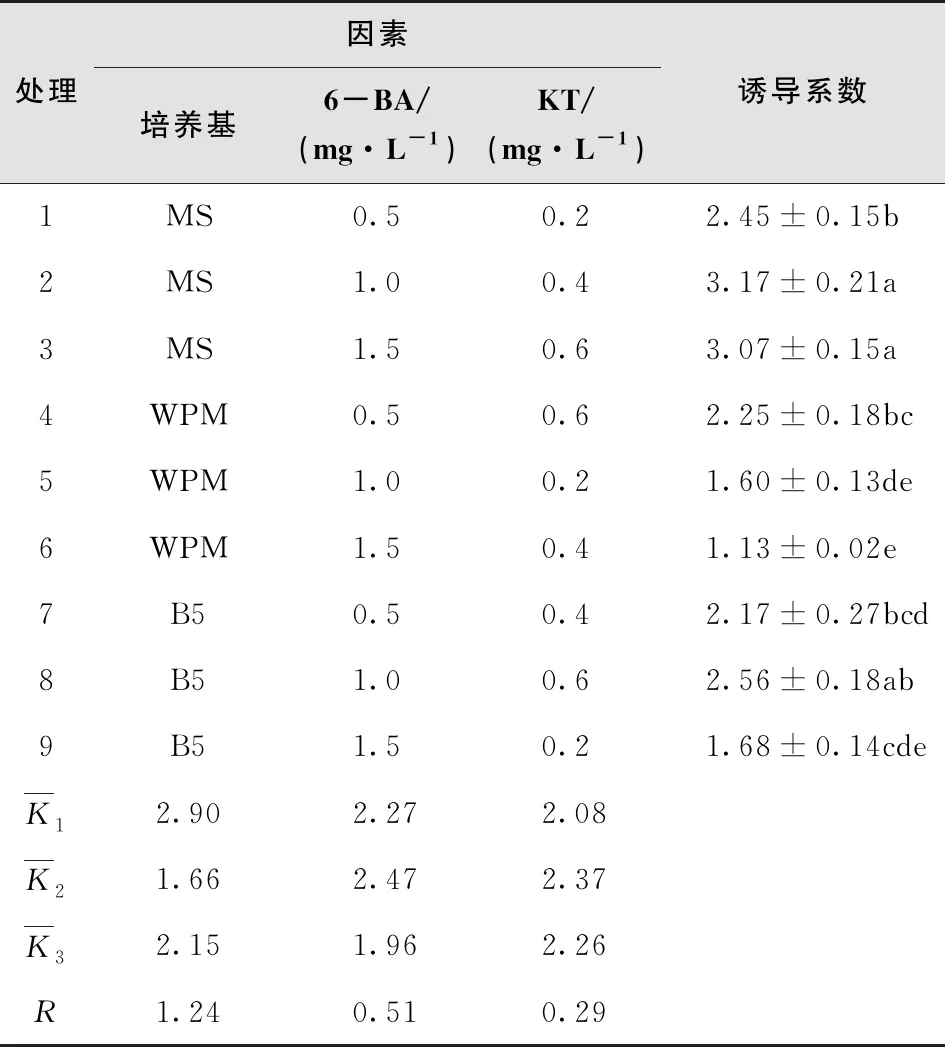
表2 不同培养基对非洲辣木的诱导效果
MS培养基更利于辣木诱导,而WPS培养基和B5培养基对辣木诱导效果表现较差。处理2(MS+6-BA 1.0 mg/L +KT 0.4 mg/L)和处理3(MS+6-BA 1.5 mg/L +KT 0.6 mg/L)诱导系数均达3.0以上,显著高于其他处理,其中处理2诱导系数最大(3.17)。从极差分析结果看,诱导系数各影响因素作用的主次顺序为:培养基>6-BA>KT(R培养基=1.24,R6-BA=0.51,RKT=0.29),故辣木不定芽诱导的最优培养基与激素配比为:MS+6-BA 1.0 mg/L+KT 0.4 mg/L。
2.3 不同激素对继代增殖的影响
不同浓度6-BA和KT组合对辣木增殖产生显著影响,各处理辣木增殖系数在2.8以上,如表3所示。

表3 不同激素对非洲辣木的增殖效果
6-BA和KT浓度过高或过低辣木的增值系数均会降低,如表3 所示,当6-BA浓度为0.6 mg/L、KT浓度为0.3 mg/L(MS+6-BA 0.6 mg/L+KT 0.3 mg/L)时辣木增殖效果最好,增殖系数达4.62,显著高于其他处理,说明该激素组合较适用于辣木增殖过程。
2.4 不同激素对生根的影响
以1/2 MS为培养基、NAA和IBA配比组合下,辣木生根率均达70%以上。当NAA浓度为1.0 mg/L时,辣木达到很好的生根效果,其中以处理4(1/2 MS+NAA 1.0 mg/L+IBA 0.5 mg/L)生根效果最好,生根率高达86.68%。从株均根数看,各处理生根数均在4.0条/株以上,处理3和处理4株均根数达5.0条以上,但与其余处理均未达显著差异(表4)。
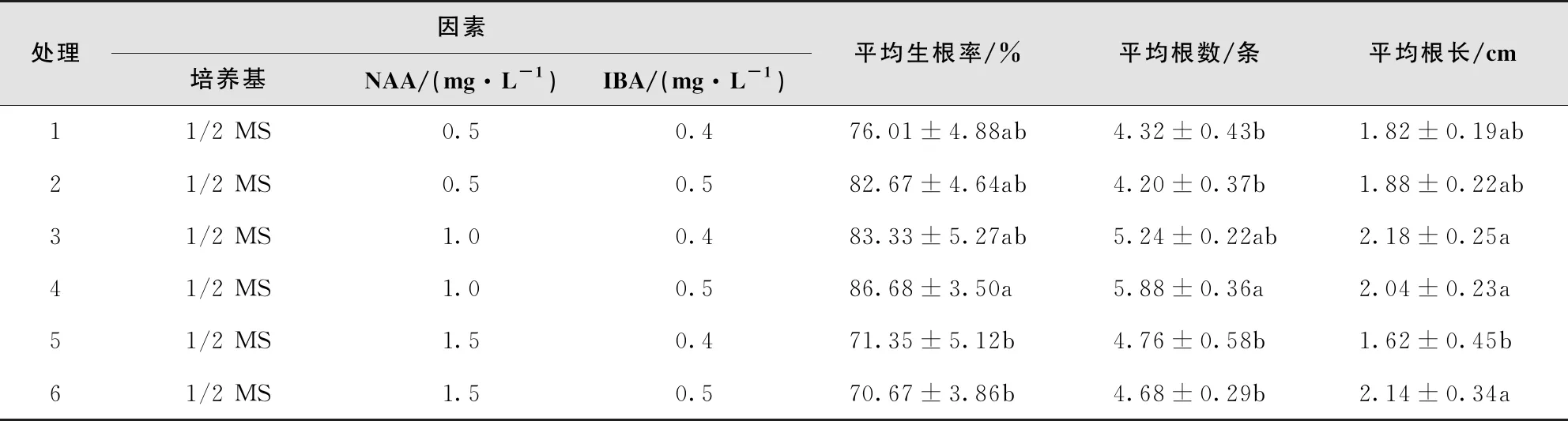
表4 不同激素对非洲辣木生根培养的效果
从平均根长指标看,处理3、处理4、处理6这3个处理平均根长达2.0 cm以上,平均根长最长的为处理3,达2.18 cm。综合分析可知,处理4较适用于辣木生根,生根率达86.68%,平均根数为5.88条/株,平均根长达到2.0 cm以上。
2.5 炼苗及移栽
试管苗在生根培养基上培养30 d,将生根的试管苗移入遮阴大棚,拧松瓶盖,在自然光下炼苗7 d后取出生长健壮的生根苗,将基部的培养基洗干净,移至消毒的泥炭土中,每日淋足水分,成活率达90%以上。
3 结论与讨论
在组织培养中可以通过种子消毒来获得无菌苗,其最主要的前提就是种子消毒剂的选择、搭配及消毒时间的掌握[10]。不同植物种子对不同消毒剂的耐受能力不同,种子消毒时间过长,在达到很好的灭菌效果的同时也会对种子造成损害,进而降低种子的发芽率,因而筛选出适宜的消毒剂和消毒时间很有必要。相关研究表明,外壳对辣木内部的种子起到保护作用,不剥壳可以提高发芽率[11],在不剥壳的情况下70%酒精浸泡30 s+0.1%升汞浸泡8 min,其成活率可达73.3%;但也有一些学者认为辣木外壳表面细菌较多,保留外壳会使污染率提高进而影响种子发芽[12]。而本研究结果显示,非洲辣木种子在剥壳的情况下发芽率较高,与黄洲[13]的研究结果一致,最佳的处理组合为清水0.5 h+75%酒精60 s+0.1%升汞10 min,采用此种处理方法种子发芽率达81.11%,且污染率低,植物受消毒剂的伤害小。
基本培养基与植物的生长发育密切相关,在植物组织培养的不同阶段所需的营养物质也存在差异[14]。实验结果显示,辣木不定芽诱导的最适培养基为MS培养基,与刘德承[15]和陈丽文等[16]的研究结果一致,表明MS培养基中较高浓度的NH4+和NO3-更适合非洲辣木不定芽的诱导。基本培养基只能使外植体存活下来,如果想要获得更加优质的试管苗,需要按照不同要求添加相应植物生长调节剂来促使其生长和分化,而决定植物形态发生启动和分化方向最重要的2个因素是生长素和细胞分裂素浓度配比。本实验选用的植物生长调节剂为6-BA和KT,其配比对实验结果起到关键作用。相关研究表明,高浓度6-BA作用下辣木侧芽生长明显,茎节距也会相应减小[17-18];当6-BA浓度高于0.6 mg/L时,增殖系数不增反降,且植株出现下部叶片黄化现象,这也说明过量的细胞分裂素对辣木产生不利影响。当6-BA浓度不变时,KT浓度高则增殖系数会相应降低,说明低浓度的KT更利于非洲辣木增殖。本研究亦得出结论:辣木在MS培养基上增殖效果较好,当6-BA 浓度为0.6 mg/L、KT 浓度为0.3 mg/L时,增殖效果最好,增殖系数达4.62。
研究结果显示,辣木在1/2 MS培养基上培养可达到很好的生根效果,当NAA浓度为1.0 mg/L、IBA浓度为0.5 mg/L时生根率高达86.68%。木本植物生根是离体培养的关键步骤[19],培养基种类、植物生长调节剂等对组培苗生根均会产生一定的影响。高浓度无机盐易使外植体切面产生愈伤组织,不利于生根,因而通常选用无机盐浓度较低的1/2 MS培养基进行生根诱导。有研究认为,IBA诱导出的根细长,无愈伤组织,根质量较好,苗木移栽成活率高,而NAA诱导出的根粗而短,且随NAA浓度增大愈伤组织增多,移栽成活率降低[20-21]。亦有研究报道,IBA、NAA和IAA等植物生长调节剂复合使用比单一使用更利于植物生根,且愈伤组织少,移栽成活率高[22]。
本研究中,非洲辣木种子无菌萌芽率高,继代增殖和生根培养效果理想,在工厂化育苗中具有重要的指导意义,后期将开展辣木继代增殖和生根过程中细胞形态及结构变化、生理活性变化等方面的研究,阐明其增殖和生根的机理机制,进一步优化非洲辣木组培再生体系。

