低氧胁迫对珍珠龙胆石斑鱼氧化应激及能量代谢的影响
陆泽峰,黄 和,黄湘湄,黄伟镇
低氧胁迫对珍珠龙胆石斑鱼氧化应激及能量代谢的影响
陆泽峰,黄 和,黄湘湄,黄伟镇
(广东海洋大学食品科技学院, 广东 湛江 524088)
【目的】探究保活运输中低氧胁迫对珍珠龙胆石斑鱼()氧化应激的影响。【方法】诱导体质量为(498.2 ± 27.3)g的杂交石斑鱼进入休眠状态,并放置在溶解氧为(1.74 ± 0.21)mg·L−1的低氧环境下,低氧胁迫0、6、12、24、48、72 h后,取样测定血清应激指标,肌肉、肝脏、鳃组织氧化应激指标及肌肉、肝脏能量利用指标。【结果】低氧胁迫过程中,杂交石斑鱼血糖含量在胁迫6 h时最大,72 h时恢复胁迫前水平;皮质醇含量在胁迫过程均显著高于胁迫前;肌肉超氧化物歧化酶(SOD)活性随胁迫时间的增加而上升,肝脏、鳃SOD活性先上升后下降;肌肉、肝脏过氧化氢酶(CAT)活性呈先升后降的趋势,鳃CAT活性在胁迫12、72 h显著低于胁迫前;肌肉、肝脏丙二醛(MDA)含量在胁迫过程中均增加,鳃MDA含量先降后升;肌肉谷胱甘肽还原酶(GSH)含量在胁迫12 h达到最大值,肝脏GSH含量呈先上升后下降的趋势,鳃中GSH含量在12 h时显著高于胁迫前,之后逐渐升高;总抗氧化能力(T-AOC)在肌肉、肝脏、鳃中均呈上升的趋势;肌肉和肝脏中糖原的含量显著减少,肌肉乳酸脱氢酶(LDH)活性显著增加,肝脏LDH先降后升。显著性水平均为0.05。【结论】低氧胁迫会刺激珍珠龙胆石斑鱼产生应激反应,影响体内正常的氧化应激系统,并对不同组织造成不同程度的氧化损伤。
珍珠龙胆石斑鱼;低氧胁迫;氧化应激;能量代谢
溶解氧是影响鱼类生存的重要环境因素之一。由于水温变化、昼夜更替及生物呼吸作用变化,水体溶解氧含量不断变化[1]。一般地,水体溶解氧含量维持在4.0 mg·L−1以上时,鱼类才能正常的生长繁殖;在低氧环境下,易诱发鱼体氧化应激反应[2],导致呼吸、代谢紊乱[3],影响自身正常生理机能和组织器官功能[4],甚至导致鱼体死亡。
珍珠龙胆石斑鱼(),俗称龙虎斑或珍珠斑。其营养丰富,味道鲜美,深受广大消费者的喜爱。我国珍珠龙胆石斑鱼的人工养殖地主要集中在东南沿海地区,并主要通过有水运输的方式将鲜活鱼体输送到各地[5-6]。在集约化养殖中,通常使用空气泵充氧或用循环水系统使溶解氧保持在较稳定水平(> 5 mg/L)[7],在长距离运输过程中,溶解氧含量易受水质变化、人为操作等影响而减少,造成急性低氧应激。目前,少见关于低氧胁迫对珍珠龙胆石斑鱼应激胁迫的研究报道。本研究通过静态模拟珍珠龙胆石斑鱼的保活运输过程,探究该石斑鱼在低氧胁迫下不同组织氧化应激和能量利用指标变化,为珍珠龙胆石斑鱼保活运输提供理论依据。
1 材料与方法
1.1 材料
实验用珍珠龙胆石斑鱼于2021年4月购自湛江市霞山东风水产品批发市场,体表无损伤,健康无病害,体质量为(498.2 ± 27.3)g,加水充氧运至广东海洋大学第三实验楼实验室暂养24 h。暂养水温(18 ± 0.2)℃,盐度23,溶解氧含量7 mg·L−1,暂养期间不投喂。
1.2 实验设计
随机选取体质良好的石斑鱼60尾,每组20尾随机放入3个100 cm × 80 cm × 70 cm养殖箱,进行低氧胁迫实验。参照一般鱼类缺氧临界值(4.0 mg·L−1)及休眠状态下石斑鱼在预实验中的窒息点(0.17 ± 0.02)mg·L−1,设置溶解(1.74 ± 0.21)mg·L−1的低氧水平。参考朱乾峰等[8]的降温模式,诱导石斑鱼进入休眠状态,通过覆盖薄膜和往水中通入氮气,1 h内将水体溶解氧质量浓度降至(1.74 ± 0.21)mg·L−1,保持水温15℃,静态模拟石斑鱼保活运输过程,进行为期72 h的低氧胁迫实验。每30 min 根据HJ 506-2009,用SG68便携式多参数测试仪监测水体溶解氧变化,通过调节通入氮气和空气的量稳定实验所需的溶解氧含量。
1.3 样品制备与采集
在低氧胁迫前(0 h)以及胁迫6、12、24、48、72 h时每平行组随机抽取鱼3尾。将石斑鱼快速取出,于装有200 mg·L-1间氨基苯甲酸乙酯甲磺酸盐(MS-222)海水的塑料箱中快速麻醉,用蒸馏水冲洗鱼体表面黏液和残留的麻醉剂,用纱布擦干体表,用10 mL一次性无菌注射器进行尾静脉采血,置4 ℃冰箱静置2 h,以4 ℃、3 000 r·min-1离心20 min,取血清,分装,放入- 80℃冰箱保存。采血后剖取鱼体肌肉、肝脏和鳃组织,用质量分数0.9%生理盐水冲洗,用吸水纸吸干水分,置液氮中速冻,于- 80 ℃下保存待测。取肌肉、肝脏、鳃各1.0 g,剪碎,加入9倍 [质量(g) 体积比(mL) ] 的预冷生理盐水,在冰水浴中匀浆,离心(4 ℃、3 000 r·min-1、10 min),取上清液,测定相关指标。
1.4 样品测定
血清指标包括血糖和血清皮质醇,分别用上海荣盛生物药业有限公司和江苏泽雨生物科技有限公司的相应试剂盒按说明书测定。肌肉、肝脏、鳃组织中氧化应激指标包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性、还原性谷胱甘肽(GSH)、丙二醛(MDA)含量和总抗氧化能力(T-AOC)。能量代谢指标包括肌肉和肝脏中糖原(Gn)含量和乳酸脱氢酶(LDH)活性。以上试剂盒购于南京建成生物工程研究所,具体检测方法按照试剂盒说明书进行。
1.5 数据处理与分析
利用JMP Pro 14.0统计分析软件对实验数据进行单因素方差分析,运用Tukey-kramer HSD进行显著性检验,以< 0.05作为差异显著的标准。实验数据用平均数± 标准差表示。
2 结果
2.1 低氧胁迫对珍珠龙胆石斑鱼血糖和皮质醇的影响
图1可见,在低氧胁迫下,珍珠龙胆石斑鱼血清中血糖含量主要呈先升高后下降的变化趋势,在胁迫6 h时,血糖含量最高,是胁迫前的2.74倍,随着胁迫时间增长,在72 h时,血糖浓度逐渐下降至胁迫前水平(> 0.05)。
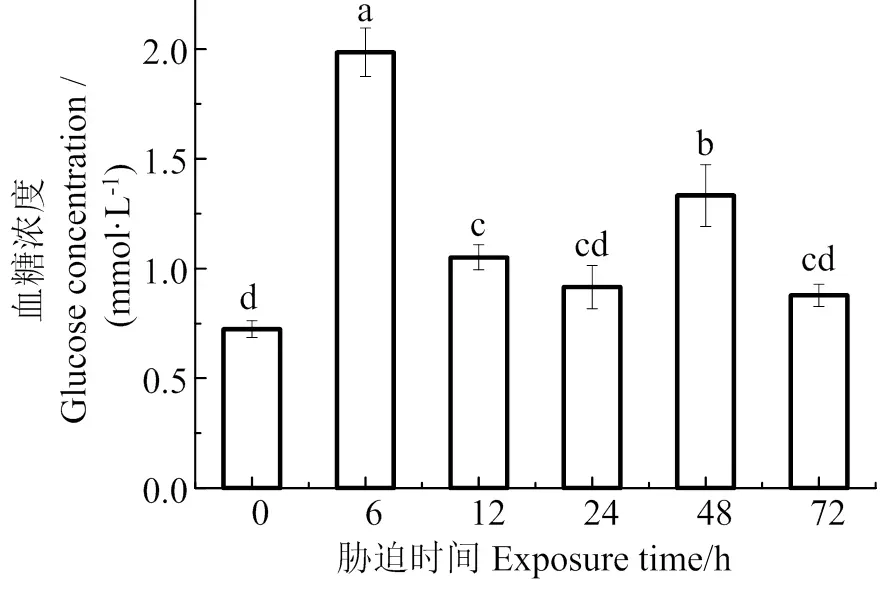
数据间凡含一个相同字母则两者差异不显著(P > 0.05)
图2可见,在低氧胁迫过程中,血清皮质醇含量主要呈上升-下降-上升的波动变化趋势,但胁迫过程中皮质醇含量均显著高于胁迫前(< 0.05),在胁迫6 h时血清皮质醇的平均含量最高,是胁迫前的1.44倍。
2.2 低氧胁迫对珍珠龙胆石斑鱼各组织氧化应激指标的影响
图3表明,随着低氧胁迫时间的增加,珍珠龙胆石斑鱼肌肉SOD活性呈增加趋势,且均显著高于胁迫前水平(< 0.05);肝脏SOD活性随胁迫时间的持续先上升后下降趋势,胁迫6 h时平均值最大,72 h时仍保持较高水平,显著高于胁迫前(< 0.05),是胁迫前的14.19倍;鳃SOD活性在低氧胁迫6 h时显著高于胁迫前(< 0.05),之后持续保持较高水平。

数据间凡含一个相同字母则两者差异不显著(P > 0.05)

同组织数据间凡含一个相同字母则两者差异不显著(P > 0.05)
图4表明,低氧胁迫6 h时肌肉CAT活性与胁迫前差异不显著(> 0.05),在胁迫12 h时,CAT活性显著增加达到最大值(< 0.05),在胁迫24、48、72 h时,CAT活性有所下降,但仍显著高于胁迫前(< 0.05);肝脏CAT活性在胁迫6 h平均值最高,是胁迫前的1.39倍(< 0.05),随后降低,在72 h时恢复到胁迫前水平(> 0.05);鳃CAT活性在胁迫12 h、72 h时显著低于胁迫前(< 0.05),在其余时间点与胁迫前差异不显著(> 0.05)。

同组织数据间凡含一个相同字母则两者差异不显著(P > 0.05)
图5可见,肌肉MDA含量随胁迫时间的持续总体上呈增加趋势,在胁迫12 h时,肌肉MDA含量与胁迫前差异显著(< 0.05);肝脏MDA含量呈先升后降趋势,在胁迫6 h时最高(< 0.05),之后持续保持较高水平;鳃组织中MDA含量在胁迫6、12、24 h时显著低于胁迫前(< 0.05),48、72 h时MDA含量迅速增加,显著高于胁迫前(< 0.05)。
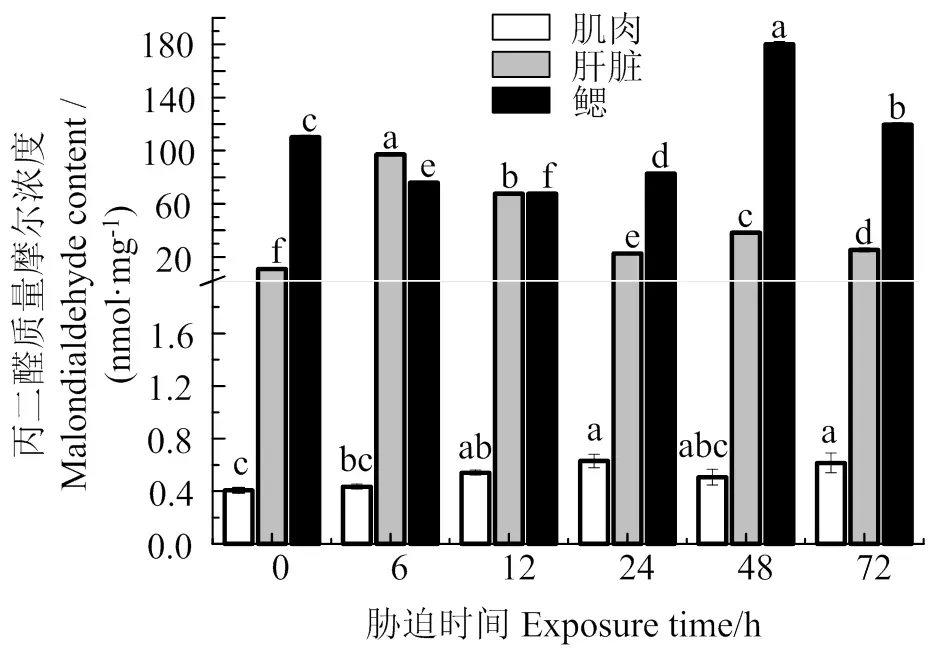
同组织数据间凡含一个相同字母则两者差异不显著(P > 0.05)
图6表明,低氧胁迫下,肌肉GSH含量在胁迫6、24、48、72 h时显著低于胁迫前(< 0.05),在胁迫12 h时最大,显著高于胁迫前(< 0.05),是胁迫前的1.25倍;肝脏GSH含量随着胁迫时间的延长,呈先增加后减少的趋势,胁迫72 h后,GSH含量显著减少(< 0.05),是胁迫前的0.23倍;鳃GSH含量在胁迫6 h时与胁迫前差异不显著(> 0.05),之后随胁迫时间的持续,GSH含量持续增加,各组与胁迫前差异显著(< 0.05)。
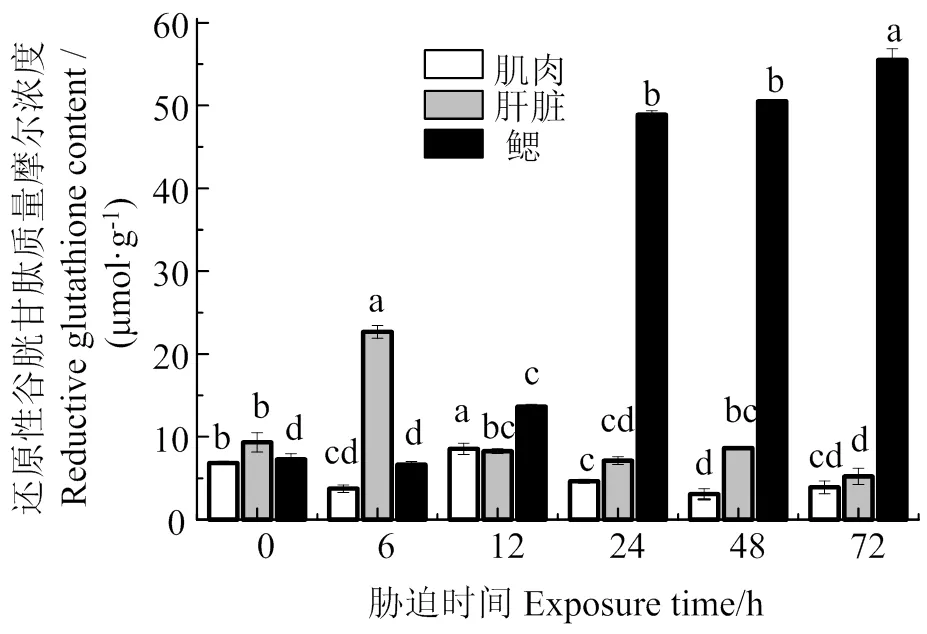
同组织数据间凡含一个相同字母则两者差异不显著(P > 0.05)
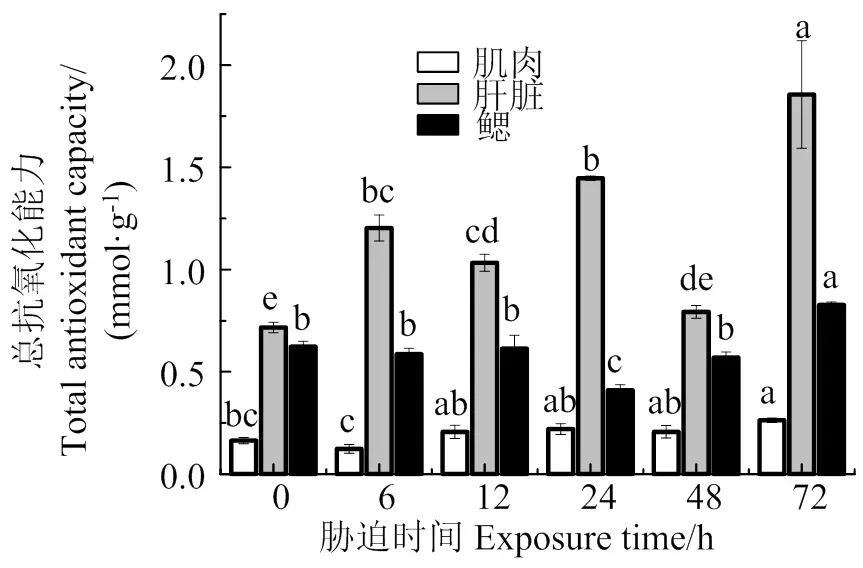
图7表明,随着胁迫时间的持续,肌肉总抗氧化能力总体上缓慢增加,在72 h时T-AOC活性最大,与胁迫前差异显著(< 0.05);肝脏T-AOC活性在48 h时和胁迫前差异不显著(> 0.05),其余各组均显著高于胁迫前(< 0.05);鳃T-AOC活性在6、12、48 h时和胁迫前差异不显著(> 0.05),在24 h时显著低于胁迫前(< 0.05),在72 h时达到最大值,显著高于胁迫前(< 0.05)。
2.3 低氧胁迫对珍珠龙胆石斑鱼能量利用的影响
图8可见,随着胁迫时间的延长,肌肉和肝脏中糖原含量总体上呈降低趋势(< 0.05),在胁迫72 h时肌糖原和肝糖原分别为胁迫前0.05、0.12倍。图9表明,肌肉LDH活性随着胁迫时间的持续,总体上呈增加的趋势,且各组均显著高于胁迫前(< 0.05);肝脏LDH活性,在胁迫6 h时,显著低于胁迫前(< 0.05),随着低氧胁迫时间的持续,LDH活性不断增加,在72 h时达到最大值(< 0.05)。
同组织数据间凡含一个相同字母则两者差异不显著(P > 0.05)
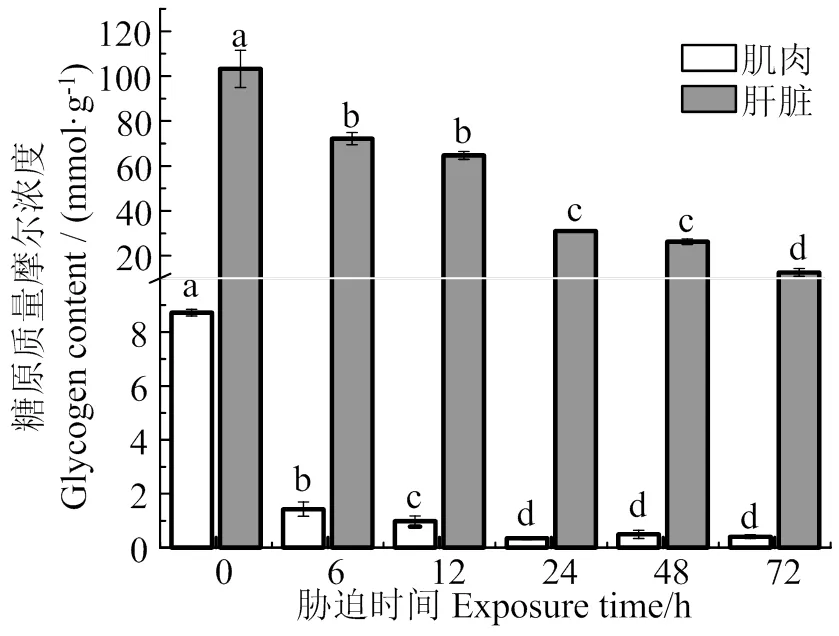
同组织数据间凡含一个相同字母则两者差异不显著(P > 0.05)
Fig. 8 Effects of hypoxia stress on glycogen content in muscle and liver of

同组织数据间凡含一个相同字母则两者差异不显著(P > 0.05)
Fig. 9 Effects of hypoxia stress on lactate dehydrogenase activity in muscle and liver of
3 讨论
3.1 低氧胁迫对珍珠龙胆石斑鱼血糖和皮质醇的影响
血糖是重要的能量供给物质,鱼体血糖值维持在一定范围内,才能维持正常的生命活动。血糖的含量受胰岛素和肾上腺素等激素及机体其他调节,极易受外界因子刺激而发生波动[2,9]。皮质醇和血糖常用作反映鱼体应激的指示性指标,当鱼体受到刺激产生应激时,会引起体内各项激素水平的变化,皮质醇为应激反应系统分泌的最后一种激素,随着应激强度的增大而分泌量增加[10]。
本研究中,珍珠龙胆石斑鱼在低氧胁迫6 h时,血清中血糖和皮质醇的含量显著上升,表明鱼体在低氧环境下对缺氧产生应激反应,机体通过激素调节,分泌皮质醇刺激糖的合成、脂肪的分解和糖原的分解,引起血糖浓度升高,同时产生大量能量,以满足鱼体自身的能量需求。这与尼罗罗非鱼()[11]、军曹鱼()[12]和大西洋鲑()[13]的结果类似。但随着胁迫时间的持续和饥饿的作用下,血糖含量降低,在低氧胁迫72 h时恢复到胁迫前水平,而皮质醇的含量持续保持在较高的水平,说明鱼体在低氧胁迫过程中一直处于应激状态,机体组织持续缺氧,无氧呼吸增强,大量消耗葡萄糖,同时皮质醇持续分泌,提供大量能量,满足各组织对能量的需求,这与团头鲂()的结果类似[14],表明珍珠龙胆石斑鱼可通过增强对葡萄糖等消耗利用,缓解缺氧应激对机体造成的损伤。
3.2 低氧胁迫对珍珠龙胆石斑鱼各组织氧化应激指标的影响
当珍珠龙胆石斑鱼受到胁迫时,其体内活性氧(ROS)含量急剧增加,而过量的ROS会促进细胞膜脂质过氧化,从而对机体造成氧化损伤[15]。机体抗氧化系统由酶促系统和非酶促系统组成。酶促系统包括SOD、CAT、T-AOC等抗氧化酶[16],可清除体内过量ROS和由ROS产生的超氧阴离子自由基(O2-),减缓对机体的氧化损害[12,17]。非酶促系统主要包括MDA、GSH等氧化产物和其他非酶类抗氧化剂[18]。
肌肉控制着鱼体的运动,肝脏是鱼体主要的代谢中心,鳃是鱼体重要的呼吸器官,有研究表明不同的组织在应对低氧胁迫时的能力不同[19],测定不同组织中抗氧化酶活性的变化,能体现各组织抗氧化能力的强弱以及在胁迫中受损程度。本研究中,暂无对血清抗氧化指标变化的研究,略有不足,这将作为日后进一步研究的方向。
本研究中,在低氧胁迫后,珍珠龙胆石斑鱼各组织SOD活性显著高于胁迫前,各组织T-AOC活性在胁迫过程中呈波动性变化,胁迫72 h时最大,说明在胁迫过程中,机体持续受到氧化损伤,刺激机体的抗氧化系统,各组织SOD和T-AOC响应性增高,保护组织不受氧化损伤。这与泥蟹 () 在(3.0 ± 0.2)mg/L的中度缺氧环境下胁迫24 h后鳃组织SOD和T-AOC活性显著高于胁迫前的结果相似[20]。CAT可将SOD消除ROS、O2-而产生的H2O2转化为H2O,保护机体细胞内环境的稳定[2]。本研究中,肌肉CAT活性呈先增加后略有回落的趋势,可能因为肌肉SOD活性不断增强,产生过多H2O2,刺激CAT的活性显著升高。而在肝脏中,CAT活性随着胁迫时间的延长先升后降,逐渐恢复到胁迫前水平,可能与肝脏中抗氧化酶类体系比较活跃,清除ROS的能力较强有关。这与黄颡鱼()在低氧胁迫后,血清CAT活性显著增加,但随胁迫时间延长活性逐渐下降的结果类似[21]。胁迫72 h后,鳃组织中CAT活性显著低于胁迫前,表明随着胁迫时间的延长,鳃组织受到的氧化应激加剧,鳃组织中抗氧化物质合成能力下降,氧化—抗氧化失衡,导致鳃组织中CAT活性显著下降[12]。
MDA属于脂质过氧化物,反映机体的氧化损伤程度[22]。本研究中,肝脏MDA含量在胁迫后均显著高于胁迫前,肌肉MDA含量在胁迫12 h后显著高于胁迫前,说明鱼体在低氧胁迫过程中,肌肉和肝脏氧化损伤程度不断加重,使细胞脂质过氧化反应加剧,导致MDA大量生成,而鳃组织MDA含量在胁迫初中期显著低于胁迫前,这可能是在缺氧环境下,珍珠龙胆石斑鱼有氧呼吸受抑制,氧气经过线粒体呼吸链减少,线粒体产生的ROS相应减少,鳃组织细胞受到的氧化损伤相应减少[23],与瓦氏黄颡鱼()[24]的结果相似。GSH是有重要解毒功能的非酶抗氧化剂,可消除体内自由基[19]。本研究中,在低氧胁迫下,肌肉和肝脏GSH含量分别在12 h和6 h时最大,之后随着时间的延长不断降低,在72 h时显著低于对照水平,说明在胁迫过程中,肌肉和肝脏通过合成和转化产生大量的GSH,配合组织中的抗氧化酶清除ROS,后期GSH的含量减少,可能与组织受到的氧化损伤得到缓解有关[18];鳃组织GSH含量不断增加,说明鳃组织中ROS积累程度不断加深,需更多的GSH消除ROS,与翘嘴鳜()[25]结果类似。说明鳃组织相比肌肉和肝脏,更易受到低氧胁迫的影响。
3.3 低氧胁迫对珍珠龙胆石斑鱼能量利用的影响
糖原是机体维持正常生命活动的主要能源物质[6]。糖原含量降低,糖酵解活性增加,表明糖代谢在鱼类应对急性缺氧应激起重要的能量供应作用,当水体溶解氧不能满足有氧糖酵解的需氧量时,需要依靠厌氧糖酵解产生能量满足缺氧应激期间鱼体的能量需求[26]。LDH可催化丙酮酸和乳酸之间的转化,参与糖的无氧酵解和糖异生作用,为生命活动提供能量,其活性大小在一定程度上可反映无氧呼吸的强弱和鱼体耐受低氧的能力[27]。本研究中,在低氧胁迫下,肌肉和肝脏糖原含量随胁迫时间的延长而不断下降,LDH活性总体上随胁迫时间的延长而增加,说明肌肉和肝脏组织缺氧情况加剧,有氧呼吸供能不足,无氧呼吸增强,分解肌糖原和肝糖原,满足机体正常的能量代谢,这与军曹鱼[23]和尼罗罗非鱼[26]在急性低氧胁迫后,肝脏和肌肉糖原含量急剧下降,LDH含量急剧上升的结果类似。同时低氧环境下诱导LDH活性增强,LDH可通过催化乳酸转化为丙酮酸,减少肌肉和肝脏中乳酸的积累,以保护组织免于缺氧损伤。
4 结论
低氧胁迫对珍珠龙胆石斑鱼生理代谢产生显著影响,激活鱼体内抗氧化系统,增强氧化应激防御机制,通过激素调节和加强无氧呼吸供能,保障机体拥有充足的能量来适应缺氧环境下生理代谢的变化。在缺氧过程中,珍珠龙胆石斑鱼不同组织应对缺氧带来的氧化压力能力不同,肝脏氧化防御体系较发达,鳃组织受损情况较为严重。
[1] 陈付菊, 付生云, 令小东, 等. 低氧胁迫对青海湖裸鲤肌肉线粒体呼吸链复合体酶及抗氧化酶活性的影响[J]. 广东海洋大学学报, 2021, 41(6): 126-132.
[2] 郭志雄, 曾泽乾, 黄建盛, 等. 急性低氧胁迫对大规格军曹鱼幼鱼肝脏氧化应激、能量利用及糖代谢的影响[J]. 广东海洋大学学报, 2020, 40(3): 134-140.
[3] 林星桦, 叶明慧, SEATAN Wanida, 等. 多鳞鱚基因家族序列特征及其在低氧胁迫后表达变化[J]. 广东海洋大学学报, 2020, 40(6): 1-8.
[4] RICHARDS J G. Physiological, behavioral and biochemical adaptations of intertidal fishes to hypoxia[J]. Journal of Experimental Biology, 2011, 214(2): 191-199.
[5] 范秀萍, 秦小明, 章超桦, 等. 珍珠龙胆石斑鱼肌肉营养成分与挥发性风味成分的分析与评价[J]. 广东海洋大学学报, 2018, 38(1): 39-46.
[6] 范秀萍, 秦小明, 章超桦, 等. 温度对有水保活石斑鱼代谢与鱼肉品质的影响[J]. 农业工程学报, 2018, 34(14): 241-248.
[7] 赵骏凯, 张健东, 陈刚, 等.循环水系统养殖杂交石斑鱼的运行效果[J]. 广东海洋大学学报, 2019, 39(2): 118-125.
[8] 朱乾峰, 陈鹏文, 范秀萍, 等. 珍珠龙胆石斑鱼低温有水保活条件优化[J]. 食品工业科技, 2018, 39(22): 276-282.
[9] 区又君, 范春燕, 李加儿, 等. 急性低氧胁迫对卵形鲳鲹选育群体血液生化指标的影响[J]. 海洋学报, 2014, 36(4): 126-131.
[10] 吴波, 谢晶. 石斑鱼有水活运工艺中温度、盐度的优化[J]. 食品科学, 2019, 40(16): 235-241.
[11] SHENG Y, HUA Z Y, YANG Z, et al. Effects of acute hypoxic stress on biochemical parameters, immune regulation and metabolic capacity of the blood in genetically improved farmed tilapia (GIFT,)[J]. Journal of Applied Ichthyology, 2019: jai.13930.
[12] 王维政, 曾泽乾, 黄建盛, 等. 低氧胁迫对军曹鱼幼鱼生长、血清生化和非特异性免疫指标的影响[J]. 海洋学报, 2021, 43(2): 49-58.
[13] OLDHAM T, NOWAK B, HVAS M, et al. Metabolic and functional impacts of hypoxia vary with size in Atlantic salmon[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2019, 231: 30-38.
[14] 王燚纬. 低氧、养殖密度对团头鲂生理生化指标和组织结构的影响[D]. 上海: 上海海洋大学, 2019..
[15] BAO J, LI X D, XING Y N, et al. Effects of hypoxia on immune responses and carbohydrate metabolism in the Chinese mitten crab,[J]. Aquaculture Research, 2020, 51(7): 2735-2744.
[16] 陈付菊, 赵宇田, 付生云, 等. 溶解氧水平对青海湖裸鲤体肾组织结构及抗氧化酶活性的影响[J/OL]. 水生生物学报: 1-12 (2021-04-29) [2021-07-14]. http://kns.cnki.net/ kcms/detail/42.1230.Q.20210429.1329.002.html.
[17] 杨明, 孙盛明, 傅洪拓, 等. 低氧和复氧对日本沼虾抗氧化酶活力及组织结构的影响[J]. 中国水产科学, 2019, 26(3): 493-503.
[18] 齐明, 侯懿玲, 刘韬, 等. 急性低氧胁迫和复氧恢复对青田田鱼幼鱼氧化应激和能量代谢的影响[J]. 淡水渔业, 2020, 50(6): 92-98.
[19] 熊向英, 黄国强, 彭银辉, 等. 低氧胁迫对鲻幼鱼生长、能量代谢和氧化应激的影响[J]. 水产学报, 2016, 40(1): 73-82.
[20] JIE Y K, CHENG C H, WANG L C, et al. Hypoxia-induced oxidative stress and transcriptome changes in the mud crab ()[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2021, 245: 109039.
[21] 杨凯. 溶氧水平对黄颡鱼生长、代谢及氧化应激的影响[D]. 武汉: 华中农业大学, 2010.
[22] 李根瑞, 任利华, 孙国华, 等. 低溶氧胁迫对刺参()氧化应激指标的影响[J]. 渔业科学进展, 2016, 37(5): 133-139.
[23] 李洪娟, 陈刚, 郭志雄, 等. 军曹鱼()幼鱼对环境低氧胁迫氧化应激与能量利用指标的响应[J]. 海洋学报, 2020, 42(4): 12-19.
[24] 张国松. 瓦氏黄颡鱼()应对低氧胁迫的分子机制研究[D]. 南京: 南京师范大学, 2017.
[25] 徐畅, 丁炜东, 曹哲明, 等. 急性低氧胁迫对翘嘴鳜抗氧化酶、呼吸相关酶活性及相关基因表达的影响[J]. 南方农业学报, 2020, 51(3): 686-694.
[26] LI M X, WANG X D, QI C L, et al. Metabolic response of Nile tilapia () to acute and chronic hypoxia stress[J]. Aquaculture, 2018, 495: 187-195.
[27] 孙俊霄, 韩广坤, 刘娅, 等. 杂交黄颡鱼与普通黄颡鱼幼鱼生长性能及耐低氧能力的比较[J]. 水生生物学报, 2019, 43(6): 1271-1279.
Effects of Hypoxic Stress on Antioxidant and Energy Metabolism of Hybrid Grouper (♀×♂)
LU Ze-feng, HUANG He, HUANG Xiang-mei, HUANG Wei-zhen
(,,524088,)
【Objective】To explore the effects of hypoxia stress on oxidative stress of hybrid grouper () during actual survival transportation. 【Methods】Hybrid groupers[(498.2 ± 27.3)g] were induced to enter a dormancy state and placed in hypoxic environment with the dissolved oxygen content of (1.74 ± 0.21) mg·L−1. After 0, 6, 12, 24, 48 and 72 h of hypoxic stress, serum stress index, oxidative stress index of muscle, liver and gill and energy utilization index of the muscle and liver were measured. 【Result】Under hypoxia stress, the serum blood glucose content reached the maximum at 6 hand recovered to the pre-stressed level at 72 h. The cortisol level during stress was significantly higher than that of the before stress. Superoxide dismutase (SOD) activity in the muscle increased with stress time, while SOD activity in the liver and gill increased initially and then decreased. Catalase (CAT) activity in the muscle and liver increased firstly and then decreased, and CAT activity in gill was significantly lower than before stress for 12 and 72 h. Malondialdehyde (MDA) content increased in muscle and liver, but decreased first and then increased in the gill. The content of glutathione reductase (GSH) in muscle reached the maximum value at 12 h, the content of GSH in liver increased firstly and then decreased, and the content of GSH in gills was significantly higher than before stress at 72 h. The total antioxidant capacity (T-AOC) increased in the muscle, liver and gill. Glycogen content in the muscle and liver was significantly reduced and lactate dehydrogenase activity significantly increased. The significance levels used in all tests were< 0.05. 【Conclusion】The results showed that hypoxic stress can stimulate the stress response of hybrid grouper (), affect the normal oxidative stress system, and cause different degrees of oxidative damage to different tissues.
; hypoxia stress; oxidative stress;energy metabolism
S981.16
A
1673-9159(2022)01-0013-07
10.3969/j.issn.1673-9159.2022.01.003
陆泽峰,黄和,黄湘湄,等. 低氧胁迫对珍珠龙胆石斑鱼氧化应激及能量代谢的影响[J]. 广东海洋大学学报,2022,42(1):13-19.
2021-09-04
“十三五”国家重点研发计划重点专项(2019YFD0901605)
陆泽峰(1997―),男,硕士研究生,研究方向为水产品贮藏与加工。E-mail:luzefeng2021@163.com
黄和(1962―),男,教授,研究方向为水产品质量安全研究。E-mail: zjhahe@163.com
(责任编辑:刘庆颖)

