捕食线虫真菌在无菌土壤中的竞争与共存机制初探
刘李蕾,邓 巍,杨晓燕,2,3,肖 文,2,3,佘 容,3*
(1.大理大学东喜玛拉雅研究院,云南大理 671003;2.云南省中国三江并流区域生物多样性协同创新中心,云南大理 671003;3.大理大学三江并流区域生物多样性保护与利用省创新团队,云南大理 671003)
物种多样性的形成和维持机制是生物多样性研究的核心和前沿问题之一〔1〕。为回答这一问题,生态学家们进行着不懈的努力,提出了许多理论和假说,但目前仍存在许多争论,其焦点是物种的竞争与共存的关系〔2〕。传统的竞争排斥理论认为,如果不出现分化,生态位完全相同的2个竞争物种就不能稳定共存于同一生境中〔3〕。现代竞争共存理论则提出,即使物种间存在强烈的竞争,如果物种具有相似的竞争能力或竞争被某些外部因素削弱,互相竞争的物种也可以共存〔4〕。
微生物是生态系统的重要组成部分,直接或间接地参与生态系统的各个环节〔5〕,是从微观角度研究生态系统动态变化和功能关系的重要指标〔6-7〕,其群落构建与维持机制已成为目前微生物生态学研究的重点领域〔8〕。土壤生态系统中微生物物种多样性形成和维持的影响因素(生物和非生物)较多〔9〕,土壤生态系统所含微生物种群结构复杂、数量庞大,绝大部分土壤微生物又难以培养〔7〕,这导致了土壤生态系统中的微生物种间竞争与共存关系尚存在较大争议〔4〕,其研究远滞后于动植物〔6〕。因此,选择一个易于分离、培养、观察和计数的微生物类群,在少干扰因素的环境下逐步开展微生物种间竞争与共存关系的研究是非常必要的。
捕食线虫真菌(nematode-trapping fungi,NTF)是一类广泛分布于各种生境的具有生防价值的真菌,其既可营腐生生活,又可以营养菌丝特化形成捕食器官(三维菌网、收缩环、黏球、非收缩环、黏性分枝)以捕食线虫为生〔10〕。该类型真菌生长繁殖速度快、种类少(仅3属97种,具三维菌网的Arthrobotrys属有54种;具非收缩环、黏球的Dactylella属有29种;具收缩环的Drechslerella属有14种)〔11-12〕。实验室条件下容易分离、培养,低倍镜下(80×)即可见,易于计数。Arthrobotrys属因具有生长快和腐生能力强的特点,是各种生境中的优势种属〔13-14〕。少孢节丛孢(Arthrobotrys oligospora)、弯孢节丛孢(Arthrobotrys musiformis)、奇妙单顶孢(Arthrobotrys thaumasium)3种均为该属中的常见种,相互之间形态差异较大、易区分〔11〕。因此,本研究以无菌土为营养基质,将上述3种NTF以单独、同时和不同顺序的植入方式植入到无菌土中,每隔7 d检测3种NTF的检出率,连续检测11周,分析不同种NTF的竞争与共存关系,研究结果将有助于对微生物多样性形成和维持机制的了解。
1 材料与方法
1.1 菌株实验菌株由大理大学东喜玛拉雅研究院菌种资源中心提供,菌种编号分别为:JA52(A.oligospora)、JA15(A.musiformis)、JA109(A.thaumasium),采用土管法室温保存于大理大学东喜玛拉雅研究院菌种资源中心。
1.2 培养基及菌苔制备制备玉米粉琼脂固体培养基(corn meal agar medium,CMA):取20 g玉米粉、20 g琼脂,加入1 000 mL蒸馏水〔11〕,高压灭菌后冷却至45℃倾倒于培养皿。将菌种接种于CMA,26.5℃培养7 d后备用。
1.3 基质-无菌土壤自大理大学茶园采集土层3~50 cm处的湿润、肥沃土壤,去除较大的颗粒物及树根,过20目筛,取筛下土壤密封保存后带回实验室,121.3℃高压灭菌30 min,隔夜再灭菌1次以杀死产芽孢类微生物,获得无菌土壤。将其分为30份,每份100 g,放入自封袋中,置于阴暗干燥的室温条件下保存备用。
1.4 诱饵线虫的制备采用燕麦培养基培养全齿复活线虫(Panagrellus redivivus),贝尔曼漏斗法分离出线虫后,用无菌水稀释为5 000条/L的诱饵线虫悬浮液,备用〔11〕。
1.5 微宇宙实验以直径6 mm的无菌打孔器自培养好的CMA培养皿上取菌苔,按不同方式人工植入无菌土壤中。见表1。每种植入方式重复5次,每份无菌土壤中合计植入菌苔15个;混合植入时,每个菌种各植入5个菌苔。混匀后室温培养,并以植入菌种时间为起点,每隔7 d对土样进行NTF检测,连续检测11周,实验结束时共采集2 750个样品。见图1。

表1 菌种植入方式及次序
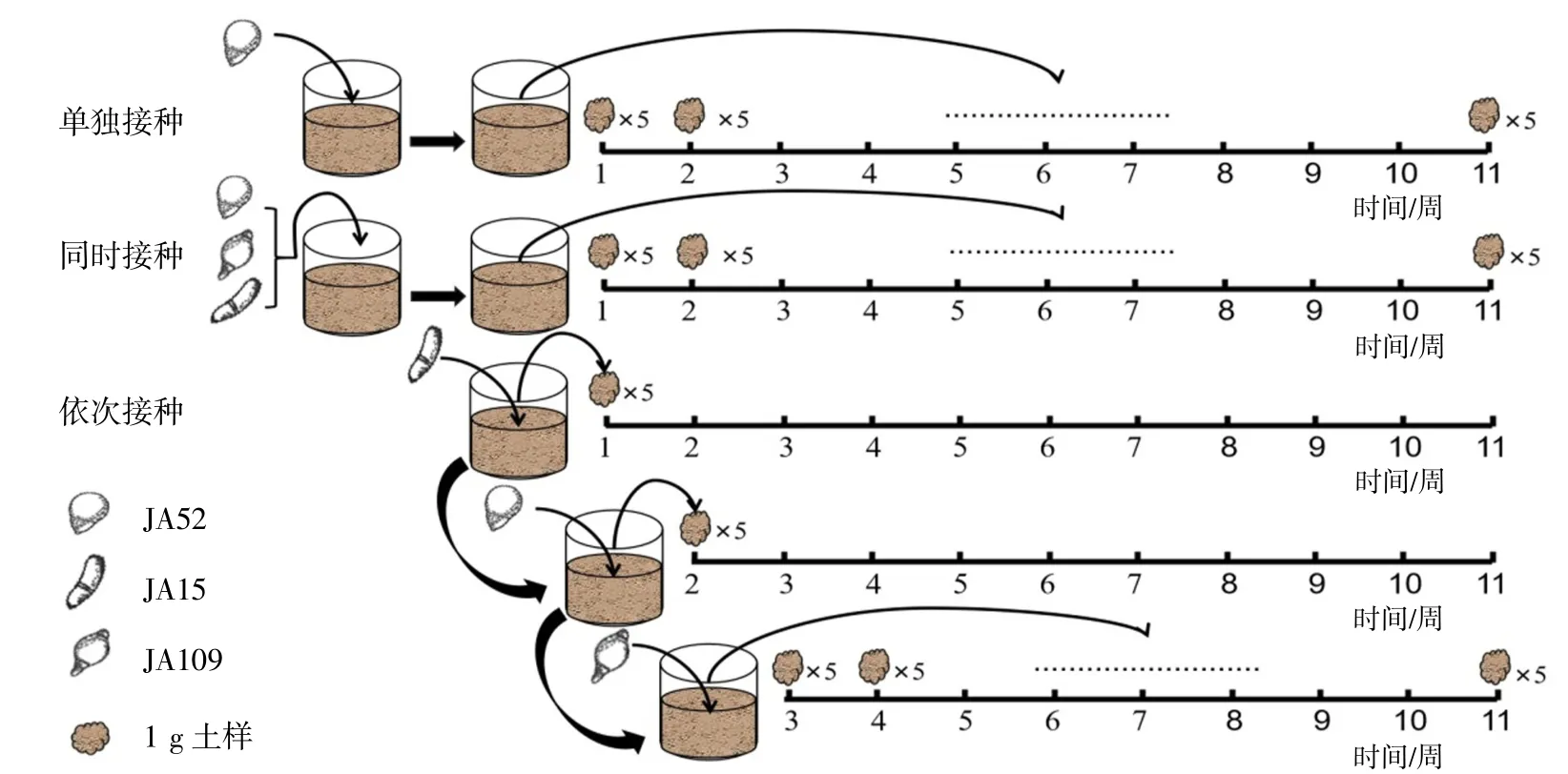
图1 微宇宙实验和取样方法示意图
1.6 NTF的检测用无菌牙签从人工植入了NTF的无菌土壤中挑取土样,使用诱饵平板法检测NTF〔11,15〕。每周取样时,从每个处理组中重复采集25次样品,取样量为1 g/次,培养7 d后置于体视显微镜下进行检测,检测结果记为土样检出或未检出某个菌种。见图2。

图2 捕食线虫真菌检测流程图
1.7 数据分析根据土样检出频次计算每份土样检出率。检出率=(某个种检出的土样数/25)×100%,其中,25为总取样次数。
2 结果
2.1 NTF单独植入无菌土壤后检出率变化3种NTF单独植入无菌土壤后,前5周的检出率均较高,A.musiformis均为100%,另外2个种检出率有轻微波动,但也接近100%;6~8周,3个种均呈现波动下降趋势;之后A.oligospora和A.musiformis波动上升,而A.thaumasium则在第8周快速增加后随即在第9周急剧下降,第11周接近于0%。见图3。
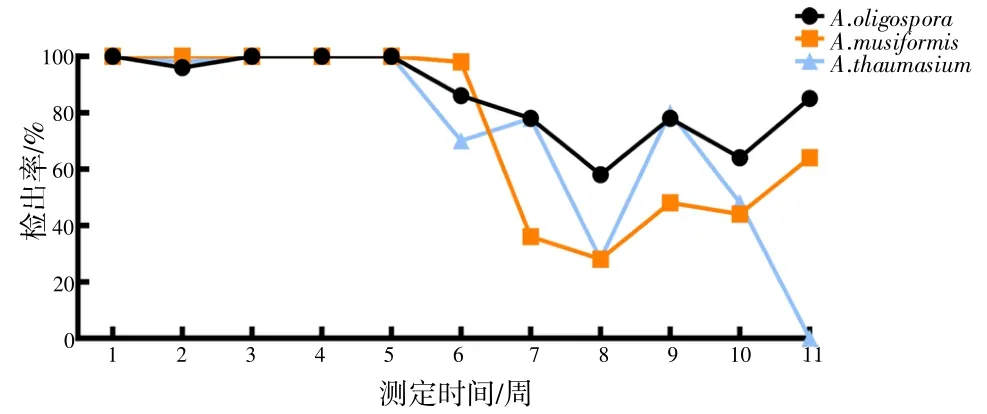
图3 NTF单独植入后检出率变化情况
2.2 NTF同时植入无菌土壤后检出率变化3种NTF同时植入无菌土壤后,A.musiformis检出率在前7周均保持在85%以上,第8周时降至整个周期的最低点,第9周回升至68%,之后又持续下降,至检测结束时检出率为38%;A.thaumasium在第1周检出率低于20%,随后大幅增加至第3周的84%,在第4周开始波动下降,第8周时为最低,至检测结束时检出率为16%;A.oligospora第1周检出率低于20%,随后大幅增加至第2周的65%,但在第3周又下降至30%,随后持续波动,第7周出现高峰,而在第4、8、9、11周基本趋近于0%。整个实验周期中,A.musiformis的检出率始终高于其余2种,A.oligospora检出率在大部分检测时间点均为最低(仅第2、10周略高于A.thaumasium),且整个周期中的波动幅度最大、频次最高。见图4。

图4 NTF同时植入后检出率变化情况
2.3 NTF按不同顺序植入无菌土壤后检出率变化按不同顺序在无菌土壤中依次植入NTF,3个种在不同时间的检出率存在明显差异。见图5。A.musiformis无论以何种顺序植入无菌土壤后其检出率都基本高于其余2种,且A.musiformis在第2周植入的情况下,3个种在第11周的检出率均较高(图5B和D),尤其是按A.thaumasium、A.musiformis和A.oligospora(图5D)的顺序植入后3个种在第11周的检出率均保持在最高水平,而A.musiformis在第3周加入时,3个种在第11周的检出率均较低,几乎接近于0%(图5A和C);除j组(图5F)外,A.oligospora的检出率在其他2个种加入后的1周均显示出下降趋势。
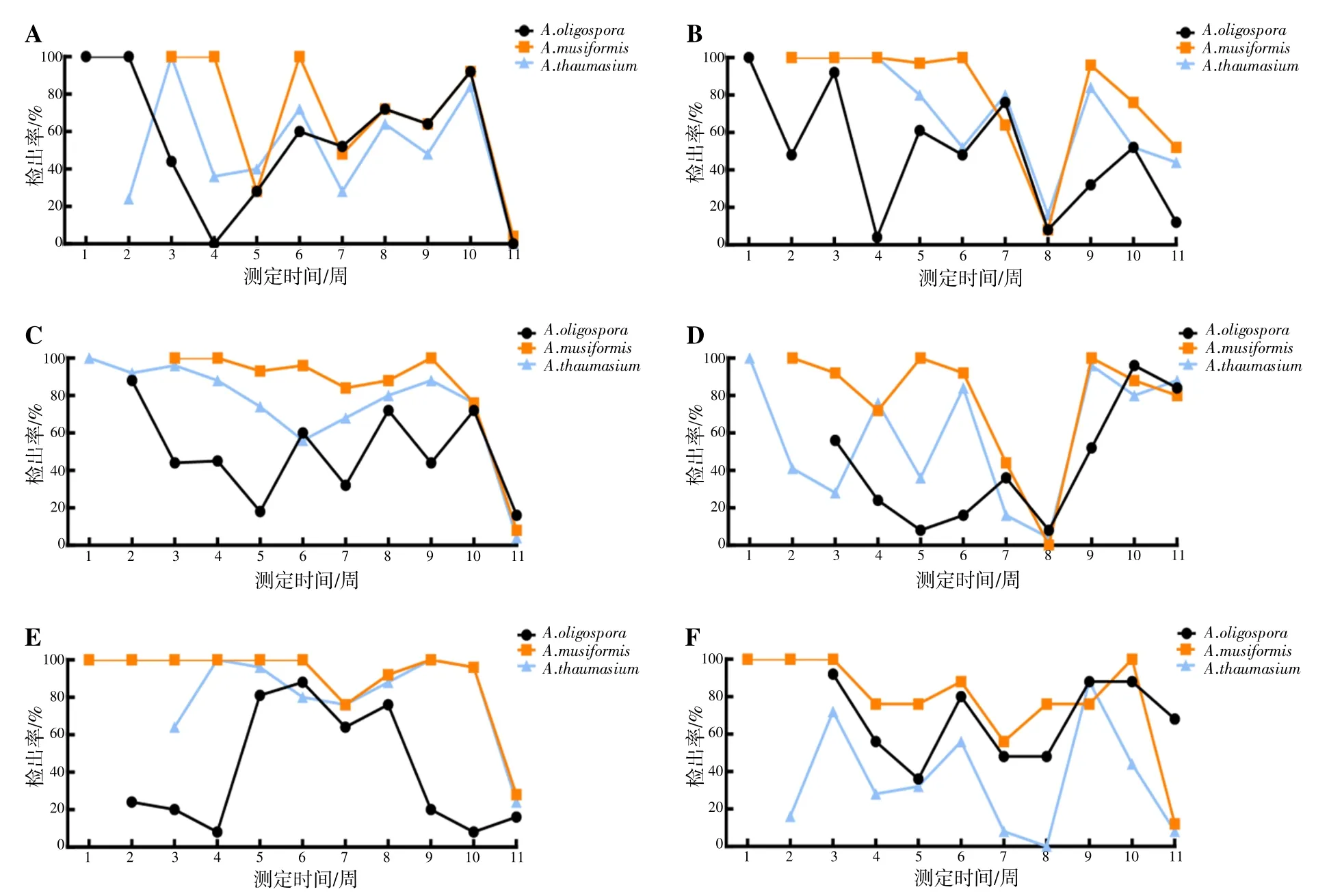
图5 NTF按不同顺序植入后检出率变化情况
3 讨论
通常情况下,生态位相近的物种在同一生境下势必面临有限资源的竞争,而竞争能力强的物种将在群落构建中占优势〔16〕。本研究中,3个物种在没有其他生物因素的干扰下,它们同时出现在无菌土壤中时,A.musiformis的检出率在前6周与单独存在时无明显差异,而A.thaumasium和A.oligospora在前6周的检出率均显著低于单独存在时;无论以何种顺序添加3个物种到土壤中,A.musiformis都可以在较短时间内获得生长优势并保持到监测结束。以往对不同生境下NTF的资源调查结果显示,A.oligospora是大多数生境里的优势种〔17〕,而在高海拔区域、温泉等恶劣环境中,A.musiformis表现出了较好的抗逆性,是这些环境中的优势种〔18-19〕,说明A.musiformis具备较强的竞争能力,在NTF群落构建过程中占据了较明显的优势。
经典生态位理论认为,2个物种在没有生态位分化的前提下是无法稳定共存于同一生境中的〔3〕,但对不同生境中NTF的调查结果显示,没有明显生态位分化的Arthrobotrys属NTF能在同一生境下共存,只是不同种的数量存在差异〔20〕。本研究无论是将3个种同时植入或按不同顺序植入到无菌土壤后,在不同时间段均能同时检测到3个种。而且3个种同时定植于土壤后,在第11周的检出率虽均低于60%,但都有检出。在单独植入实验中A.thaumasium第11周的检出率为0%,说明生态位相近的NTF在同一生境中不只存在竞争,也存在协同共存效应。这种协同效应可能是因微生物多样的代谢途径和代谢产物使其能够在竞争中实现共存〔21〕,也可能是相互之间的生活史周期存在交错从而形成空白斑块〔22〕,为群落中弱竞争者提供了生存条件,进而实现共存,以提高群落多样性,促进群落的稳定存在。
研究资料显示,先植入物种因得到更多的生长资源而获得快速生长的机会,相较于后期植入的物种在数量上占有绝对优势,呈现出群落构建中的优先效应〔23〕。本研究中,优先植入的物种,因为没有竞争者,其检出率在第1周结束时均可达到100%。但随着其他物种的植入,仅A.musiformis的检出率没有受到明显影响,可以维持较高的检出率至第10周;而A.oligospora的检出率会受到后期植入物种的影响急剧下降,A.thaumasium的检出率也有一定程度下降且后期的物种植入顺序对其下降幅度有影响,特别是在植入A.oligospora后再植入A.musiformis。由此可见,在NTF的群落构建中也存在优先效应,但优先效应的持续时长受群落中不同物种竞争能力差异影响〔23〕。实验所使用的3个物种中,A.musiformis竞争能力强,因此能抵抗后期植入物种的竞争长时间保持其优先植入的优势。同时,我们发现,A.thaumasium的植入可以协助A.oligospora抵抗A.musiformis的竞争,使得其优先效应几乎可以保持与A.musiformis相同的时长。因此,优先效应的持续时长还受到物种间协同作用的影响。
4 总结与展望
同属不同种的NTF在资源有限时相互之间存在竞争作用,但这种竞争作用并不是排除某个物种,而是物种间的竞争性共存。在此过程中,到达生境的先后顺序会影响最终群落构成,体现出群落构建的优先效应,不过,优先效应的持续时长受物种本身竞争能力和物种间系统作用的影响。本研究只是基于前期对自然环境中NTF活力监测结果而设计的11周连续检测,尚缺乏更长期的监测数据以更全面了解NTF群落的动态变化。因此在未来的研究中,我们将增加监测时长,并进一步对生成相同捕食器官及不同捕食器官的NTF开展交叉实验,测定不同的实验设计下的捕食效率,以探索不同组合下NTF的竞争与协同机制。本研究在推进微生物的竞争与协同机制理解的同时,也可为NTF生防研究提供参考。

