利福平致肝损害机制及基因多态性研究进展
陈智慧 综述,刘泉波 审校 (重庆医科大学附属儿童医院,儿童发育疾病研究教育部重点实验室,国家儿童健康与疾病临床医学研究中心,儿童发育重大疾病国家国际科技合作基地,儿科学重庆市重点实验室,重庆 400014)
抗结核药物不良反应以药物性肝损害(drug-induced liver injury,DILI)最多见,危害性也最大[1]。研究显示,我国涉及的主要药物性肝损害中,抗结核药物致肝损害(anti-tuberculosis drug-induced hepatotoxicity,ATDH)占人群总发病率的21.99%,位居第二[2],儿童结核患者中ATDH发病率约为8.80%[3]。ATDH可致抗结核治疗选药方案变化以及诱发耐药,且二线抗结核药物价格昂贵,均导致抗结核治疗困难,可能引起治疗中断甚至危及生命,给个人、家庭及社会造成沉重的负担。利福平(rifampicin,RFP)是目前抗结核治疗中广泛使用并引起ATDH的一线药物之一,但其引起肝损害的具体机制尚不明确,本文就RFP致肝损害的机制及其基因多态性相关研究进展进行综述。
1 利福平导致的肝损害
DILI根据发病机制分为固有型和特异质型,RFP所致ATDH多为固有型,其所致肝损害呈浓度及时间依赖性,具有可预测性[1,4]。临床中抗结核治疗以联合用药为主,利福平可与其他药物相互作用,常引起肝细胞损伤型或胆汁淤积型肝损害[1,5]。RFP导致的肝脏组织病理学改变,多表现为急性肝炎、带状坏死及胆汁淤积性肝炎[6],镜下可见肝细胞脂肪变性,伴轻度坏死和炎症,部分线粒体、内质网肿胀断裂,以及散在的胆汁淤积[7-8]。
2 利福平致ATDH发病机制
RFP致ATDH的发病机制较复杂,具体机制尚不明确,可能有多种机制共同参与,如线粒体氧化应激、内质网应激、肝细胞凋亡增加、胆汁淤积、PXR激活诱导多种药物代谢酶及转运蛋白的活性和表达水平增加等。
2.1 利福平增加应激反应引起肝细胞凋亡致肝损害
RFP可通过线粒体氧化应激、内质网应激,增加肝细胞的凋亡率,降低肝细胞的存活率,其所致细胞毒性具有浓度及时间依赖性[4,9-10]。利福平可使线粒体超微结构产生病理改变引起线粒体功能障碍,导致活性氧的过度产生和细胞色素C的释放,诱导细胞凋亡、坏死和纤维化[10]。利福平与异烟肼(isoniazid,INH)联合用药时,由于肝脏中谷胱甘肽(glutathione,GSH)合成无法应对机体需求的增加或药物活性代谢物的消耗性利用,导致GSH稳态失衡,引起线粒体氧化应激增加,诱导线粒体通透性改变导致肝细胞凋亡损伤[11]。GSH可与多种药物的毒性中间代谢产物结合,并排出体外起到解毒作用[12],GSH消耗过多可致肝脏毒性产物集聚,进一步加重肝损害。
RFP通过激活PERK-ATF4-CHOP途径,增加葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)、转录激活因子(activa-ting transcription factor 4,ATF4)、C/EBP同源蛋白(C/EBP homologous protein,CHOP)的蛋白和基因表达水平,从而影响内质网应激,介导细胞凋亡[9]。内质网中未折叠或错误折叠的蛋白质累积也可导致内质网应激,进而激活未折叠蛋白反应,诱导适应性反应以重建内质网功能并恢复体内平衡[13],如果应激信号严重和/或延长,则细胞凋亡途径被激活[14],从而导致肝损害。
但另一方面,RFP也可通过激活腺苷酸活化蛋白激酶α(AMP-activated protein kinase α,AMPKα)介导核因子E2相关因子2/血红素加氧酶-1(nuclear factor erythroid 2-related factor 2/heme oxygenase 1,Nrf2/HO-1)信号通路,对肝脏起到一定程度抗氧化应激的保护作用[15]。
2.2 利福平引起肝内胆汁淤积致肝损害
多项动物实验研究表明,RFP可引起小鼠肝内胆汁淤积。研究发现,利福平可抑制胆汁酸转运蛋白及mRNAs的表达,如胆盐输出泵(bile salt export pump,BSEP,由ABCB11编码)、Na+/牛磺胆酸盐转运蛋白(Na+/taurocholate cotransporter,NTCP,由SLC10A1编码)、多药耐药蛋白1(multidrug resistance protein 1,MDR1,由ABCB1编码)、多药耐药蛋白2(multidrug resistance-associated protein,MRP2,由ABCC2编码)、有机阴离子转运多肽2(organic anion transporting protein 2,OATP2,由SLCO1B1编码)、有机溶质转运蛋白β(organic solute transporter β,OSTβ)。这些因子影响胆汁酸循环,血清中结合胆红素、总胆汁酸的水平显著升高,导致胆汁淤积及肝功能损害[4,12,16-18],但具体发生机制仍待进一步研究。Xu B Y等[19]研究发现,RFP可通过氧化应激激活蛋白激酶C-细胞外信号调节激酶/c-Jun氨基末端激酶/p38(protein kinase C-extracellular signal-regulated kinase/c-Jun N-terminal kinase/p38,PKC-ERK/JNK/p38)和磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)信号通路,引起网格蛋白介导的内吞作用和泛素-蛋白酶体降解MRP2,使MRP2在细胞膜的分布减少,抑制MRP2表达,导致胆汁淤积。熊去氧胆酸和丹参酮ⅡA通过Nrf2介导适应性应答,增加胆汁酸转运蛋白表达则能减轻肝损害[4,20]。RFP还可影响紧密连接蛋白如ZO-1蛋白和闭合蛋白的连续性,破坏肝细胞连接,诱导肝内胆汁淤积[7]。肝功能受损后肝脏中有毒胆汁盐逐渐积累,激活GRP78和CHOP等蛋白的基因表达,促进未折叠蛋白反应[21],增加肝细胞凋亡。
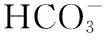
2.3 利福平通过人孕烷X受体途径引起肝毒性物质积聚致肝损害
RFP为人孕烷X受体(pregnane X receptor,PXR)特异性配体,可引起PXR蛋白过表达和活化,诱导多种药物代谢酶及转运蛋白的活性和表达水平增加[25],可增加RFP自身及其他药物代谢,并使卟啉、脂质及胆红素等物质在机体内积聚导致肝损害。
原卟啉IX(protoporphyrin IX,PPIX)是卟啉生物合成的中间体,通常在肝脏中浓度非常低,肝脏中高浓度的PPIX会导致肝损伤。RFP与INH联用时通过PXR介导改变血红素生物合成途径,导致肝脏中内源性肝毒素PPIX积聚并致毒性作用[26]。而氨基乙酰丙酸合成酶(aminolevulinic acid synthase,ALAS)是卟啉生物合成中的限速酶,PXR的激活可上调肝脏中的ALAS1表达[27],使其产物ALA增加,ALA是PPIX的前体,进而引起PPIX积聚导致肝损害。
过氧化物酶体增殖体激活受体γ(peroxisome proliferator-activated receptor,PPARγ)信号通路是PXR的一个下游靶点,RFP通过活化PXR诱导PPARγ信号通路及其靶基因表达上调,促使循环系统的甘油三酯转向肝脏;另外脂肪酸合成的相关mRNA(Fas、Acc、Scd-1)表达上调,促进脂肪合成,加剧脂质在肝脏的积聚[28]。表达上调的PPARγ信号通路下游可检测到围脂滴蛋白,该蛋白可促进脂滴成熟并抑制脂肪的分解,导致甘油三酯聚集,但该传导途径未表现出剂量依赖性,引起的脂质积聚主要是低剂量RFP的毒性作用[29]。在另一项动物实验研究中,高剂量RFP(>20 mg/kg)可通过间接激活mPXR的核转位,诱导CYP3A11等PXR靶基因的反式激活,增加CYP3A在小鼠肝脏中的表达,而CYP3A高表达可能会引起总胆固醇和低密度脂蛋白胆固醇升高[29-30]。
PXR蛋白过表达和活化也增加CYP3A4和CYP2B6表达,促进INH产生肝毒性代谢产物[25,31],熊果酸和齐墩果酸通过抑制PXR的反式激活作用,降低其表达则可减轻肝损害[32-33]。对于合并有艾滋病的结核患者,PXR还可通过CYP3A4依赖性途径参与利托那韦生物活化、氧化应激和内质网应激导致肝毒性[34]。由于胆红素的清除需要表达尿苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyltransferase,UGT),RFP引起的高胆红素血症可能与PXR对UGT1A表达的负调节作用有关[29]。
2.4 其他
在以往KEGG通路富集分析中,PPARγ信号通路、CYP参与的异生素代谢、GSH代谢、化学致癌作用和酒精毒性作用相关蛋白表达在RFP处理后的动物肝脏中呈剂量依赖性增加[29],对肝脏功能均产生一定影响。
3 利福平致ATDH相关基因多态性
在中国人群发现,ABCB11基因的rs2287616位点与抗结核药物诱导的胆汁淤积型肝损害有关[17];OATP1B1的521T>C位点与利福平所致的肝损害尤其是胆汁淤积型肝损害密切相关[35];SLCO1B1基因的rs4149014位点、SLCO1B1*15单倍体[36],SLCO1B1基因的rs2417957位点T/T基因型、rs4149063位点T/T基因型和TGTG、TTTC和GTTC单倍型[37],以及Nrf2基因中rs4243387位点T/C基因型或rs2001350、rs6726395位点单倍型C-C[38]也与ATDH风险增加相关。转录因子BTB-CNC异体同源体(BTB domain and CNC homologue 1,Bach1)可与Nrf2竞争结合DNA,中国人群中Bach1的遗传多态性也可能与ATDH易感性有关[39],日本人群中Bach1基因rs2070401位点C/C基因型更是发生ATDH的独立危险因素[40]。
PXR基因在中国人群中的rs2461823-AA基因型[41]和印尼人群中的rs3814055-TT基因型[42]与ATDH风险增加相关,而PXR基因的rs7643645-AA基因型[41]、rs3814055变异型[43]、次要等位基因rs7643645和H0010001单倍型[44]与ATDH风险降低有关。巴西人群中CYP2B6基因的rs3745274位点516TT纯合子变异型与RFP-INH导致的ATDH有关[31],中国人群中携带有CYP2B6*6/*6的男性患者发生ATDH风险也更高[45]。Huai C等[46]通过全基因组关联分析及CRISPR/cas9介导的甲基化修饰细胞模型,证明AK2、SLC8A2和PSTPIP2基因区域或其附近的4个CpG位点与利福平治疗后的细胞应答反应有关,并参与引起肝损害。
4 结语
ATDH是全球严重的药物不良反应,可影响抗结核治疗疗效。近年国内外大量研究发现了ATDH的一些高危因素及易感基因,但由于ATDH机制的复杂性以及相关基因的多态性,不同抗结核药物单独或相互作用导致肝损害的机制尚不完全清楚,了解ATDH发生机制有助于我们提前预测和识别抗结核药物与ATDH的相关性及严重程度,减少肝损害的发生,为结核患者的个体化及精准治疗提供理论基础。但目前研究发现的易感基因包含SNP位点较少,也缺乏多种族、多中心的大样本研究,尚不能作为独立的分子生物标志物指导临床抗结核治疗,未来全基因组关联分析将更多的应用于结核病研究,逐渐展开更深入的分子遗传机制研究。
——以咸阳市屯庄水库为例
——疾病防治的新靶标

