油楠倍半萜类合成酶基因SgSTPS3的克隆与表达分析*
陈朝黎 余 纽 李荣生 邹文涛 董明亮 朱茂成 杨锦昌
(1.中国林业科学研究院热带林业研究所 广州 510520; 2.南京林业大学 南京 210037)
萜类化合物是自然界中迄今为止种类最多的次生代谢产物(Ashouretal.,2018),在植物生长发育中发挥着重要的生理生态作用。萜类可以帮助植物抵御外界干扰,也能促进植物与其他生物群体互利共生(Tetali,2019),并广泛应用于医疗、食品、园艺和香料(Wright,2005;Jenneweinetal.,2001;Ajikumaretal.,2010;Cöretal.,2018)。鉴于萜类具有重要的开发利用价值,许多学者对萜类化合物生物合成的分子机制进行了较深入的探索,以期通过分子生物学手段调控萜类化合物的产量。萜类合成酶(terpenoid synthases,TPS)是萜类化合物生物合成途径中的关键酶,是影响萜类合成的重要因素。近年来国内外已对多种植物的TPS基因进行了鉴定和功能分析(Yahyaaetal.,2015;Martinetal.,2004),其中研究最为广泛的是拟南芥(Arabidopsisthaliana)。基于TPS的基因组测序,发现了40个拟南芥AtTPS基因家族(Aubourgetal.,2002)。通过对云杉属(Picea)中多个种TPS基因家族的全基因组分析,已发现其中含69种特异性TPS基因(Keelingetal.,2011)。除此之外,许多学者还对其他植物进行了TPS全基因组分析,如:葡萄(Vitisvinifera)(Martinetal.,2010)、番茄(Solanumlycopersicum)(Zhou,2020)、陆地棉(Gossypiumhirsutum)(Yangetal.,2013)、毛果杨(Populustrichocarpa)(Irmischetal.,2014)、大麻(Cannabissativa)(Boothetal.,2020)及红藻类(Rhodophyta)(Weietal.,2019)。
油楠(Sindoraglabra)为云实亚科(Caesalpinioideae)油楠属(Sindora)高大乔木,也是国家二级重点保护野生植物,天然分布于我国海南岛的陵水县、保亭县、五指山、乐东县、东方市、昌江县、白沙县等地。自1981年有学者发现油楠树干可分泌出柴油状的树脂油后(黄全,1981),有关油楠泌油特性及其机制的研究逐步深入。吴忠锋等(2014)研究了油楠的泌油特征,发现油楠年泌油量因不同径级和个体而差异较大,其变化幅度为0~3 L;陆碧瑶等(1982)分析了吊罗山油楠树脂油的化学组分,初步检测出11种倍半萜组分,其含量占总挥发油含量的95%以上;杨锦昌等(2016)对尖峰岭7份油楠树脂油的化学成分进行测定,发现油楠树脂油中含有19种倍半萜,其平均含量占树脂油的76.88%;Yu等(2020)对海南吊罗山、尖峰岭等4个分布区的油楠树脂油化学组分进行分析,发现树脂油含有86%以上的倍半萜类,且其化学组分和含量在不同分布区存在较大差异。为探究油楠树脂油富含倍半萜的成因,Yu等(2018)针对油楠成年植株开展了茎部转录组数据分析,挖掘获得油楠倍半萜类生物合成关键基因SgSTPS1和SgSTPS2(Yuetal.,2018)。由于油楠茎部萜类化合物种类较多,其生物合成的关键基因仍有待进一步解析。本研究在Yu等(2018)已获得油楠倍半萜类生物合成关键基因的基础上,以不同年龄油楠植株为研究对象,分离克隆出油楠树脂油中倍半萜合成的关键基因SgSTPS3,并对其进行生物信息学分析,同时在体外对该基因编码的蛋白进行原核诱导表达,并通过GC-MS鉴定其酶反应产物,再通过荧光定量PCR等技术分析该基因在油楠不同年龄、不同器官中的表达情况,以及激素诱导下的表达变化,以全面解析SgSTPS3在萜类合成途径中的生物学功能,为阐明油楠倍半萜类化合物的分子形成机制提供重要参考。
1 材料与方法
1.1 植物材料
油楠幼株种植于中国林业科学研究院热带林业研究所温室,成年植株来自于该所后山。2019年12月,分别在4种不同株龄(0.5、1.5、15、30年生)的植株上采集根、韧皮部、木质部、老叶、嫩叶5种器官。2020年6月,对2年生油楠幼株进行激素诱导处理,分别于0、6、12、24、48、72 h采集叶片。
1.2 油楠SgSTPS3基因的克隆
根据已有油楠转录组数据库的序列信息,设计开放阅读框两端的引物SgSTPS3 F/R(表1)。用RNA提取试剂盒(TIANGEN,DP441)提取成年油楠植株茎部的总RNA,反转录试剂盒(TARAKA,6110A)合成cDNA。以cDNA为模板通过高保真酶(TOYOBO,KOD-401)进行PCR扩增。利用1.2%琼脂糖凝胶电泳检测PCR产物,对目的条带进行纯化回收(TIANGEN,DP209)。与pEASYBlunt Zero(TransGen,CB501)载体连接,转化大肠杆菌(Escherichiacoli)Trans-T1感受态细胞,筛选阳性克隆菌落,菌液PCR检测后,送往生工生物工程(上海)股份有限公司进行测序,提取重组质粒。
1.3 生物信息学分析
通过NCBI网站进行BLAST在线分析,找到与该基因相似性高的同源序列,初步判断基因的类型。通过软件DNAman与油楠倍半萜合成酶SgSTPS1、SgSTPS2基因序列进行序列比对。ORF finder翻译出该基因所编码的氨基酸序列,通过在线软件ProtParam分析氨基酸序列的相对分子量、等电点、分子式等理化性质;使用软件Protscale对氨基酸序列的亲疏水性进行分析;利用 NetPhos3.1server对SgSTPS3基因所编码的蛋白质进行磷酸化位点分析;使用软件TMpred对氨基酸序列进行跨膜结构预测;使用软件Signal P4.1 Server分析相应蛋白的信号肽;用TargetP和Uniprot对该蛋白进行亚细胞定位预测;使用在线软件SOPMA对蛋白质进行二级结构预测;在线软件SWISS-MODEL进行三级结构预测。使用软件Jalview进行氨基酸序列同源性分析;通过在线软件InterPro分析蛋白的结构域;软件MAGE 7 进行系统发育进化树的构建。
1.4 原核表达载体构建及诱导表达
以pET-30a为表达载体,提取质粒。选择合适的限制性酶切位点BamHⅠ、XhoⅠ,设计表达引物SgSTPS3-BamHⅠ及SgSTPS3-XhoⅠ (表1),将基因克隆获得的质粒作为模板进行PCR扩增,凝胶电泳检测后纯化回收,将pET30a载体质粒与目的片段同时进行双酶切后连接转化至大肠杆菌TOP10感受态中,检测筛选出阳性克隆进行测序验证。将pET-30a-SgSTPS3重组质粒转入大肠杆菌感受态细胞BL21,热激后涂布在含Kan抗生素的LB固体培养基,培养后挑取单克隆到液体培养基中培养至OD600约为0.6,添加诱导剂IPTG进行原核诱导表达,分别置于20 ℃条件下培养16 h、37 ℃条件下培养4 h,以未添加诱导剂的培养皿为阴性对照。诱导表达后的菌液离心,弃上清,收集菌体。将收集到的菌体加入PBS(pH7.4)中悬浮,使用超声破碎仪使其充分溶解,离心。离心后的沉淀在缓冲液A(8 mol·L-1Urea、50 mmol·L-1Tris-HCl、300 mmol·L-1NaCl,pH8.0)中溶解,分别对上清和沉淀处理,制样,SDS-PAGE 检测。并将检测后的菌液进行大量表达。
1.5 原核蛋白纯化
将大量表达的细胞菌体用缓冲液B(50 mmol·L-1Tris、300 mmol·L-1NaCl、0.2 mmol·L-1PMSF、0.1%TritonX-100,pH8.0)溶解、超声破碎,离心收集上清粗蛋白。取5 mL Ni-NTA,用5倍柱床体积的缓冲液C (50 mmol·L-1Tris、300 mmol·L-1NaCl,pH8.0)清洗平衡柱,流速5 mL·min-1;将粗蛋白与平衡后的柱填料孵育1 h;将孵育后的产物上柱,收集流出;用结合缓冲液(50 mmol·L-1Tris、300 mmol·L-1NaCl,pH8.0)清洗平衡柱;用3种不同规格洗涤液(50 mmol·L-1Tris、300 mmol·L-1NaCl、20/50/500 mmol·L-1Imidazole)洗柱,并分别收集流出;对粗蛋白、洗杂流出、洗脱流出分别处理,制样,准备SDS-PAGE 检测。将纯度较好的组分透析到缓冲液D (50 mmol·L-1Tris、300 mmol·L-1NaCl,pH8.0)中,透析结束后用 PEG20000浓缩,0.45μm滤膜过滤后分装,-80 ℃保存。
1.6 目的蛋白检测
将纯化后的蛋白进行SDS-PAGE电泳,检测蛋白分子量;同时,将纯化后的蛋白在250 mA恒流条件下冰上湿转膜90 min,孵育抗体,一抗为兔抗His标签(Sangon Biotech,D110002),二抗为羊抗兔IgG-HRP(Sangon Biotech,D110058),随后用TMB显色试剂盒进行显色检测;最后用蛋白定量试剂盒测定蛋白浓度。
1.7 体外酶活反应及GC-MS分析
分别以法尼基焦磷酸(FPP)与香叶基焦磷酸(GPP)为底物,对纯化蛋白SgSTPS3进行体外表达鉴定(Yuetal.,2018),反应在含有3.5 μg纯化蛋白和50 μmol·L-1GPP/FPP底物的500 μL测定缓冲液(5 mmol·L-1DTT,100 mmol·L-1KCl,5 mmol·L-1MgCl2,50%甘油,25 mmol·L-1Tris-HCl,pH7.4)中进行。反应体系置于2 mL的棕色玻璃瓶中,30 ℃水浴5 h。然后将样品采用固相微萃取系统萃取30 min,并通过具有HP-5 MS色谱柱(30 m×0.25 mm)的气相色谱-质谱(GC-MS)系统7890B-5977A(Agilent Technologies)进行分析。进样口温度为250 ℃,载气为He气,流速为1.0 mL·min-1,电离能为70 eV,质量扫描范围为30~350 Amu,不分流进样。升温程序为:初始温度50 ℃,保持1 min,随后以5 ℃·min-1的速率升温至80 ℃,保持1 min,然后以10 ℃·min-1的速率升温至220 ℃,持续10 min。通过NIST14质谱库数据库检索,并将样品保留时间、质谱与标准品进行比较,选择匹配度大于90%的化合物进行鉴定。
1.8 基因表达分析
为进一步了解倍半萜合成酶基因SgSTPS3在油楠体内的时间和空间表达模式,分别取0.5、1.5、15、30年生油楠植株的根部、韧皮部、木质部、嫩叶、老叶,每个处理2个生物学重复,分析该基因在4个不同株龄5个不同器官中的表达状况。分析SgSTPS3在同一株龄不同器官中的相对表达量时,以各自株龄基因表达量最低的器官为对照;分析SgSTPS3在不同株龄同一器官中的相对表达量时,以0.5年生的器官作为对照。为检测该基因对于外源激素的响应模式,通过水杨酸(SA,50 μmol·L-1)和茉莉酸甲酯(MeJA,100 μmol·L-1)以及混合激素SA(50 μmol·L-1)+MeJA(100 μmol·L-1)浇灌喷洒2年生油楠幼株诱导基因的表达,以不添加激素的溶液作为对照组(CK)。并在处理后的0、6、12、24、48、72 h取顶端以下成熟叶片2片,每个处理3个生物学重复,以0 h基因表达量作为对照。将以上样品,提取其RNA,并反转录为cDNA。设计基因序列荧光定量RT-PCR引物qSgSTPS3 F/R,以Actin-2作为内参基因(引物信息见表1),用SYBR Premix Ex Taq II(TARAKA,RR820A)进行实时荧光定量PCR。实时荧光定量的反应体系为20 μL,每个样品3个技术重复,反应过程在LightCycler96荧光定量PCR仪上进行。用2-ΔΔCt法分析试验数据。

表1 试验所用引物Tab.1 Primers used in the test
2 结果与分析
2.1 SgSTPS3基因的克隆与生物信息学分析
以油楠木质部cDNA模板,通过PCR扩增获得CDS片段 (图1),其开放阅读框为1 701 bp,编码566个氨基酸(GenBank登录号:MW345633)。该基因与Yu等(2018)克隆的基因SgSTPS1(Cluster-32860.19290,编码549个氨基酸)及SgSTPS2(Cluster-32860.116868,编码577个氨基酸)的基因序列进行比对,结果显示与SgSTPS1间核酸序列相似性为58.17%,与SgSTPS2相似性为59.82%,本研究将其命名为SgSTPS3。SgSTPS3蛋白的理论分子量为64.82 kDa,等电点为5.43,分子式为C29H4502N770O867S14,不稳定系数40.17,属于不稳定蛋白。该蛋白为亲水性蛋白,含有51个可信度高的磷酸化位点,其中丝氨酸24个、酪氨酸14个、苏氨酸13个。其跨膜结构预测,有4个比较明显的氨基酸跨膜区,由内向外的区域位于第22-44位、412-436位,由外向内的区域位于第294-312位和411-432位。该蛋白是一种非信号肽蛋白,亚细胞定位预测该蛋白定位在细胞质中。SgSTPS3中不存在信号肽切割位点,为非分泌蛋白;SgSTPS3二级结构预测,α螺旋结构占比最多,为68.90%,无规则卷曲占比24.73%,延伸链占比3.89%,β卷曲占比2.47%。对油楠SgSTPS3编码蛋白三级结构预测,SgSTPS3蛋白为倍半萜烯合酶,序列一致性为40.15%。

图1 SgSTPS3 PCR产物琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of SgSTPS3 PCR products
将SgSTPS3与其他物种同源蛋白进行序列比对(图2),发现其与古巴香胶树(Copaiferaofficenalis)CoTPS3和兰氏香脂树(Copaiferalangsdorffii)ClTPS3蛋白的同源性最高,均为87.68%,而与其他物种的同源性较低,其中与红花车轴草(Trifoliumpretense)TpGDS-like蛋白的同源性为58.35%,与鸡血藤(Spatholobussuberectus)SsTPS2的同源性为56.62%,与野大豆(Glycinesoja)GsTPS2和大豆(Glycinemax)GmTPS2的同源性均为56.83%。SgSTPS3蛋白与其他的TPS蛋白均含有萜类合成酶保守结构域:DDXXD和RRX8W,及结构域NSE/DTE和RXR,初步认为该蛋白为萜类合成酶,属于类异戊二烯生物合成ClassⅠ超家族。将SgSTPS3蛋白序列与其他物种TPS序列进行进化分析(图3):油楠SgSTPS3与古巴橡胶树CoTPS3、兰氏香脂树ClTPS3亲缘关系最近;与其他萜类合成酶相关蛋白的亲缘关系稍远。
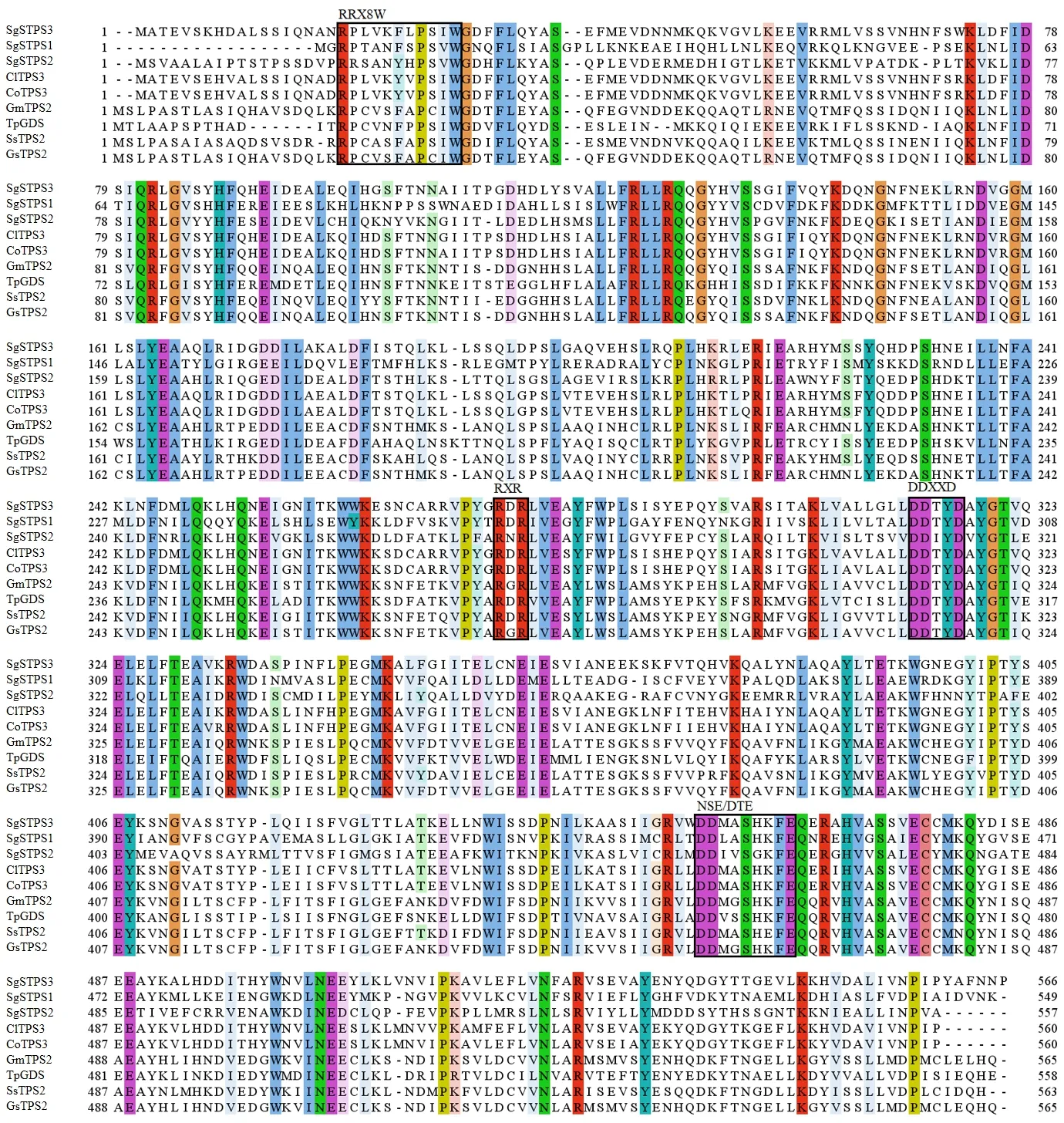
图2 油楠SgSTPS3氨基酸与其他物种氨基酸序列比对及结构域分析Fig.2 Alignment and domain analysis of the amino acids blonging to Sindora glabra with other speciesClTPS3:兰氏香脂树Copaifera langsdorffii(AGW18160.1);CoTPS3:古巴香胶树Copaifera officenalis (AGW18156.1);GmTPS2:大豆Glycine max(XP_025980989.1);TpGDS:红花车轴草Trifolium pretense (PNY15989.1);SsTPS2:鸡血藤Spatholobus suberectus (TKY49012.1);GsTPS2:野生大豆Glycine soja(XP_028189414.1).
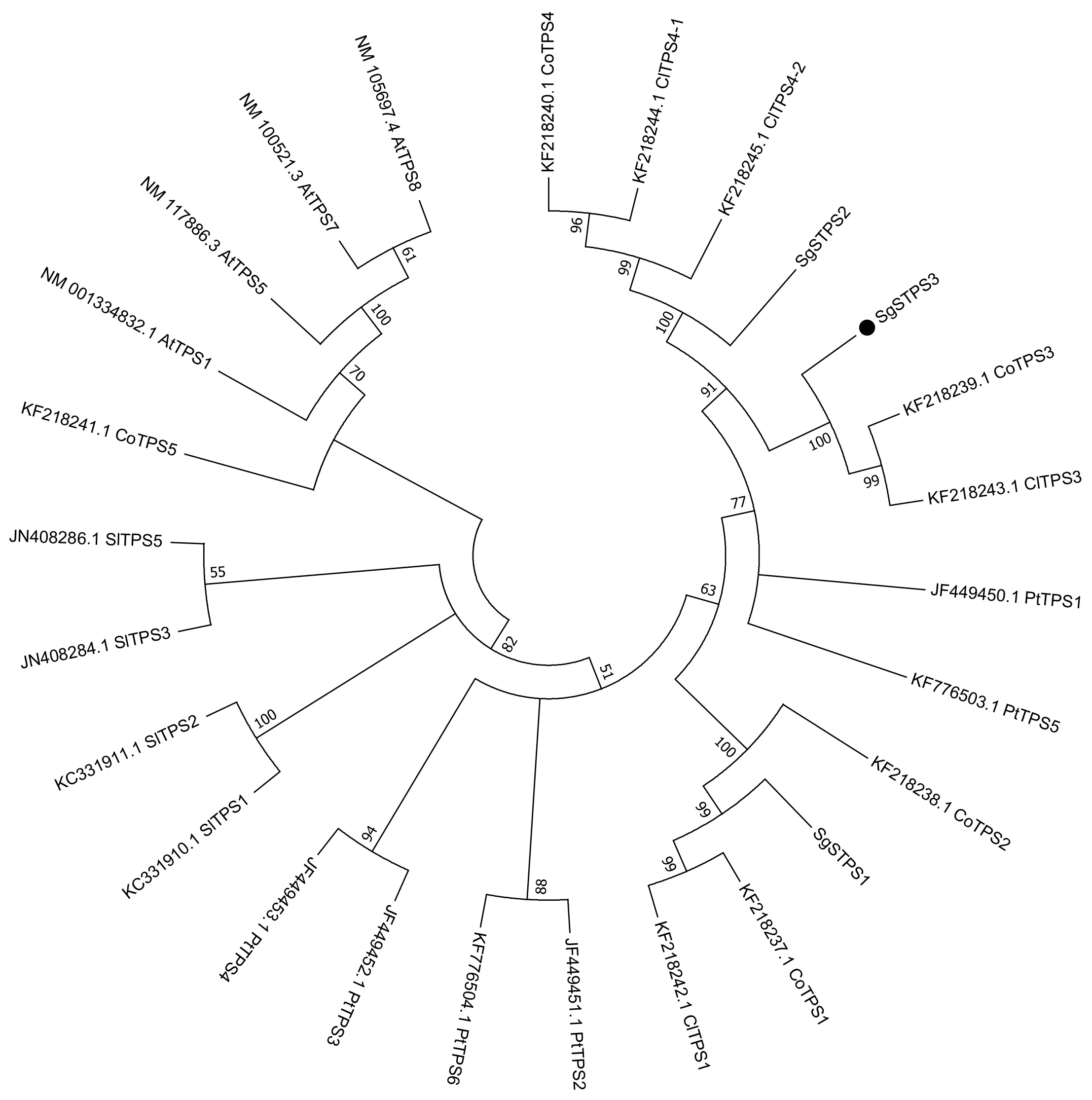
图3 不同植物TPS同源蛋白序列的系统进化树分析Fig.3 Phylogenetic tree analysis of TPS homologous protein sequences of different plantsJF449450.1 PtTPS1,JF449451.1 PtTPS2,JF449452.1 PtTPS3,JF449453.1 PtTPS4,KF776503.1 PtTPS5,KF776504.1 PtTPS6:毛果杨 Populus trichocarpa;JN408284.1 SlTPS3,JN408286.1 SlTPS5,KC331910.1 SlTPS1,KC331911.1 SlTPS2:番茄Solanum lycopersicum;KF218237.1 CoTPS1,KF218238.1 CoTPS2,KF218239.1 CoTPS3,KF218240.1 CoTPS4,KF218241.1 CoTPS5:古巴香胶树 Copaifera officinalis;KF218242.1 ClTPS1,KF218243.1 ClTPS3,KF218244.1 ClTPS4-1,KF218245.1 ClTPS4-2:兰氏香脂树 Copaifera langsdorffii;NM001334832.1 AtTPS1,NM100521.3 AtTPS7,NM105697.4 AtTPS8,NM117886.3 AtTPS5:拟南芥 Arabidopsis thaliana.
2.2 SgSTPS3蛋白的功能分析
2.2.1 SgSTPS3蛋白原核表达载体构建及表达 将成功构建的原核表达载体SgSTPS3-pET30a重组质粒转化至感受态大肠杆菌BL21中表达,结果显示,在20 ℃条件下培养16 h时蛋白在上清液中表达量较高(图4A),该蛋白为可溶性蛋白。
2.2.2 重组蛋白纯化与验证 SDS-PAGE分析如图4B所示。当使用50 mmol·L-1咪唑洗脱组分时,目的蛋白条带清晰明亮,非特异性蛋白量较少,蛋白纯度相对较高;使用20 mmol·L-1和500 mmol·L-1咪唑洗脱组分时,有少量非特异性蛋白与介质结合。使用50 mmol·L-1洗脱缓冲液效果更佳。SDS-PAGE 电泳分析在理论分子量±5 kDa 相应位置出现明显条带(图4C),可初步确定融合蛋白成功得到了纯化。Western Blot验证结果显示目的条带大小与理论相一致(图4D),表明该蛋白为目的蛋白,测得蛋白浓度为0.33 mg·mL-1。
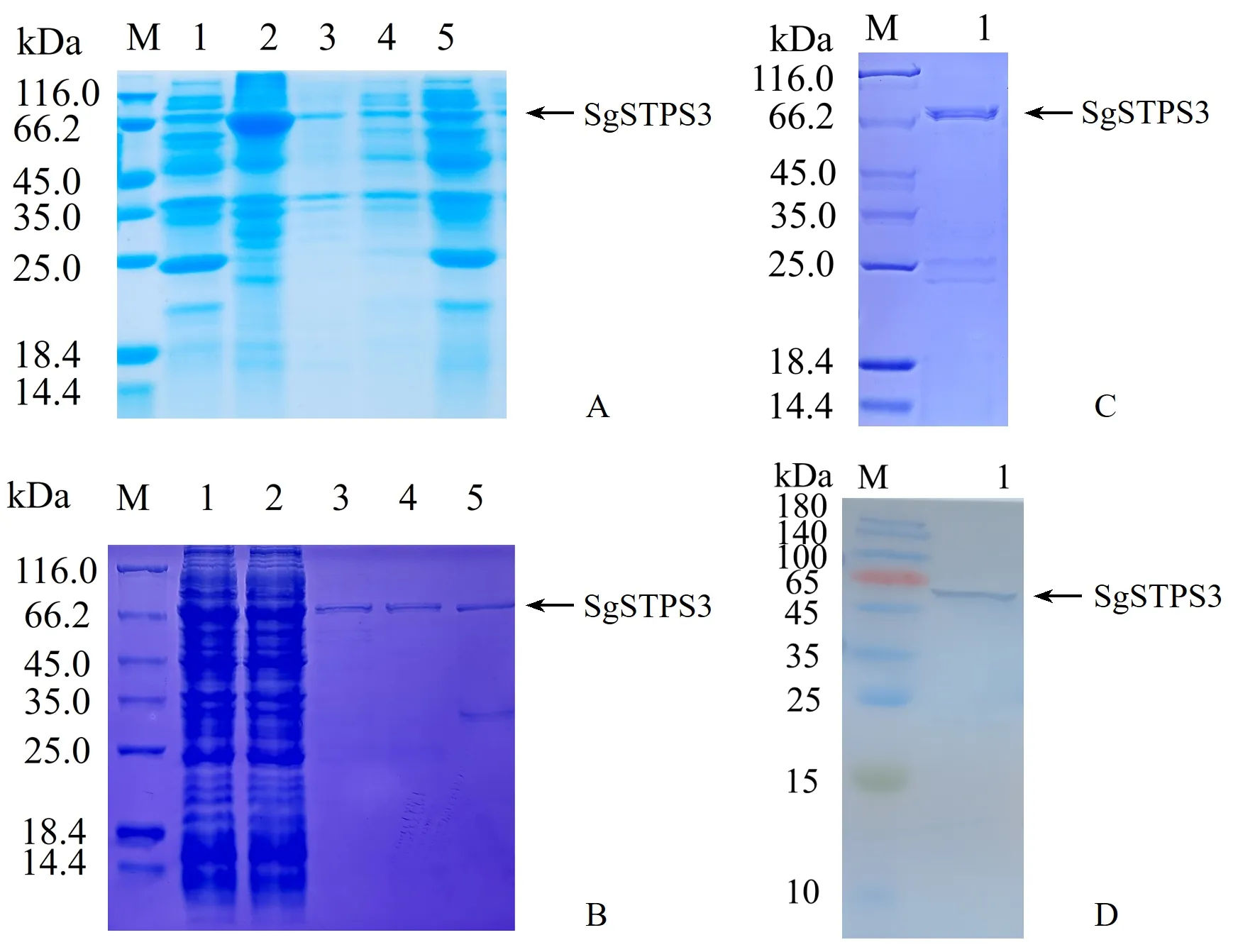
图4 蛋白表达、纯化与Western Blot分析Fig.4 Protein expression,purification and Western Blot analysis diagramA:融合蛋白表达SDS-PAGE分析图(M:Protein marker;1:诱导前总蛋白;2:20 ℃上清;3:20 ℃沉淀;4:37 ℃上清;5:37 ℃沉淀);B:融合蛋白纯化SDS-PAGE分析图(1:上样;2:流出;3:20 mmol·L-1 咪唑洗脱组分;4:50 mmol·L-1 咪唑洗脱组分;5:500 mmol·L-1 咪唑洗脱组分);C:SgSTPS3纯化蛋白SDS-PAGE分析图;D:SgSTPS3纯化蛋白Western Blot分析图。A:SDS-PAGE analysis diagram of fusion protein expression test(M:Protein marker;1:Total protein before induction;2:20 ℃ supernatant;3:20 ℃ precipitation;4:37 ℃ supernatant;5:37 ℃ precipitation);B:SDS-PAGE analysis diagram of fusion protein purification(1:Sample loading;2:Outflow;3:20 mmol·L-1 imidazole elution component;4:50 mmol·L-1 imidazole elution component;5:500 mmol·L-1 imidazole elution component);C:SDS-PAGE analysis diagram of SgSTPS3 purified protein;D:Western Blot analysis diagram of SgSTPS3 purified protein.
2.2.3 酶促反应和GC-MS分析 对SgSTPS3进行酶促反应分析(图5)显示,SgSTPS3是一种多功能酶,在以FPP为底物时共产生11种倍半萜,包括:环苜蓿烯、可巴烯、β-榄香烯、β-依兰烯、顺式-β-可巴烯、异喇叭烯、γ-衣兰油烯、大牛儿烯D、α-衣兰油烯、广藿香烯、γ-古芸烯。其中环苜蓿烯、可巴烯及顺式-β-可巴烯为主要产物,占比分别为27.94%、24.11%、27.03%。以GPP为底物时,酶促产物的GC-MS分析显示主要形成单萜化合物芳樟醇,占比为12.90%。

图5 SgSTPS3蛋白体外酶活性分析Fig.5 Analysis of enzyme activity of SgSTPS3 protein in vitro1,2,3,4,5,6,7分别为芳樟醇、环苜蓿烯、可巴烯、β-榄香烯、顺式-β-可巴烯、γ-衣兰油烯、α-衣兰油烯。1,2,3,4,5,6 and 7 are linalool,cyclosativene,copaene,β-elemene,cis-β-copaene,γ-muurolene,α-muurolene,respectively.
2.3 SgSTPS3基因时空表达及激素响应模式分析
2.3.1SgSTPS3基因时空表达特异性分析 由图6可以看出,SgSTPS3基因表现出多样化的表达模式,以各个年龄基因表达量最低的器官作为对照。基因表达量在0.5年生植株5个不同器官间差异显著,根部表达量最高,木质部表达量最低,根部为木质部基因表达量的52.6倍。基因表达量在1.5年生植株韧皮部、嫩叶中与老叶间差异显著。成年植株韧皮部表达量最高,其他4个器官间表达无显著性差异;15年生植株木质部表达量最低,韧皮部是木质部的12.3倍,30年生植株老叶表达量最低,韧皮部是老叶的986倍。
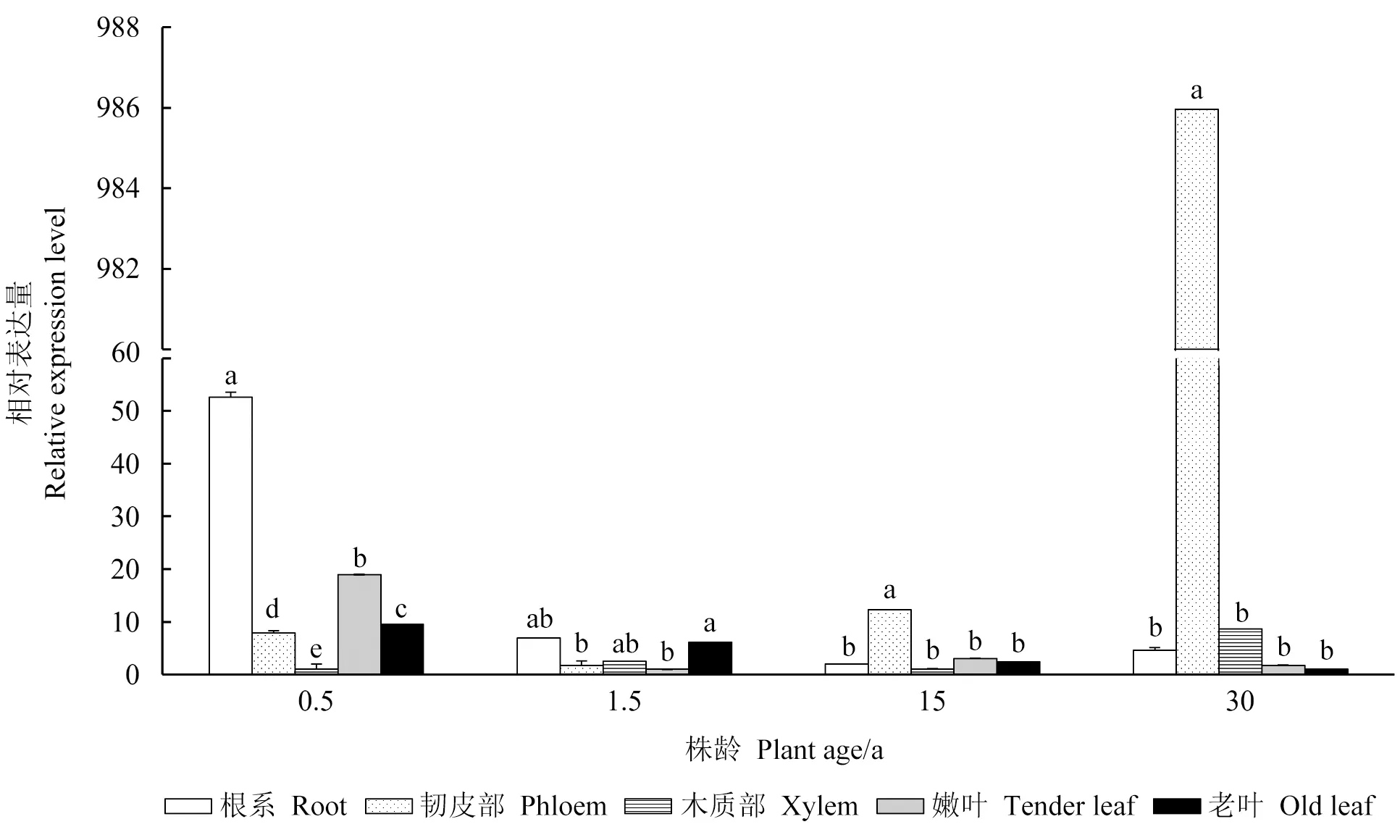
图6 油楠同龄植株不同组织中SgSTPS3基因表达量Fig.6 Gene expression of SgSTPS3 in different organs of S. glabra plant at the same age不同小写字母表示统计学差异显著(P<0.05),下同。0.5年生植株基因相对表达量对照器官为木质部,1.5年生为嫩叶,15年生为木质部,30年生为老叶。Different lowercase lerrers indicate significant statistical differences (P<0.05),the same below.Relative gene expression control organs:0.5 years old for xylem,1.5 years old for tender leaves,15 years old for xylem,30 years old for old leaves.
为比较SgSTPS3在各器官在不同年龄中的相对表达量(图7),以0.5年生植株各器官为对照。根部、韧皮部、木质部表达表现出清晰的规律,根部基因相对表达量随株龄的增加显著减小,木质部中则随株龄的增加而增大;0.5、15、30年生植株韧皮部基因表达量呈递增趋势,各株龄间差异显著,且均高于1.5年生韧皮部,30年生为1.5年生基因表达量的303.5倍。此外,0.5年生和15年生嫩叶中基因表达量显著高于1.5年生和30年生,3个较小年龄的老叶基因表达量显著高于30年生老叶。
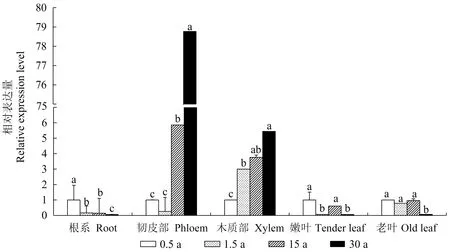
图7 油楠植株不同株龄同一器官中SgSTPS3基因表达量Fig.7 Expression levels of SgSTPS3 in the same organs of S. glabra at different ages SgSTPS3基因在各器官中的相对表达量,以0.5年生相应器官作为对照。The relative expression of SgSTPS3 in various organs was compared with the corresponding organs of 0.5 years old plant.
2.3.2SgSTPS3基因不同激素诱导下表达差异 分别检测SgSTPS3基因在不同激素诱导下的响应情况(图8),对照组基因表达量随时间的推移无显著变化。SA处理下,基因表达水平显著上升,在处理12 h时SgSTPS3基因的表达量快速升高为0 h的35.1倍。MeJA诱导表达的效果呈现先促进后抑制再促进的趋势,在6 h时升高为原来的7.3倍,在24 h时表达量下降为原来的0.1倍,随后有小幅增加。SA+MeJA混合激素处理12 h时基因表达量升高至4.1倍。对照组与各激素处理24 h时,基因表达量均低于12 h,激素诱导可能对该基因具有先正调控后负调控的诱导机制,需通过进一步的试验进行验证。
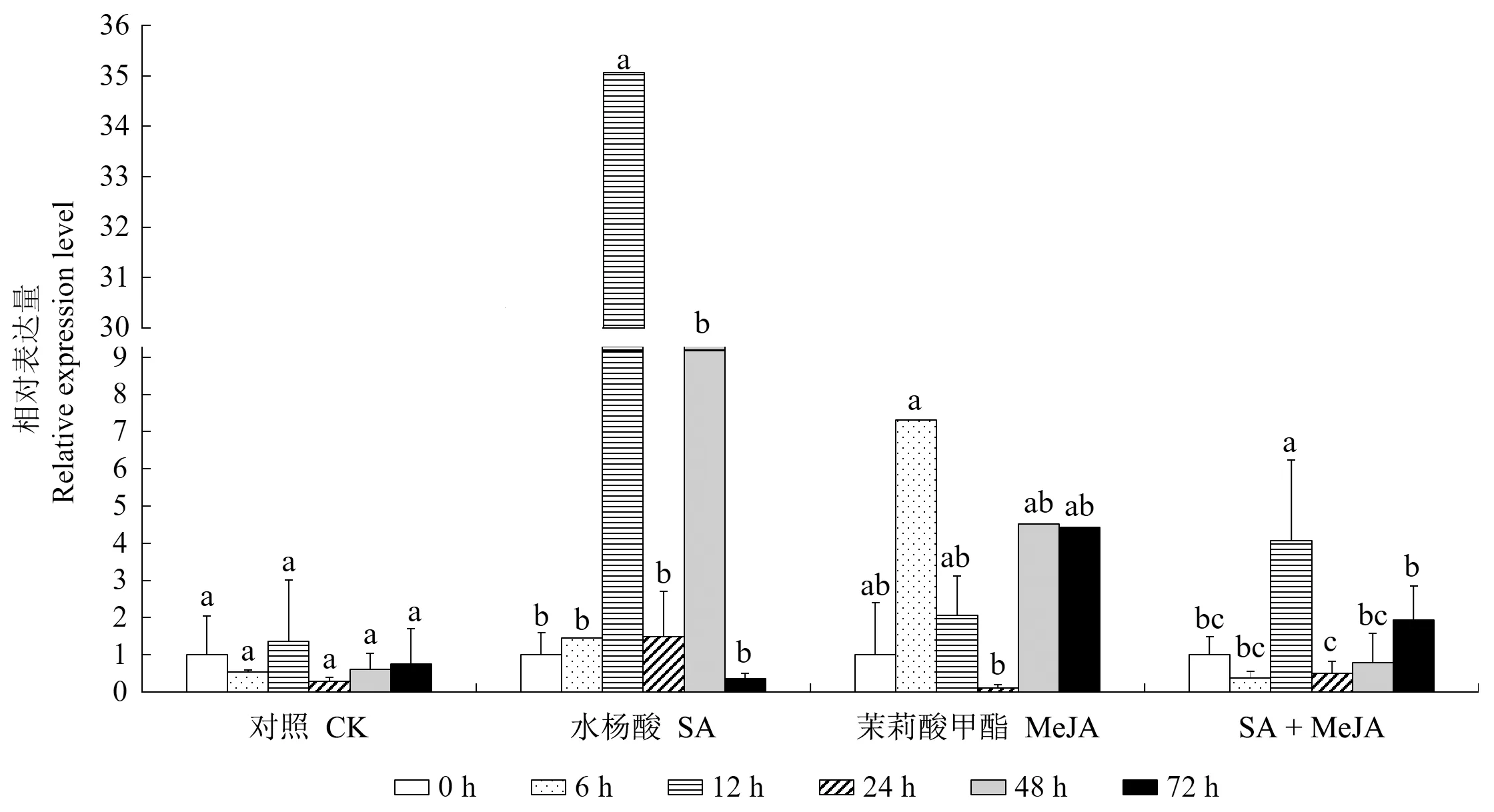
图8 SgSTPS3基因在不同外源激素处理下在油楠叶片中的表达量Fig.8 Expression levels of SgSTPS3 in leaves of S. glabra with different exogenous hormone treatments以各处理下0 h时SgSTPS3的基因表达量作为对照。The SgSTPS3 gene expression level at 0 h under each treatment was used as a control.
3 讨论
萜类化合物是植物次生代谢产物的最大家族,本研究克隆了SgSTPS3并进行表达量分析。生物信息学分析显示该基因所编码的蛋白定位于细胞质中,属于ClassⅠ超家族。氨基酸序列具有萜类化合物保守结构域DDXXD、RRX8W、RXR及NSE/DTE。系统进化分析显示与古巴香胶树CoTPS3氨基酸序列相似性最高,为87.68%;根据已知CoTPS3编码560个氨基酸,主要催化FPP产生倍半萜法尼醇和α-甜没药烯,为倍半萜合成酶(Joyce,2013),推测SgSTPS3编码蛋白为油楠的倍半萜类合成酶。
对SgSTPS3进行酶促反应显示,以FPP为底物时,SgSTPS3与CoTPS3获得产物不同,其催化产生了11种倍半萜,其中主要产物为环苜蓿烯、可巴烯及顺式-β-可巴烯,也催化GPP产生单萜芳樟醇。目前已知的多数萜类合成酶都具有多底物催化功能(Chenetal.,2011),如玉米(Zeamays)ZmTPS1,不仅可以催化产生倍半萜E-β-法尼烯和E,E-法尼醇,还可催化产生单萜橙花叔醇(Schneeetal.,2002)。金鱼草(Antirrhinummajus)AmNES/LIS-1、AmNES/LIS-2蛋白都具有同时催化FPP和GPP的能力,可生成芳樟醇和橙花叔醇(Nagegowdaetal.,2008)。据报道,油楠倍半萜类合成酶SgSTPS1在以FPP为底物时,催化产生β-石竹烯以及少量的异丁子香烯和蛇麻烯,以GPP为底物进行酶促反应时,产生少量的芳樟醇和香叶醇;SgSTPS2催化FPP产生12种倍半萜类化合物,主要产物为榄香烯、依兰烯、β-蒎烯及大牛儿烯D,催化GPP产生3种单萜类:芳樟醇、香叶基甲基醚、香叶醇(Yuetal.,2018)。本文图5显示,SgSTPS3也是一种多功能酶,在以FPP为底物时共产生11种倍半萜,主要是环苜蓿烯、可巴烯及顺式-β-可巴烯。环苜蓿烯具有抗氧化和抗癌的功能(Türkezetal.,2015);可巴烯无毒性,能增加人体淋巴细胞的抗氧化性(Türkezetal.,2014)。不同油楠倍半萜类合成酶催化产物种类有较大差异,可能与其酶蛋白的结构密切相关(王凌健等,2013)。本研究唯一检测到的单萜类为芳樟醇,研究表明天然芳樟醇具有抗菌消炎的作用,在医疗和食品领域的应用十分广泛。因此,该研究为利用合成生物学方法生产药用萜类化合物提供了重要的基因资源。
解析油楠中倍半萜的生物合成机制,重要的是探索这些物质合成与积累的部位。Yu等(2018)的研究表明SgSTPS1、SgSTPS2基因在不同器官中表达水平不同,SgSTPS1在根中表达量最高,SgSTPS2在叶、韧皮部和根中均表达量高,且基因的表达模式与萜类化合物在油楠植株组织中的积累呈正相关。本研究对SgSTPS3进行时空表达模式探索,发现该基因在0.5年生幼株根中表达最高,这与Yu等(2018)发现的2个基因在根中表达量丰富的结果比较一致;SgSTPS3基因在30年生植株的韧皮部表达量高,这可能与韧皮部主要负责同化物的装载和运输且细胞代谢旺盛等特性有关;另外,SgSTPS3基因在木质部的表达量随株龄的增大而增加,这与野外油楠植株泌油特性比较吻合(吴忠锋等,2014;Yuetal.,2020),预示该基因的表达变化可能解释油楠天然群体不同组织中一些萜类化合物含量的变化。根据对油楠成年植株树干泌油特性的观察,泌油仅发生在木质部;而本研究发现15和30年生的成年植株SgSTPS3的表达量均是韧皮部高于木质部,这与油楠树干泌油规律(陆碧瑶等,1982;吴忠锋等,2014)不一致;后期需要通过检测不同年龄植株韧皮部和木质部中萜类化合物含量,进一步研究该基因的表达丰度,同时验证该基因是否具有指征油楠树脂油中萜类化合物含量的潜在作用。
水杨酸和茉莉酸甲酯具有诱导植物次生代谢相关基因表达、促进次生代谢产物积累的作用,食草动物、病菌的侵袭及机械损伤有类似的诱导效果 (王焕,2015;Ozawaetal.,2000;Martinetal.,2003)。本研究中,激素对SgSTPS3基因表达有一定的调控作用,但调控效果不同,SA(50 μmol·L-1)的诱导水平强于MeJA(100 μmol·L-1)及SA(50 μmol·L-1)+MeJA(100 μmol·L-1)的混合液。前人对SA和MeJA诱导萜类合成相关基因在不同植物中的表达进行了大量的研究。Shabani等(2010)用5种不同浓度的MeJA和SA处理洋甘草(Glycyrrhizaglabra),检测三萜角鲨烯合成酶(squalene synthase,SQS)和β-香树脂醇(β-amyrin synthase,bAS)基因表达量的变化,不同浓度激素对萜类合成酶的基因表达诱导间存在差异:SQS基因在MeJA所有5个浓度诱导下均上调,但SA的诱导仅在浓度为0.1、1.0 mmol·L-1时为正调控;bAS基因在MeJA浓度为0.1、1.0 及2.0 mmol·L-1的诱导下表达量增加,仅在SA浓度为0.1、1 mmol·L-1处理时增加。Majdi等(2015)外施SA(1 mmol·L-1)和MeJA(100 μmol·L-1)于1月龄小白菊(Tanacetumparthenium)植株上,倍半萜类化合物小白菊内酯含量表现出不同程度的增加。Chen等(2009)研究了古巴香胶树幼苗体内倍半萜的分布和挥发,发现未受伤的幼苗分泌极少量的倍半萜,而受到机械损伤的幼苗可以分泌大量的倍半萜。以上研究均表明,不同激素、不同激素浓度及机械损伤对基因表达、化合物的累积有一定的诱导作用。在今后的研究中,可通过对成年油楠植株喷施MeJA、水杨酸等激素或机械损伤的方式,检测不同株龄油楠植株的不同组织器官在逆境和激素诱导下树脂油的分泌状况及基因表达特性,探究激素处理或受伤是否诱导植株中特定相关萜类合成酶基因的表达从而提高其产物得率,为调控油楠树脂油萜类化合物的含量与组成提供理论基础。
4 结论
本研究克隆得到SgSTPS3基因并分析其表达模式。该基因为多功能萜类合成酶,催化FPP主要产生倍半萜环苜蓿烯、可巴烯及顺式-β-可巴烯,催化GPP主要产生单萜芳樟醇。SgSTPS3在0.5年生幼株根部表达量较高,在30年生植株韧皮部表达量较高,在木质部的表达量随株龄增大而增加。同时50 μmol·L-1SA可诱导其表达,MeJA(100 μmol·L-1)诱导效果次之。本研究为阐明林木萜类化合物的合成和调控提供一定的参考。

