肺脓肿术后发生心脏损伤后综合征的诊治
高 莉 韩利红 郑州大学附属洛阳中心医院呼吸重症监护病区,河南省洛阳市 471000
心脏损伤后综合征(Post-cardiac injury syndrome,PCIS)被认为是一种由多种原因引起的心脏损伤后出现的自身免疫反应,病因不明,临床表现为发热、胸腔积液、心包积液、肺实质炎症等[1]。文献报道PCIS常见于心脏外科及介入术后、心梗后、射频消融术后或起搏器植入术后等。本文报告了1例右下肺脓肿术后发生PCIS的临床表现及诊治过程,希望对该病的诊疗提供新的认识。
1 病例资料
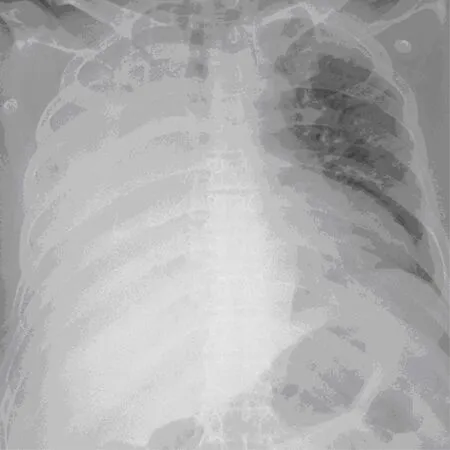
患者男,10年前因劳累后出现阵发性咳嗽,伴咳中量黄色脓痰,无畏寒发热,无鼻塞、头疼,无夜间阵发性呼吸困难,至郑州大学附属洛阳中心医院就诊,完善胸部CT提示支气管扩张伴感染、肺脓肿,予以抗感染、清热、化痰等药物应用,症状缓解。后因反复咳嗽、咳痰及发热住院治疗。1个月前再次咳大量黄色脓痰,伴间断发热,体温高峰不详,无畏寒、寒战,伴有气喘,至郑州大学附属洛阳中心医院门诊就诊行胸部CT(2020年9月14日)示:(1)右肺多发支气管扩张伴感染,部分实变;右肺下叶空洞形成;(2)右肺上叶前段感染并邻近肺大泡内积液;(3)纵隔及右肺门多发淋巴结;(4)右侧胸膜增厚粘连。 当时建议住院治疗,患者拒绝,自服药物治疗,效果不理想,后再次至郑大附属洛阳中心医院呼吸科住院治疗,给予抗感染、化痰及对症治疗,病情控制后转入胸外科并于2020年10月15日行右肺下叶切除术,术后给予抗感染治疗,但逐渐出现胸闷气喘,症状持续不能缓解,行床旁胸片示右侧胸腔积液(图1a),给予留置胸腔闭式引流管,胸腔积液初期为血性积液后转为深黄色积液,胸腔积液引流后患者胸闷气喘症状稍缓解,但每日可引出胸水300~500ml不等,活动后仍感气喘不适,遂转回呼吸科,复查胸部CT(图1b):右侧胸腔积液,心包少量积液,继续给予胸腔引流及抗感染、甲泼尼龙琥珀酸钠抗炎平喘治疗,患者胸腔积液逐渐减少,每日可引出100~200ml不等,给予夹闭引流管后胸腔积液未再增多,给予拔出胸腔引流管并于2020年10月31日出院。于2020年11月6日至门诊复查胸部CT(图1c)示:右下肺切除术后改变,右侧胸腔积液较前略减少,右肺感染较前稍吸收好转,心包少量积液同前。患者于2020年11月30日因与他人发生争执后出现右侧胸痛,无胸闷、呼吸困难、咯血,无意识丧失,复查床旁胸片示: 右下肺切除术后改变,右肺感染大致同前,右侧肋膈角变钝,给予塞来昔布口服后症状缓解出院。患者于2020年12月2日再次出现胸闷气喘,活动耐力明显下降,入院后行胸部CT示(图1d):胸腔积液大致同前,心包积液明显增多,考虑为心包填塞所致,给予心包穿刺引流,心包积液初期呈血性后转为淡黄色,心包积液常规及生化检测提示渗出液,积液行脱落细胞检查未见肿瘤细胞,行结核菌涂片及多次心包积液培养未见异常,患者心包积液共计引流出2 000ml后仍可每日引出300ml,结合患者前后病史特征考虑为外科手术后诱发PCIS可能性大,遂加用甲泼尼龙40mg,1次/d,静滴,患者心包积液逐日减少,静滴7d后拔出心包引流管,并改为泼尼松20mg/d口服,半个月后来院复查胸部CT未见有心包积液,胸腔积液较前明显减少,后逐步减量(每周减5mg)至停用泼尼松,停用后患者病情未再反复。
a
2 讨论
2.1 PCIS的发病机制 PCIS的发病机制不明,当前被普遍认可的观点是心脏损伤后抗原释放导致易感人群发生的自身免疫反应,Puhl Sarah-Lena等人的研究表明,中性粒细胞的激活和促炎细胞因子的释放会损害胸膜、心包的间皮细胞,进一步诱发PCIS的发生[2],心脏损伤多见于心肌坏死、手术创伤、意外胸外伤或医源性外伤等。损伤发生后心脏抗原被释放入血,刺激机体产生自身抗体,形成的免疫复合物在胸膜、肺、心包和关节中沉积,从而导致多浆膜腔积液及肺实质炎性改变[3]。大多PCIS见于冠脉PCI术后、起搏器植入术后、射频消融等各种心脏疾患干预后导致的心脏损伤,而本例患者出现PCIS是继发于右肺下叶脓肿切除术后,推测可能是手术后胸膜损伤诱发心脏抗原产生,刺激机体产生抗体,进而导致PCIS的发生,同时该患者术后2d即出现右侧大量胸腔积液,不排除为PCIS导致的胸腔积液可能,在治疗胸腔积液的过程中因胸闷、气喘、有糖皮质激素应用史,经治疗后胸腔积液逐渐减少。目前针对胸膜损伤与心包之间联系的研究甚少,尚不明确两者之间的关系和作用机制,但有报道发现胸膜损伤是PCIS的独立危险因素。
2.2 PCIS 的临床表现及诊断 大多数PCIS患者会出现胸痛(>80%);低热;炎性标志物[即C-反应蛋白(CRP)和红细胞沉降率(ESR)]水平升高;心包积液;胸腔积液伴或不伴肺浸润。50%~60%的患者伴有呼吸困难,30%~60%的患者可扪及胸膜或心包摩擦感,超过20%的患者会出现心电图改变,且具有明显的类固醇反应[4]。宋红星等人[5]的研究发现高龄或伴高血压的患者更易发生 PCIS。本例患者主要以胸痛、胸闷气喘来诊,曾出现一过性低热,入院后查CRP升高,多次胸部CT发现心包及胸腔积液,无明显诱因情况下出现心包积液增多,导致心脏填塞症状出现,且排除其他导致积液形成的原因,给予非甾体消炎药及糖皮质激素治疗效果佳,符合PCIS的临床特征。目前,PCIS的诊断主要通过排除法, Shrivastava R等人建议要求至少有以下5个标准中的2个:无其他原因的发热,胸膜炎性胸痛,心包或胸膜摩擦感,新的或恶化的心包积液以及胸腔积液并结合患者临床表现。也有学者认为可测定患者胸腔积液及血清中抗心肌抗体的比值进一步协助诊断,当胸腔积液及血清中抗心肌抗体的比值>1时考虑PCIS,但抗心肌抗体特异性不高,目前尚未广泛应用于临床。Kumar的研究证实胸腔积液的高pH也可用于鉴别感染性疾病导致的胸腔积液,PCIS导致胸腔积液多为高pH,且多数PCIS患者胸水为渗出液、呈血性[6],而本例患者的胸腔及心包积液均为渗出液,初期呈血性,与Kumar的报道一致。
2.3 PCIS的治疗 2015 ESC心包疾病诊断与管理指南推荐急性心包炎的一线治疗药物是非甾体抗炎药(NSAIDs)和秋水仙碱,类固醇是控制症状的二线药物,而硫唑嘌呤和免疫球蛋白是三线药物,阿司匹林是治疗心梗后继发PCIS的首选药物,所有药物中以糖皮质激素的治疗效果最佳。目前国内关于激素使用的剂量及治疗疗程尚无统一推荐,但国外有研究证实,低剂量激素[泼尼松0.2~0.5mg/(kg·d)]较高剂量激素[泼尼松1mg/(kg·d)]具有更少的不良反应以及更低的住院率、治疗失败率,同时可根据患者临床症状的改善和炎性标记物的变化而逐渐减少剂量至停用。2015 ESC心包疾病诊断与管理指南中推荐当泼尼松剂量>50mg时可每1~2周减量10mg,泼尼松剂量在25~50mg时每1~2周减量5~10mg,剂量为15~25mg时每2~4周减量2.5mg,而剂量<15mg时每2~6周减量1.25~2.5mg。过早、过快的激素减量可能导致复发。
本病例是继发于右下肺脓肿切除术后的PCIS,目前罕有报道,推测原因可能为胸膜损伤后刺激心脏抗原产生导致PCIS发生,该病例提醒临床医生,PCIS虽常见于PCI术后、心脏外科手术、心肌梗死及起搏器植入或射频消融术后,但如遇到肺部术后的患者出现排除其他原因的多浆膜腔积液,积液呈血性,为渗出液,具有高pH值,积液抗心肌抗体与血清抗心肌抗体比值>1,伴有发热、胸痛以及CRP或ESR升高时应考虑PCIS 的可能,需及早采取干预措施,避免延误PCIS的诊断,防止危及患者生命并发症的发生,也希望有更多的研究去证实肺部术后胸膜损伤与心包之间的联系,进一步明确胸膜损伤后发生PCIS的机制。

