固相萃取净化-超高效液相色谱-串联质谱法检测茶叶中胺菊酯
叶美君,潘胜东,杜颖颖,李文萃,陆小磊,刘相真*
(1.中华全国供销合作总社杭州茶叶研究院,浙江杭州310016;2.宁波市疾病预防控制中心,浙江省微量有毒化学物健康风险评估技术研究重点实验室,浙江宁波315010)
我国是茶树的原产地,是世界上发现和利用茶树最早的国家,具有近3000年的种茶、用茶历史。目前,我国的茶园种植面积、茶叶产量、消费量和出口额等指标均居世界第一,茶产业已成为我国茶叶主产区特别是中西部欠发达地区的富民产业、支柱产业,在决战脱贫攻坚、助力乡村振兴中发挥着重要的作用。
技术贸易壁垒(TBT)中绿色贸易壁垒一直是我国茶叶出口增长的最大障碍,近年来,欧盟、美国、日本、韩国等国家和地区不断调整农药残留限量标准,导致我国出口茶叶常因农药问题被通报和扣留[1]。胺菊酯可降解为四氢邻苯二甲酰亚胺,并进一步氧化为邻苯二甲酰亚胺。鉴于邻苯二甲酰亚胺食品安全风险,根据法规EU2016/156,从2016年8月26日起,欧盟启用杀菌剂灭菌丹的新定义:灭菌丹及其代谢物邻苯二甲酰亚胺,茶叶中限量为0.1 mg/kg[2]。目前国内茶叶尚无邻苯二甲酰亚胺和胺菊酯的残留限量标准,只有出口欧盟的茶叶有监测该项目。食品中针对该类物质的检测方法研究较少,茶叶中邻苯二甲酰亚胺的检测主要集中在气相色谱质谱法[3-5],胺菊酯的研究主要集中在原药制备、剂型分析,相关检测方法主要集中在气相色谱或气相色谱-质谱法,液相色谱或液相色谱-质谱法检测胺菊酯相关报道较少[6-8]。
胺菊酯CAS号为7696-12-0,分子量为331.4,纯品为白色结晶固体,具有除虫菊气味,在弱酸性条件下稳定。在30℃条件下,水中的溶解度为4.6 mg/L;在25℃条件下,苯、二甲苯、甲苯、丙酮、甲醇、乙醇等溶剂中的溶解度分别为50%、50%、40%、40%、5%和4.5%。50℃下贮藏6个月后不丧失生物活性,正常条件下,贮存两年稳定。胺菊酯由日本加藤武明(KATO T)等于1964年首先研制,由日本住友化学公司(Sumitomo Chemical Co.,Ltd.)、美国食品机械化学公司(FMC)等先后开发,商品名称为诺毕那命、Neo-Pynamin、Phthalthrin Chemical book等。胺菊酯为世界卫生组织推荐用于公共卫生的主要杀虫剂之一,用于防治蚊、蝇、蟑螂等害虫,具有触杀作用,对蜚蠊有驱赶作用,但致死性能差,有复苏现象。胺菊酯属于神经毒剂,大量摄入致人中毒,会引起头痛、头昏、恶心呕吐、双手颤抖,重者抽搐或惊厥、昏迷、休克[9]。
在茶园管理过程中尚未见胺菊酯作为杀虫剂使用的报道,茶叶中胺菊酯等污染物可能在生产或流通过程中引入。监测茶叶中胺菊酯残留水平和排查该类物质污染源的首要任务是建立一种快速、灵敏、准确的检测方法。鉴于此,选择高灵敏度的UPLC-MS/MS作为检测仪器,采用固相萃取法,以石墨化碳黑-氨基复合固相萃取小柱作为吸附剂对茶叶提取液进行净化,降低UPLC-MS/MS检测过程中基质干扰,同时该方法具有准确、灵敏和通用性强等优点,可为茶叶安全风险监测与评估提供有效的技术支撑。
1 材料与方法
1.1 仪器与设备
UPLC/TSQ Quantum Access MAX超高效液相色谱-三重四极杆质谱联用仪(美国Thermo Fisher Scientific公司);分析天平(感量0.0001 g,瑞士METTLER TOLEDO公司);SC-3610低速离心机(安徽中科中佳科学仪器有限公司);VM06型SPE装置(天津艾杰尔公司);T10高速组织分散机(德国IKA公司);KQ5200E超声波清洗器(昆山超声仪器有限公司);VORTEX-5旋涡混合器(其林贝尔Kylin-bell);HY-5型回旋振荡器(江苏省金坛市荣华仪器有限公司);CS501旋转蒸发仪(上海瑞立科学仪器有限公司);MTN-2800D氮吹浓缩装置(天津奥特赛恩斯仪器有限公司)。
1.2 试剂与材料
胺菊酯(100.2μg/mL,1 mL,AccuStandard);磷酸三苯酯(TPP,分析纯,含量99%,河北百灵威超精细材料有限公司),乙腈、甲醇和甲酸(色谱纯,德国Merck公司);乙酸铵(色谱纯,美国Fluka公司);乙腈和甲苯(分析纯,华东医药股份有限公司);醋酸(分析纯,上海凌峰化学试剂有限公司),无水醋酸钠(分析纯,温州吉象化学股份有限公司),无水硫酸镁(分析纯,上海试四赫维化工有限公司),乙二胺-N-丙基硅烷化硅胶PSA(40~60 μm,岛津技迩商贸有限公司),十八烷基硅烷键合硅胶C18(40~60μm,上海安谱科学仪器有限公司),石墨化碳黑GCB(40~120μm,天津艾杰尔公司),石墨化碳黑-氨基复合柱(WondaSep GC-e/NH26 mL 500 mg/500 mg,岛津技迩商贸有限公司);50 mL塑料螺纹具塞离心管(上海安谱科学仪 器 有 限 公 司);200 mL圆 底 烧 瓶,0.5、1、5、10 mL刻度移液管(天津市天玻玻璃仪器有限公司);2 mL一次性无菌注射器(华东医药股份有限公司);0.22μm微孔过滤膜(尼龙,上海迪柯马分析技术有限公司)。
1.3 标准溶液的配制
准确称取0.0750 g TPP于100 mL容量瓶中,加入乙腈溶解并定容至刻度线,得到750 mg/L的标准储备溶液。取1 mL标准储备溶液,用乙腈配制成0.75 mg/L标准使用溶液。
准确移取1 mL胺菊酯标准物质于10 mL容量瓶中,加入乙腈溶解并定容至刻度线,得到10 mg/L的标准储备溶液。取1 mL标准储备溶液,用乙腈配制成1 mg/L标准使用溶液,然后取适量1 mg/L标准使用溶液和TPP内标,加入含茶叶基质(阴性样品)的乙腈溶液,配制成2.5、5、10、50、100、200、400μg/L的基质匹配标准工作溶液,使用内标法定量。
1.4 仪器条件
色谱柱:Thermo Hypersil GOLD C18(150 mm×2.1 mm,1.9μm);流动相A为5 mmol/L乙酸铵水溶液(含10%(v/v)乙腈,0.1%(v/v)甲酸),流动相B为甲醇(含0.1%(v/v)甲酸);柱温:40℃;进样量:4.0μL;电离模式:电喷雾离子化(ESI);电离源极性:正模式;雾化气:氮气;离子喷雾电压:3500 V;雾化室温度:120℃;离子传输管温度:350℃;碰撞气:氩气,0.2 MPa;扫描模式:SRM多反应监测扫描。
1.5 样品前处理
提取:称取经粉碎的茶叶样5.0 g于50 mL离心管中,加入2.0 g氯化钠,然后加入20 mL乙腈(1%醋酸),匀浆提取1 min,2500 r/min离心5 min,重复提取两次,合并提取液,40℃旋蒸浓缩至近干。
净化:在WondaSep GC-e/NH2固相萃取柱中加入约2 cm高无水硫酸钠,5 mL乙腈/甲苯(3∶1,v/v)淋洗液以1 mL/min流速润洗WondaSep GCe/NH2SPE小柱,弃去流出液,用5 mL乙腈溶解,移取3 mL于SPE小柱净化,用15 mL淋洗液以1 mL/min流速洗脱SPE小柱,流出液收集于200 mL圆底烧瓶中。
定容:将洗脱液在40℃下减压浓缩近干,加入内标物质TPP,用乙腈定容至约3 mL,供UPLC-MS/MS检测。
2 结果与分析
2.1 液相色谱-质谱条件优化与选择
2.1.1 质谱条件的优化
胺菊酯和TPP的保留时间相近,两种化合物的基质匹配标准曲线斜率也相近,加之TPP在超高效液相色谱-串联质谱中的响应较好,因此采用TPP作为内标物质。将胺菊酯和TPP的标准溶液进入质谱仪器直接分析,采用ESI+模式。在MS+MS/MS模式下,选择信号强度高、稳定性好的准分子离子作为母离子进行优化,超高效液相色谱-串联质谱参数(包括碰撞能量CE、透镜补偿电压Tube lens等)如表1所示。
2.1.2 色谱条件的优化
根据胺菊酯的结构特点,采用通用型的C18色谱柱作为分离柱,分别选择乙腈/水、乙腈/甲酸水溶液、乙腈/水-甲酸-乙酸铵水溶液作为流动相,在10%~90%有机相浓度范围内进行梯度洗脱,考察流动相对胺菊酯检测的影响。在正离子模式下,酸性能够促进化合物的离子化,提高化合物的离子化效率和灵敏度,在水相中添加0.1%甲酸时,胺菊酯的灵敏度高,分离效果满意。在水相中添加5 mmol乙酸铵,胺菊酯峰型对称,信噪比增大,灵敏度提高。
实验结果显示,当选择乙腈/水-甲酸-乙酸铵溶液体系时,胺菊酯的色谱分离、保留和灵敏度情况较为理想,稳定性较好,但内标TPP的稳定性和灵敏度欠佳。选择甲醇/水-甲酸-乙酸铵水溶液作为流动相,内标TPP的响应和稳定性显著提升,但胺菊酯的响应相对乙腈溶液略微下降。根据表3数据综合考虑,在流动相A相中加入10%的乙腈溶剂,胺菊酯的响应提高,保证流动相中甲酸的浓度一致,以提高样品的稳定性和重复性,在流动性B中加入0.1%甲酸。综上所述,采用5 mmol/L乙酸铵水溶液(含10%(v/v)乙腈,0.1%(v/v)甲酸)/甲醇(含0.1%(v/v)甲酸)作为流动相进行梯度洗脱,色谱图如图1所示。

表2 梯度洗脱程序Table 2 Program of the gradient elution
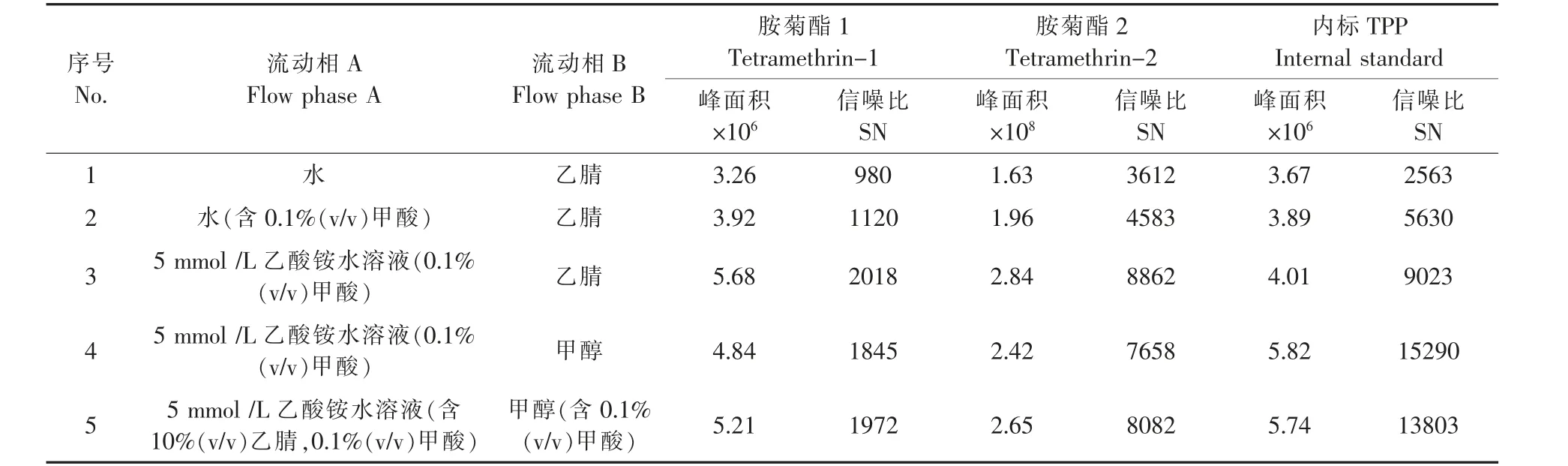
表3 不同色谱条件下胺菊酯和TPP的色谱参数Table 3 Parameters for chromatographic condition of tetramethrin and TPP in different gradient elution

图1 胺菊酯和TPP标准溶液在LC-MS/MS上的色谱图Fig.1 Chomatogram of tetramethrin and TPP in LC-MS/MS
2.2 前处理方法优化
2.2.1 提取方式的选择与优化
茶叶样品中加入适量标准使用溶液,配制添加水平为100.0μg/kg的加标样品,采用超声、旋涡、震荡和匀浆等提取方式,以乙腈为提取试剂,考察提取方式对茶叶中胺菊酯检测的影响。从表4数据可知,超声提取回收率相对较低,旋涡提取和震荡提取回收率相当,匀浆提取回收率较高。匀浆提取具有快速、充分等特点,实验选择匀浆提取的方式。

表4 胺菊酯在不同提取方式下的加标回收率和相对标准偏差(n=3)Table 4 Recoveries and relative standard deviations(RSD)of tetramethrin in different extraction method(n=3)
2.2.2 提取溶剂的选择与优化
基于乙腈良好的提取效率,植物源食品中农药残留检测大量采用乙腈为提取剂[10-11]。茶叶含水率低,在提取之前加入一定量的水浸泡(非提取剂),考察水对茶叶中胺菊酯检测的影响。以添加水平为100.0μg/kg设计两组实验,一组乙腈提取之前,加入10 mL水,静置30 min,加入氯化钠和乙腈,浸泡30 min,采用匀浆提取两次,合并两次提取液,另一组加入氯化钠,加入乙腈浸泡30 min,匀浆提取两次,合并两次提取液,实验结果见表5。
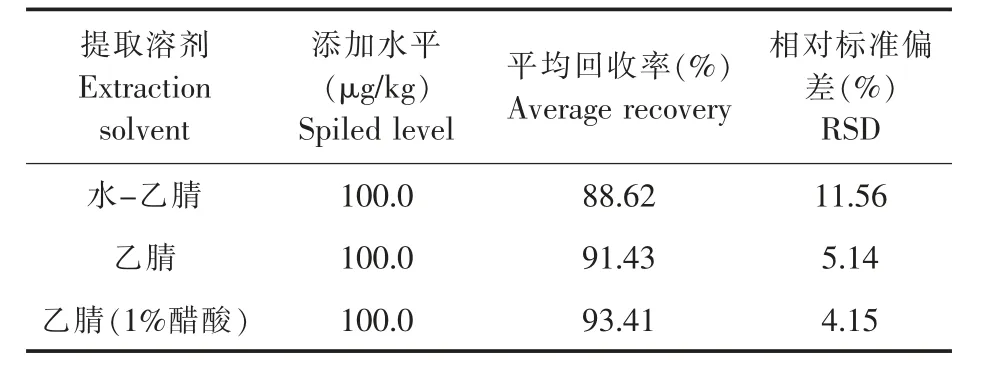
表5 胺菊酯在不同提取溶剂中的加标回收率和相对标准偏差(n=3)Table 5 Recoveries and relative standard deviations(RSDs)of tetramethrin in different extraction solvent(n=3)
三组处理胺菊酯的回收率均在85%以上,回收率满足检测要求。提取剂加入水,茶多酚、茶皂素、茶蛋白等水溶性物质被大量提取出来,杂质增加,增加净化的难度;检测过程中,色谱柱、离子源、四级杆等容易污染,需要频繁维护清洗,影响样品分析检测,整体实验效率下降;水分去除不完全又会导致浓缩无法近干,定量结果存在偏差,RSD偏高,样品检测重现性下降。在乙腈提取剂中加入1%醋酸可以改善胺菊酯在UPLC-MS/MS上的峰型,提高检测灵敏度,胺菊酯的回收率达93.41%。因此,实验选取乙腈(1%醋酸)作为提取试剂。
在茶叶中加入一定量NaCl可以使乙腈和水分离,起到盐析作用,同时NaCl可增加茶叶和匀质仪器刀头间的摩擦,在高速均质中提高茶叶破碎度,使茶叶基质与提取溶剂充分接触,从而提高茶叶中农药的提取率和回收率[12]。
2.2.3 净化方式的选择与优化
对目标化合物进行分离和纯化,主要有基体分散固相萃取(dSPE)和固相萃取(SPE),茶叶中有机酸、脂肪和磷脂较高,GCB、PSA、C18和NH2等填料去杂质效果较优,实验选取GCB、PSA、C18和NH2等填料为分散萃取材料,选取石墨化碳黑-氨基复合柱(GC-e/NH2)评价净化效果。
以添加水平8.0μg/kg和100.0μg/kg的茶叶样品为实验样品,乙腈(1%醋酸)为提取溶剂,匀浆为提取方式,提取溶液减压蒸馏近干,采用10 mL乙腈溶解,移取8 mL溶液于dSPE净化管中待净化,移取6 mL溶液于SPE小柱净化。根据GB 23200.121《食品安全国家标准 植物源性食品中331种农药及其代谢物残留量的测定 液相色谱-质谱联用法》,dSPE净化管的填料配比为无水硫酸镁120 mg,PSA 400 mg,C18400 mg,GCB 200 mg;根据GB 23200.13《食品安全国家标准 茶叶中448种农药及相关化学品残留量的测定 液相色谱-质谱法》SPE洗脱液为乙腈/甲苯(3∶1,v/v),不同净化方式的结果见表6,不同处理方法的胺菊酯色谱图见图2和图3。由于UPLC-MS/MS的高选择性,dSPE和SPE两种方法对胺菊酯的定性和定量无显著影响,因此回收率和重复性无显著性差异。dSPE相对于SPE前处理方法,样品的信噪比较低,目标物附近的基质干扰较大,因此实验采用SPE净化。

图2 茶叶空白样品在UPLC-MS/MS上的色谱图Fig.2 Chomatogram of tetramethrin in blank tea sample

图3 茶叶基质中胺菊酯的UPLC-MS/MS色谱图Fig.3 UPLC-MS/MS chomatogram of tetramethrin in tea matrix

表6 胺菊酯在不同净化方式下的加标回收率和相对标准偏差(n=3)Table 6 Recoveries and relative standard deviations(RSDs)of tetramethrin in purify(n=3)
综上所述,实验以乙腈(1%醋酸)为提取溶剂,匀浆为提取方式,GC-e/NH2为SPE净化小柱,通过前处理方法优化,提高样品检测的准确性、重复性和便捷性。
2.3 方法验证与评价
2.3.1 方法线性方程、检出限和定量限
采用茶叶空白基质配制标准溶液,以胺菊酯与内标物质的质谱响应峰面积比值(Ri)作为纵坐标,浓度作为横坐标绘制标准工作曲线,标准工作曲线为y=0.00166643x,在2.5~400μg/L的浓度范围内呈现良好的线性关系,相关系数r2=0.9983。胺菊酯采用茶叶空白基质逐级稀释,当浓度稀释至2.5μg/L,S/N的值为3,由此确定方法检出限(LOD)为2.5μg/kg,以S/N=10计算最低添加水平(8μg/kg),以8μg/kg为添加水平进行回收率实验,根据最低添加水平的回收率和相对标准偏差确定方法定量限(LOQ)为8μg/kg。
2.3.2 方法准确度和精密度
分别称取5.0 g胺菊酯茶叶阴性样品,然后加入适量标准使用溶液,配制成低、中、高3个浓度水平(8.0、30.0、100.0μg/kg)的加标样品,按照“1.5样品前处理方法”进行提取与净化,然后采用UPLC-MS/MS检测,每一个加标水平测定6次,结果如表7所示。胺菊酯在低、中、高3个浓度水平均有较好的准确度与精密度,平均加标回收率为88.88%~109.87%,RSD为3.29%~8.26%。
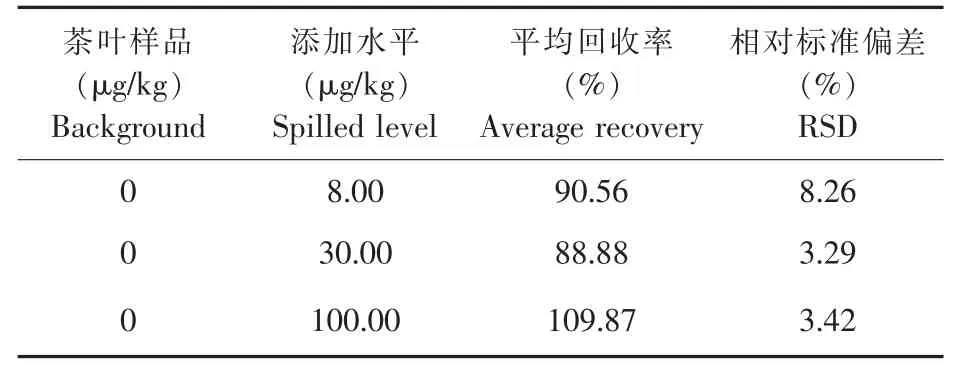
表7 胺菊酯在茶叶中的加标回收率(n=6)Table 7 Recoveries and relative standard deviations(RSDs)of tetramethrin in tea(n=6)
2.3.3 基质效应
为了减少实验次数,提高实验效率,基质效应以单点法计算基质效应η,即η=(基质加标溶液的R(i+ck)-溶剂标准溶液Ri)/溶剂标准溶液Ri×100%。为评价不同茶类的基质效应,选取龙井茶、祁门红茶、普洱茶、安溪铁观音和福鼎白茶为实验样品,以乙腈和乙腈基质溶液为溶剂配制浓度为100 ng/mL溶液,以此计算基质效应,数据见表8。不同茶类的基质效应在2.94%~8.13%,基质效应η<20%,说明不同茶叶无显著的基质效应。

表8 胺菊酯在不同茶类中的基质效应(n=6)Table 8 Matrix effects of tetramethrin in different teas(n=6)
2.4 实际样品检测
采用固相萃取净化-超高效液相色谱-串联质谱法对90份绿茶、红茶、乌龙茶、黑茶和白茶样品进行监测,其中胺菊酯阳性样品2份,残留量在0.008~0.030 mg/kg之间,检出率为2.22%,茶叶中胺菊酯的检出率和残留量均较低。
3 结论
文章以乙腈(1%醋酸)为提取溶剂,匀浆为提取方式,石墨化碳黑-氨基复合柱为SPE净化小柱,通过前处理方法优化,建立固相萃取净化-超高效液相色谱-串联质谱法检测茶叶中胺菊酯的实验方法。该分析方法高效、便捷,可操作性强,方法的灵敏度、精密度和准确度满足茶叶的日常检测要求。茶叶提取剂中加入水,杂质增加,检测难度增大,由此可见,茶叶丰富的内源性物质对胺菊酯的检测影响较大,茶叶基质的有效去除是排除假阳性样品的关键。

