基于线粒体DNA D-loop区的肉鸡品种遗传多样性和起源分析
唐修君,樊艳凤,贾晓旭,葛庆联,陆俊贤,唐梦君,韩威,高玉时
基于线粒体DNA D-loop区的肉鸡品种遗传多样性和起源分析
唐修君1,2,樊艳凤1,贾晓旭1,葛庆联1,陆俊贤1,唐梦君1,韩威1,高玉时1
1中国农业科学院家禽研究所/江苏省家禽遗传育种重点实验室,江苏扬州 225015;2南京农业大学动物科技学院,南京 210095
【目的】探讨不同生长速度鸡品种(配套系)线粒体DNA D-loop区全序列遗传多样性和起源特性,为肉鸡品种选育和溯源提供理论依据。【方法】以不同生长速度的8个黄羽肉鸡配套系(中快速型5个、慢速型3个)、2个地方鸡种(固始鸡、藏鸡)、2个引进鸡种(隐性白羽鸡、安卡鸡)、1个白羽肉鸡(罗斯308)、817杂交肉鸡以及1个高产蛋鸡配套系(大午褐壳蛋鸡)共计15个鸡种为研究对象,采集血液提取DNA后进行PCR扩增,对15个鸡种共683个个体mtDNA D-loop区全序列进行测序,使用DnaSP 5.10软件分析各个鸡种遗传多样性和单倍型特点,使用MEGA 4.0软件计算种间遗传距离,构建不同单倍型与红色原鸡之间NJ系统发育树,分析起源和亲缘关系。【结果】15个鸡种线粒体D-loop区全序列大小为1 231—1 232bp,序列长度为1 231 bp的个体在859 bp处存在C碱基缺失。683个个体共检测到45个变异位点,组合为53个单倍型,可以分为A、B、C和E共4个单倍型群,其中中快速型肉鸡、817杂交肉鸡以及高产蛋鸡均是E单倍型为优势单倍型(≥48.89%);慢速型黄羽肉鸡中鸿光黑鸡优势单倍型为B单倍型,京海黄鸡优势单倍型为A单倍型,雪山鸡4种单倍型相对均衡,3个慢速型黄羽肉鸡配套系E单倍型比例≤38.46%;地方鸡种中固始鸡的单倍型为A和C型,藏鸡的单倍型为A和B型。15个鸡种单倍型多样度()分布在0.496—0.853,核苷酸多样度()分布在0.00146—0.00673,遗传多样性相对丰富的品种(配套系)是新兴矮脚黄鸡、雪山鸡、京海黄鸡和罗斯308;遗传多样性程度相对较低的品种(配套系)是藏鸡、高产蛋鸡、安卡鸡、新兴麻鸡4号和墟岗黄鸡1号。15个鸡种Kiumura双参数距离范围为0.0016—0.0113,其中罗斯308种内遗传距离最大,而817杂交肉鸡和高产蛋鸡的种内遗传距离最小;种间遗传距离最大为高产蛋鸡与藏鸡之间,最小为高产蛋鸡与817杂交肉鸡之间;中快速型黄羽肉鸡配套系相互之间遗传距离相对较小,而与慢速型黄羽肉鸡配套系以及地方鸡种之间遗传距离相对较大;京海黄鸡和鸿光黑鸡均是与藏鸡遗传距离最小。聚类分析显示,A、B单倍型群与红色原鸡滇南亚种交叉聚为一枝;E单倍型与红色原鸡印度亚种交叉聚为一枝;C单倍型群与红色原鸡印度亚种、滇南亚种、指名亚种以及印尼亚种交叉聚为一枝。【结论】不同生长速度鸡种之间线粒体D-loop区遗传多样性程度差异较大;E单倍型与肉鸡生长速度具有较强的相关性,中快速型群体均以E单倍型为优势单倍型,而慢速型群体E单倍型比例均低于40%;我国家鸡群体具有多个红色原鸡母系起源,显示其在中性选择下被驯化。研究结果为肉鸡品种选育和溯源以及资源化开发利用提供了理论依据。
鸡;线粒体DNA;D-loop区;遗传多样性;遗传起源
0 引言
【研究意义】近年来,随着冷鲜鸡产业的不断发展,一些不法商家为了谋取利益,往往以生长速度快、肉品质等级较低的品种冒充品质较高等级的品种,以次充好、以假乱真的现象时有发生,而消费者却对冷鲜鸡的品质和来源难以准确区分和鉴别[1]。特别是随着大批肉鸡配套系的成功培育,人们对家禽品种的需求越来越多元化,如何培育出满足不同消费者需求的肉鸡品种是育种工作者的当务之急。前期研究发现线粒体D-loop区单倍型在不同鸡种(配套系)中差异较大,本研究旨在通过对不同生长速度类型鸡种线粒体D-loop区遗传多样性和单倍型特点进行研究,探讨线粒体D-Loop区单倍型与肉鸡生长速度的相关性,为鸡品种溯源提供分子标签,为肉鸡选育和开发利用提供理论基础。【前人研究进展】线粒体DNA(mitochondrial DNA,mtDNA)为动物核外遗传物质,属于母系遗传,由于其进化速度相对较快且不易发生DNA重组等优点,已被广泛用作动物遗传起源、系统发育和品种鉴定研究[2-4]。线粒体控制区又称D-环区(D-loop区),是一段非编码区,其进化速率为线粒体其他区域的5—10倍,是研究亲缘关系较近的群体起源进化和种质鉴定理想的分子标记[5-6],目前已成功应用于马[7]、水牛[8]、山羊[9]、驴[10]、鸽[11]、鸭[12]和鸡[13]等物种的遗传多样性和起源进化研究,而且研究者发现以全序列替代高变区进行物种遗传多样性研究,信息更为齐全,结果更为准确。赵倩君等[14]通过测序技术分析了8个绵羊品种59个个体线粒体D-loop全序列遗传多样性,并通过系统发育和网络进化分析其母系起源和系统进化。高玉时等[15]基于线粒体D-loop全序列分析了安义瓦灰鸡的遗传多样性和起源进化。随着对线粒体D-loop区全序列的不断深入研究,人们关注的已不仅仅是其遗传多样性,更多的焦点集中于对线粒体单倍型(世系)的划分。LIU等[16]对世界家鸡mtDNA D-loop区进行深入研究,揭示了家鸡和红色原鸡由A、B、C、D、E、F、G、H和I型等9个母系世系构成,其中A型和B型在东亚和东南亚地区普遍存在,C型为东亚特有,D型主要发生在非洲、南亚、东南亚和东亚,E型在南亚和欧美商品鸡中普遍存在,F型和G型只限于分布在中国云南地区,I型主要分布在中国云南地区,H型只在东亚有少量分布。MIAO等[17]基于家鸡线粒体全基因组序列构建了mtDNA系统发育树,对世界各地大样本线粒体D-loop区序列进行了重新分析,确定世界家鸡及其近缘种红色原鸡可以划分为A、B、C、D、E、F、G、H、I、W和X等世系。【本研究切入点】以往的研究对象主要为地方品种,且关注点基本集中于“从哪里来”,即在鸡种的遗传多样性和起源进化方面,取得了诸多成就。但对于“到哪里去”关注度较低,即对配套系的研究少之又少,迄今为止对线粒体优势单倍型与鸡生长速度相关性的研究还未见相关报道。【拟解决的关键问题】本研究针对我国特殊的消费特性,拟选择市场上具有代表性的鸡种15个,包括快速型、中速型和慢速型黄羽肉鸡(上市日龄分别为60 d以内、65—90 d以及95 d以上,上市体重1.5—2.0 kg)、白羽肉鸡(上市日龄35 d左右,上市体重2.5—3.0 kg)、地方鸡种(上市日龄120 d以上,上市体重1.5—2.0 kg)以及占有市场一定比例的817杂交肉鸡(上市日龄在40—52 d,上市体重1.3—1.8 kg)和淘汰高产蛋鸡(日龄在500 d左右,体重约2.0 kg)等,通过PCR和测序技术,分析不同生长速度类型肉鸡群体线粒体D-Loop区全序列突变位点情况以及遗传多样性和单倍型特性,探讨基于线粒体D-Loop区单倍型区分不同生长速度类型肉鸡品种(配套系)的可行性,通过与19条红色原鸡序列的聚类分析探究不同鸡种的遗传起源,为肉鸡配套素选育、品种改良和溯源以及开发利用提供参考依据。
1 材料与方法
1.1 试验材料
以不同生长速度黄羽肉鸡配套系8个(中快速型:墟岗黄鸡1号、新广铁脚麻鸡、新兴麻鸡4号、良凤花鸡、新兴矮脚黄鸡;慢速型:雪山鸡、京海黄鸡、鸿光黑鸡)、地方鸡种2个(固始鸡、藏鸡)、引进鸡种2个(隐性白、安卡)、白羽肉鸡1个(罗斯308)、817杂交肉鸡以及淘汰高产蛋鸡1个共计15个鸡种为研究对象,翅静脉采血,ACD抗凝。各鸡种相关信息见表1。
1.2 试验方法
1.2.1 总DNA提取 基因组DNA提取采用常规的酚/氯仿法[18],0.8%琼脂糖(Promega,美国)凝胶电泳检测DNA提取效果。
1.2.2 引物合成 根据GenBank数据库中公布的红色原鸡线粒体控制区全序列(序列号: NC_007235),利用Primer Premier 5.0软件设计筛选特异性引物1对,PF:5'-AAACACCCAAACTCAC TAAC-3';PR:5'-CACTGGGATGCGGATACTTGC-3',交由生工生物工程(上海)股份有限公司合成。
1.2.3 PCR扩增和测序 50 μL扩增体系:2×PCRMaster Mix(大连宝生物公司)25 μL,10 μmol·L-1上下游引物(上海生工生物工程公司)各1.5 μL,DNA模板2 μL,灭菌双蒸水20 μL。
PCR扩增条件:95℃预变性5 min;95℃变性30 s,55℃退火60 s,72℃延伸60 s,共30个循环;72℃延伸10 min。
反应完毕后,PCR产物采用1.0%琼脂糖(Promega,美国)凝胶电泳检测,测序工作由生工生物工程(上海)股份有限公司完成,所有序列均采用双向一代Sanger双向测序,引物扩增序列全长为1 586 bp。

表1 15个鸡种来源和采样数
1.3 数据处理和分析
测序结果经 DNAStar 5.02 软件SeqMan程序拼接后,剪去多余片段序列后通过BioEdit软件与GenBank中红色原鸡(Gallus gallus)参考序列逐碱基比对。利用DnaSP 5.10 软件统计遗传多态性信息,包括突变位点总数(total number of mutations)、单倍型数(number of haplotype)、单倍型多样度(haplotypediversity, Hd)、平均核苷酸差异(average number of nucleotide differences, K)以及核苷酸多样度(nucleotide diversity, Pi)等[19]。利用MEGA 4.0软件计算种内和种间遗传距离,采用邻接法构建基于Kimura 2模型的系统发育树(neighbor-jointing, NJ)[20],与Genbank数据库中公开发表的红色原鸡线粒体控制区全序列进行聚类分析,模型参数bootstrap选用1 000次重复。采用Network 10.1软件构建中介网络图(median-joining)(www.fluxus- technology.com)。
2 结果
2.1 15个鸡种线粒体控制区序列分析
对15个鸡种683个个体PCR产物测序结果进行分析,发现D-loop区全序列大小为1 231—1 232 bp,1 231 bp个体在859 bp处存在C碱基缺失,共检测到45个变异位点,变异位点数占分析位点总数的3.65%,其中单一多态位点5处,分别位于211、238、321、354和711 bp;其余突变位点均为简约信息位点。突变类型以转换为主,仅在252和391 bp处分别为A-T颠换和A-C颠换,其余均为转换,其中T-C转换26处,A-G 转换17处。碱基组成分析显示T、C、A和G 4种碱基含量分别为33.5%、26.5%、26.6%和13.4%,其中A+T含量为60.1%,G+C含量为39.9%。
2.2 15个鸡种线粒体控制区单倍型分析
对683个个体进行单倍型分析,发现45个突变位点共有53种单倍型,划分为A、B、C和E共4个单倍型群(分支),其中A单倍型群包括11个单倍型(分别表示为A1—A11),B单倍型群包括20个单倍型(分别表示为B1—B20),C单倍型群包括7个单倍型(分别表示为C1—C7),E单倍型群包括15个单倍型(分别表示为E1—E15)。各单倍型数量及在品种间的分布见表2。其中,单倍型E2出现频率最高,共计11个品种159个个体;其次是单倍型C1,共出现85次(9个品种);第三是单倍型E1,共出现82次(9个品种);第四是单倍型A2,共出现52次(4个品种)。
进一步分析显示,中、快速型黄羽肉鸡品种E单倍型为优势单倍型,比例较高,其中墟岗黄鸡1号、新广铁脚麻鸡、新兴麻鸡4号、良凤花鸡和新兴矮脚黄鸡E单倍型占比分别为80.00%、65.79%、85.45%、77.36%和50.00%;慢速型黄羽肉鸡品种雪山鸡、京海黄鸡和鸿光黑鸡E单倍型占比相对较低,其中鸿光黑鸡优势单倍型为B单倍型,占比76.62%(59/77);京海黄鸡优势单倍型为A单倍型,占比50.00%(20/40);雪山鸡4种单倍型相对较为均衡。地方鸡种固始鸡和藏鸡样本中未发现E单倍型,固始鸡主要为A和C单倍型,占比分别为53.42%和46.58%;藏鸡主要为A和B单倍型,占比分别为34.21%和65.79%。引进鸡种隐性白羽鸡和安卡鸡E单倍型占比也较高,分别为48.89%和89.66%,罗斯308 E单倍型为50.00%,与隐性白羽鸡含量相当。817杂交肉鸡和高产蛋鸡E单倍型比例均为100%。结果见表3。

表2 15个鸡种线粒体D-loop区单倍型数量分布

续表2 Continued table 2
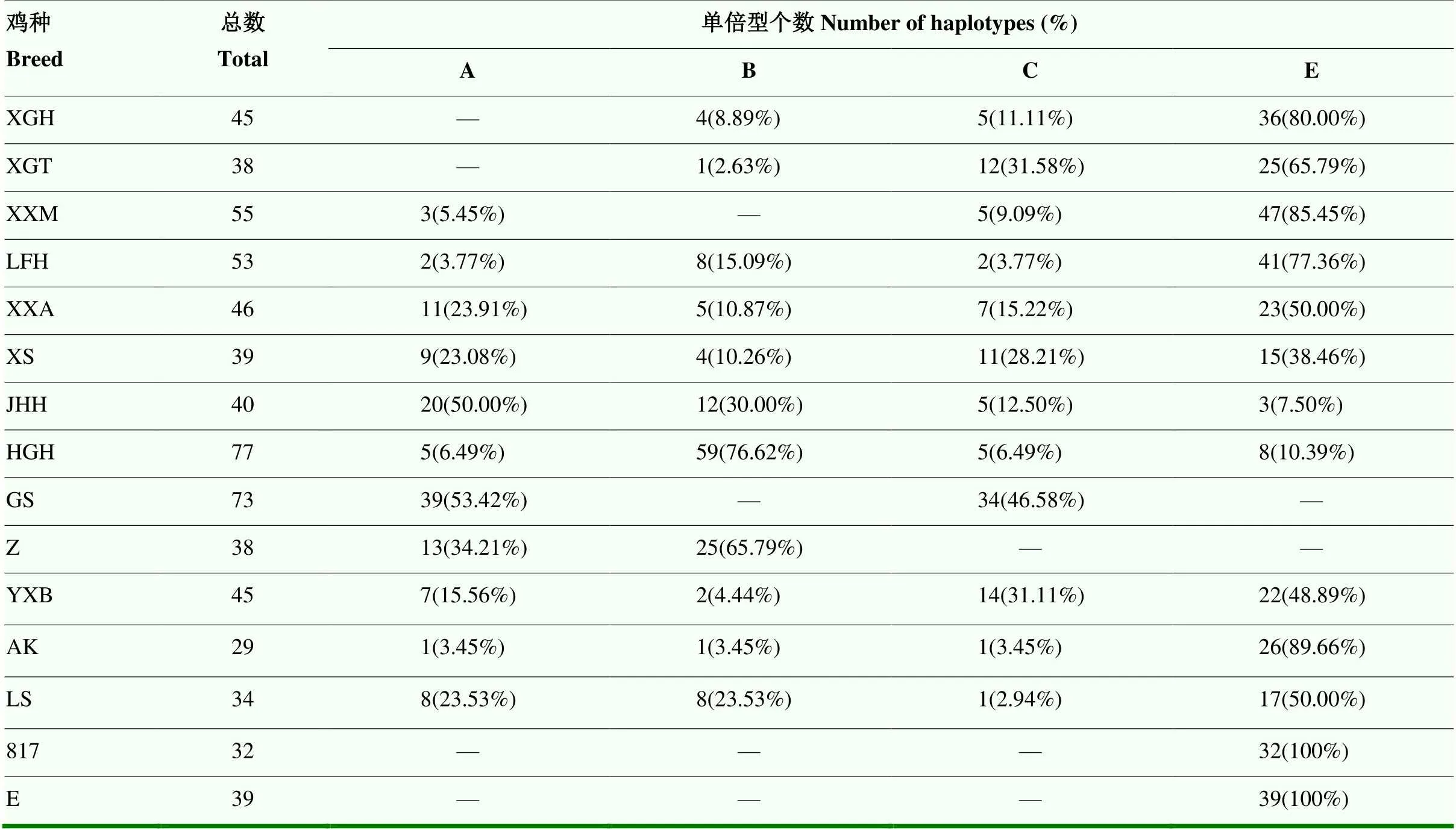
表3 不同鸡种D-Loop区全序列单倍型汇总
2.3 15个鸡种线粒体控制区遗传多样性和遗传距离
本研究中15个鸡种遗传多样性结果见表4,其中核苷酸多样度和单倍型多样度的表示方式为平均值±标准差。由表可见,总体单倍型多样度()为0.901 ± 0.006,分布在0.496—0.853,其中最高为京海黄鸡,其次为新兴矮脚黄鸡、鸿光黑鸡、良凤花鸡和雪山鸡,值均在0.8以上;最低为藏鸡,值在0.5以下;墟岗黄鸡1号、高产蛋鸡、新兴麻鸡4号、安卡鸡和固始鸡值均在0.5—0.6。总体核苷酸多样度()为0.00646±0.00011,分布在0.00146—0.00673,其中最高为罗斯308,其次为雪山鸡和新兴矮脚黄鸡,值均在0.006以上;最低为高产蛋鸡,其次为817杂交肉鸡、安卡鸡、新兴麻鸡4号、墟岗黄鸡1号和藏鸡,值均在0.0035以下;其余鸡种值在0.004—0.006。15个鸡种平均核苷酸差异()分布趋势与核苷酸多样度完全一致。除817杂交肉鸡之外,其余鸡种单倍型多样度与核苷酸多样度之间基本吻合。
15个鸡种种内和种间平均遗传距离结果见表5,种内遗传距离范围为0.0015—0.0068,最小为817杂交肉鸡和高产蛋鸡,最大为罗斯308,其次为雪山鸡和新兴矮脚黄鸡,分别为0.0062和0.0061。种间遗传距离大小体现了鸡种之间亲缘关系的远近,最大为高产蛋鸡与藏鸡之间(0.0113),最小为高产蛋鸡与817杂交肉鸡之间(0.0016)。中快速型黄羽肉鸡(墟岗黄鸡1号、新广铁脚麻鸡、新兴麻鸡4号、良凤花鸡和新兴矮脚黄鸡)、引进鸡种(安卡鸡和隐性白羽鸡)、817肉杂鸡以及高产蛋鸡之间遗传距离相对较小,范围为0.0023—0.0059;而这些鸡种与慢速型黄羽肉鸡(京海黄鸡和鸿光黑鸡)、地方鸡种(固始鸡和藏鸡)之间遗传距离相对较大,范围为0.0062—0.0113。京海黄鸡、鸿光黑鸡、固始鸡和藏鸡均是与高产蛋鸡遗传距离最大,分别为0.0092、0.0107、0.0087和0.0113;京海黄鸡和鸿光黑鸡均是与藏鸡遗传距离最小,分别为0.0058和0.0053。
2.4 系统进化树和中介网络图的构建
由构建的NJ系统进化树(图1)看出,15个鸡种683个个体拥有的53种单倍型很明显地分成了A、B、C和E等4个支系,分别含有118、129、102和334条序列。用Network10.1构建的网络关系图也证实了这一点(图2),中介网络图主要有4个进化枝,分别以A2、B1、C1和E2为中心节点,这4种单倍型在各自的单倍型类群里出现的频率最高。

表4 15个鸡种D-Loop区序列变异位点数、平均核苷酸差异和核苷酸多样度

表5 基于Kimura双参数模型计算的15个鸡种品种内和品种间平均遗传距离

A、B、C、E 分别表示D-loop区的单倍型类型 A, B, C and E stood for haplotype type of D-loop region
同时,本研究从NCBI下载了19条红色原鸡的D-loop区全长序列,结合所发现的53种单倍型683条序列,采用K2P模型构建了系统发育树(图3)。A、B、C和E单倍型在发育树中形成了4个大枝,2个原鸡海南亚种的个体(GGJ1、GGJ2)单独形成一枝。11种A单倍型和20种B单倍型仅与原鸡滇南亚种聚为一枝,其中A单倍型群均与滇南亚种GGS5(GU261695)交叉聚为一枝;B单倍型群均与滇南亚种GGS1(NC007235)和GGS8(GU261704)2条序列交叉聚为一枝。15种E单倍型均与红色原鸡印度亚种(GGM1、GGM3和GGM4)交叉聚为一枝。7种C单倍型聚类形成C单倍型群,并与印度亚种(GGM2,GU261707)、滇南亚种(GGS10,GU261716)、指名亚种(GGG1,AB007725;GGG2,NC007236)以及印尼亚种(GGB,NC007237)等4种红色原鸡亚种5条序列聚为一枝。
3 讨论
3.1 15个鸡种mtDNA控制区序列结构
15个鸡种683个个体线粒体D-loop区全序列为1 231—1 232 bp,其中1 231 bp的个体在859 bp处存在C碱基缺失。全序列共检测到45个变异位点,突变位点从133 bp到1 215 bp,高变区主要集中在211—446 bp,长度占全长的19.2%(236/1 232),集中了75.6%(34/45)的碱基变异。国内外有关鸡线粒体控制区的研究大都集中在高变区[21-22],本研究结果显示,除了高变区外,在序列的其余部位还存在24.4%(11/45)的碱基变异。可见,利用线粒体D-loop区全序列进行核苷酸多态性分析可以获得更为全面的信息。碱基组成分析显示,鸡线粒体D-loop区富含A/T碱基,含量为60.1%,可能为了RNA聚合酶等特异分子的快速识别,碱基和密码子的使用均具有一定的偏向性,密码子第三位T的使用频率最高。

A1-A11、B1-B20、C1-C7、E1-E15均表示单倍型类型 A1-A11, B1-B20, C1-C7 and E1-E15 all stood for haplotype type
3.2 15个鸡种mtDNA控制区单倍型特征
本研究共发现53个单倍型,按照鸡线粒体DNA单倍型分类通用标准[16-17],可以分为A、B、C和E共4个单倍型群(分支),分别有118、129、102和334个个体。由构建的NJ系统进化树和Network中介网络图均可以看出,683个个体明显地分成了A、B、C和E等4个支系。研究显示,中、快速型黄羽肉鸡、引进鸡种、白羽肉鸡以及817杂交肉鸡和高产蛋鸡优势单倍型均为E单倍型,而慢速型黄羽肉鸡E单倍型占比相对较低,本研究中鸿光黑鸡优势单倍型为B单倍型,占比76.62%;京海黄鸡优势单倍型为A单倍型,占比50.00%。有文献记载,线粒体E分支前世与红色原鸡印度亚种()亲缘关系较近,可能起源于印度周边地区;而今为印度半岛、中东和欧洲大陆地方鸡种的主要单倍型,在中国少数地方品种中也能检测到,但是所占比例均较低,至今为止未发现占绝对优势(比例在80%以上)的品种[23-24]。本研究涉及到的地方鸡种(固始鸡和藏鸡)所采集的样本中未发现E单倍型,固始鸡主要为A和C单倍型,所占比例相当;藏鸡主要为A和B单倍型,所占比例分别为34.21%和65.79%,说明这两个鸡种在长期的进化过程中受外来鸡种入侵机会较小,可能跟当地交通不便或者高山深谷形成的天然隔离屏障有关,导致外来鸡种难以进入,保护了品种的独有特性。而E单倍型在中快速型肉鸡以及高产蛋鸡中普遍存在,揭示了欧美商品鸡包括安卡和隐性白羽鸡等快速型肉鸡以及白来航等高产蛋鸡在这些商品肉鸡和蛋鸡配套系的培育过程中贡献较大。由于线粒体母系遗传的独有特性,在今后的育种工作中,可以根据育种目标,选择合适的母系,加快培育出满足消费者需求的品种(配套系)。

GGG,原鸡指名亚种;GGS,原鸡滇南亚种;GGM,原鸡印度亚种;GGJ,原鸡海南亚种;GGB,原鸡印尼亚种
进一步分析显示,E分支所有单倍型共334个个体均在1 214 bp处存在C-T突变,而B分支所有单倍型共129个个体均在1215bp处存在A-G突变,结合数据库中上千条序列也得出类似结论。在实际应用中,可以省去测序步骤,利用变异位点酶切等SNP检测方法来区分不同个体单倍型,既经济而且易于操作。
3.3 15个鸡种mtDNA 控制区遗传多样性
遗传多样性大小一般用平均核苷酸差异()、核苷酸多样度()以及单倍型多样度()来表示。和是评价一个群体遗传多样性和分化程度的主要指标,值和值越大,表明群体的遗传多样性越丰富,而遗传变异越大,则群体选择潜力也越大[25-26]。本研究15个鸡种中值最大的为京海黄鸡,其次为新兴矮脚黄鸡、鸿光黑鸡、良凤花鸡和雪山鸡,值均在0.8以上,说明这些鸡种遗传多样性相对较为丰富,还可以经过进一步选育提优;墟岗黄鸡1号、高产蛋鸡和新兴麻鸡4号值均在0.5—0.6,说明这些鸡种遗传多样性处于中等水平;藏鸡值最低,可见藏鸡质量性状遗传趋于稳定,选择潜力相对较小,据资料显示[27]藏鸡主要采用保护区和基因库保护,自2002年开始已经过多个世代选育,目前群体的遗传特性和生产性能保持相对稳定。15个鸡种平均核苷酸差异()分布趋势与核苷酸多样度完全一致。不同鸡种线粒体D-loop区遗传多态性程度不一,揭示了各品种(配套系)遗传资源保护以及选育程度不同。另外,本研究中除了817杂交肉鸡之外,其余鸡种单倍型多样度与核苷酸多样度之间基本吻合,这可能与817杂交肉鸡的选育模式和程度有关,今后可以考虑进一步加强选育,从而稳定该配套系的遗传性状。
种间遗传距离大小体现了鸡种之间亲缘关系的远近,本研究中Kiumura双参数距离结果显示,中快速型黄羽肉鸡、引进鸡种、817杂交肉鸡以及高产蛋鸡之间遗传距离相对较小,亲缘关系较近;而这些鸡种与慢速型黄羽肉鸡、地方鸡种之间遗传距离相对较大,亲缘关系较远。而慢速型黄羽肉鸡京海黄鸡和鸿光黑鸡均是与藏鸡亲缘关系最近,京海黄鸡、鸿光黑鸡、固始鸡和藏鸡均是与高产蛋鸡亲缘关系最远。
3.4 15个鸡种系统发生关系和母系起源
自达尔文提出红色原鸡为家鸡()祖先这一假说以来,家鸡究竟起源于红色原鸡5个亚种中的哪一种,迄今为止学术界还没有明确定论。FUMIHITO等[28]提出家鸡的唯一祖先是生活在泰国及其周边地区的原鸡指名亚种()。KANGINAKUDRU等[29]研究表明在家鸡的进化过程中,生活在印度及其周边地区的原鸡滇南亚种()和印度亚种()也同样作出了贡献。
本研究结合所发现的53种单倍型683条序列和从NCBI下载的19条红色原鸡D-loop区全长序列,构建了K2P模型系统发育树,结果显示,A、B分支中的所有单倍型包括11种A单倍型和20种B单倍型均仅与原鸡滇南亚种交叉聚为一枝,以往的研究显示A、B单倍型为我国地方鸡种的主要单倍型[30],推测滇南亚种在中国地方鸡种形成过程中母系贡献较大。E分支中的所有单倍型均与原鸡印度亚种交叉聚为一枝,本研究中E单倍型在中国培育的中快速肉鸡和高产蛋鸡中比例较高,而E单倍型在南亚和西方商品鸡中普遍存在,验证了我国快长型鸡种在培育过程中引入了外来鸡种血液。C分支母系起源较为丰富,7种C单倍型与指名亚种、滇南亚种、印度亚种以及印尼亚种()等4种红色原鸡亚种交叉聚为一枝,推测拥有C单倍型的家鸡在长期的选育过程中,通过引入或者迁移等方式受到多种原鸡血液的入侵,从而逐渐形成具有独特个性的群体。
4 结论
在15个鸡种683个个体线粒体D-loop区全序列共发现45个突变位点和53种单倍型以及A、B、C和E共4个单倍型群。不同单倍型与肉鸡生长速度相关,中快速型群体以E单倍型为优势单倍型,慢速型群体E单倍型比例相对较低。A、B单倍型群均起源于滇南亚种,E单倍型群起源于印度亚种,C单倍型群具有印度亚种、滇南亚种、指名亚种和印尼亚种等多个起源。E单倍型均在1 214 bp处存在C-T突变,B单倍型均在1 215 bp处存在A-G突变,不同群体线粒体D-loop区遗传多态性差异不一,均具有各自的特异位点和特异单倍型。研究结果为肉鸡品种选育和溯源以及资源化开发利用提供了理论依据。
[1] 赵华, 范梅华. 活鸡向冰鲜鸡消费转型亟需解决的六大问题. 中国畜牧杂志, 2015(16): 8-10, 14.
ZHAO H, FAN M H. Six problems need to solve during the consumption of chilled chicken replacing live chicken. Chinese Journal of Animal Science, 2015(16): 8-10, 14. (in Chinese)
[2] ARMSTRONG E, IRIARTE A, MARTINEZ A M, FEIJOO M, VEGA-PLA J L, DELGADO J V, POSTIGLIONI A. Genetic diversity analysis of the Uruguayan Creole cattle breed using microsatellites and mtDNA markers. Genetics and molecular research, 2013, 12(2): 1119-1131.
[3] ASATO Y, OSHIRO M, MYINT C K, YAMAMOTO Y I, KATO H, MARCO J D, MIMORI T, GOMEZ E A L, HASHIGUCHI Y, UEZATO H. Phylogenic analysis of the genusby cytochrome b gene sequencing. Experimental Parasitology, 2009, 121(4): 352-361. doi:10.1016/j.exppara.2008.12.013
[4] 李雪娟, 黄原, 雷富民. 山鹧鸪属鸟类线粒体基因组的比较及系统发育研究. 遗传, 2014(9):912-920.
LI X J, HUANG Y, LEI F M. Comparative and phylogenomic analyses on mitochondrial genomes ofspecies. Hereditas, 2014(9):912-920.(in Chinese)
[5] MALTSEV A N, STAKHEEV V V, BOGDANOV A S, FOMINA E S, KOTENKOVA E V. Phylogenetic relationships of intraspecific forms of the house mouse: Analysis of variability of the control region (D-loop) of mitochondrial DNA. Doklady Biological Sciences, 2015, 465(1): 285-288.
[6] TAKASU M, ISHIHARA N, TOZAKI T, KAKOI H, MAEDA M, MUKOYAMA H. Genetic diversity of maternal lineage in the endangered kiso horse based on polymorphism of the mitochondrial DNA D-loop region. Journal of Veterinary Medical Science, 2014, 76(11): 1451-1456.
[7] 张涛, 路宏朝.宁强矮马线粒体DNA D-loop区的遗传多样性. 中国农业科学, 2012, 45(8): 1587-1594.
ZHANG T, LU H Z. Genetic diversity of mitochondrial DNA D-loop sequences in Ningqiang pony. Scientia Agricultura Sinica, 2012, 45(8):
[8] 齐国强, 昝林森, 张桂香, 王志刚, 王均辉, 韩旭. 中国部分地方水牛品种mtDNA D-loop区遗传多样性与起源研究. 畜牧兽医学报, 2008(1): 7-11.
QI G Q, ZAN L S, ZHANG G X, WANG Z G, WANG J H, HAN X. Mitochondrial DNA D-loop genetic diversity and origin of some Chinese domestic buffalo breeds. Chinese Journal of Animal and Veterinary Sciences, 2008(1): 7-11. (in Chinese)
[9] 武艳平, 关伟军, 赵倩君, 何晓红, 浦亚斌, 霍俊宏, 敖红, 李奎, 马月辉. 山羊线粒体DNA D-loop区部分序列变异位点分析. 畜牧兽医学报, 2008, 39(8): 1137-1141. doi:10.3321/j.issn: 0366-6964. 2008.08.023.
WU Y P, GUAN W J, ZHAO Q J, HE X H, PU Y B, HUO J H, AO H, LI K, MA Y H. Analysis on partial sequence of mitochondrial DNA D-loop region variation position of goat. Acta Veterinaria et Zootechnica Sinica, 2008, 39(8): 1137-1141. doi:10.3321/j.issn: 0366-6964.2008.08.023. (in Chinese)
[10] 郑立, 刘延鑫, 赵绪永, 靳双星, 邓红雨, 刘太宇. 河南3个驴种mtDNA D-loop区序列多态性及起源进化分析. 西北农林科技大学学报(自然科学版), 2011(4): 29-34.
ZHENG L, LIU Y X, ZHAO X Y, JIN S X, DENG H Y, LIU T Y. Analysis of phylogenetic relationship and genetic diversity of mtDNA D-loop in three Henan donkey breeds. Journal of Northwest A & F University (Natural Science Edition), 2011(4): 29-34. (in Chinese)
[11] LEE J C, TSAI L C, LIAO S P, LINACRE A, HSIEH H M. Evaluation of the polymorphic D-loop ofin forensic applications. Electrophoresis, 2010, 31(23/24): 3889-3894. doi:10. 1002/elps.201000414.
[12] 李慧芳, 朱文奇, 杨宁, 宋卫涛, 王继文, 徐文娟, 王强, 陈宽维. 家鸭、媒鸭和野鸭mtDNA D-loop区的遗传变异. 畜牧兽医学报, 2011, 42(9): 1213-1219.
LI H F, ZHU W Q, YANG N, SONG W T, WANG J W, XU W J, WANG Q, CHEN K W. The genetic variation of the mtDNA D-loop region in domestic ducks,ducks and wild ducks. Acta Veterinaria et Zootechnica Sinica, 2011, 42(9): 1213-1219. (in Chinese)
[13] 周蓉李佳琦李铀刘迺发房峰杰施丽敏王莹. 基于线粒体DNA的大石鸡种群遗传变异. 生物多样性, 2012, 20(4): 451-459. doi:10. 3724/SP.J.1003.2012.09221.
ZHOU R, LI J Q, LI Y, LIU N F, FANG F J, SHI L M, WANG Y.Genetic variation in rusty-necklaced partridge () detected by mitochondrial DNA. Biodiversity Science, 2012, 20(4): 451-459. doi:10.3724/SP.J.1003.2012.09221. (in Chinese)
[14] 赵倩君, 关伟军, 郭军, 乔海云, 何晓红, 浦亚斌, 傅宝玲, 敖红, 李奎, 马月辉. 中国7个绵羊品种mtDNA D-loop区序列的系统发育与起源研究. 畜牧兽医学报, 2008(4): 417-422.
ZHAO Q J, GUAN W J, GUO J, QIAO H Y, HE X H, PU Y B, FU B L, AO H, LI K, MA Y H. Origin and phylogenetics of seven Chinese sheep breeds based on D-loop sequence. Chinese Journal of Animal and Veterinary Sciences, 2008(4): 417-422. (in Chinese)
[15] 高玉时, 贾晓旭, 唐修君, 唐梦君, 樊艳凤, 陆俊贤, 顾荣, 葛庆联, 苏一军. 基于线粒体基因组D-loop区全序列分析安义瓦灰鸡遗传多样性及其起源进化关系. 农业生物技术学报, 2015, 23(7): 940-944. doi:10.3969/j.issn.1674-7968.2015.07.011.
GAO Y S, JIA X X, TANG X J, TANG M J, FAN Y F, LU J X, GU R, GE Q L, SU Y J. The genetic diversity and origin analysis of Anyi tile-like chickens (domestiaus) based on mitochondrial DNAD-loop sequence. Journal of Agricultural Biotechnology, 2015, 23(7): 940-944. doi:10.3969/j.issn.1674-7968.2015.07.011. (in Chinese)
[16] LIU Y P, WU G S, YAO Y G, MIAO Y W, LUIKART G, BAIG M, BEJA-PEREIRA A, DING Z L, PALANICHAMY M G, ZHANG Y P. Multiple maternal origins of chickens: out of the Asian jungles. Molecular Phylogenetics and Evolution, 2006, 38(1): 12-19.
[17] MIAO Y W, PENG M S, WU G S, OUYANG Y N, YANG Z Y, YU N, LIANG J P, PIANCHOU G, BEJA-PEREIRA A, MITRA B, PALANICHAMY M G, BAIG M, CHAUDHURI T K, SHEN Y Y, KONG Q P, MURPHY R W, YAO Y G, ZHANG Y P. Chicken domestication: an updated perspective based on mitochondrial genomes. Heredity, 2013, 110(3): 277-282.
[18] 萨姆布鲁克J, 拉塞尔D W.分子克隆实验指南: 第三版. 北京: 科学出版社, 2002, 461-512.
SAMBROOK J, RUSSELL D W. Molecular cloning:a laboratory manual: the third edition. Science Press. Beijing. 2002, 461-512. (in Chinese)
[19] ROZAS J, SÁNCHEZ-DELBARRIO J C, MESSEGUER X, ROZAS R. DnaSP, DNA polymorphism analyses by the coalescent and other methods. Bioinformatics (Oxford, England), 2003, 19(18): 2496-2497. doi:10.1093/bioinformatics/btg359.
[20] TAMURA K, DUDLEY J, NEI M, KUMAR S. MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. doi:10. 1093/molbev/msm092.
[21] 包文斌, 束婧婷, 王存波, 张红霞, Steffen Weigend, 陈国宏. 中国家鸡和红色原鸡mtDNA控制区遗传多态性及系统进化分析. 畜牧兽医学报, 2008, 39(11): 1449-1459. doi:10.3321/j.issn: 0366-6964. 2008.11.001.
BAO W B, SHU J T, WANG C B, ZHANG H X, WEIGEND S, CHEN G H. Investigation on genetic diversity and systematic evolution in Chinese domestic fowls and red jungle fowls by analyzing the mtDNA control region. Acta Veterinaria et Zootechnica Sinica, 2008, 39(11): 1449-1459. doi:10.3321/j.issn: 0366-6964.2008. 11.001. (in Chinese)
[22] DANA N, MEGENS H J, CROOIJMANS R P M A, HANOTTE O, MWACHARO J, GROENEN M A M, ARENDONK J A M V. East Asian contributions to Dutch traditional and western commercial chickens inferred from mtDNA analysis. Animal Genetics, 2010, 42, 125-133.
[23] LYIMO C M, WEIGEND A, MSOFFE P L, HOCKING P M, SIMIANER H, WEIGEND S. Maternal genealogical patterns of chicken breeds sampled in Europe. Animal Genetics, 2015, 46(4): 447-451.
[24] OSMAN S A M, YONEZAWA T, NISHIBORI M. Origin and genetic diversity of Egyptian native chickens based on complete sequence of mitochondrial DNAregion. Poultry Science, 2016, 95(6): 1248-1256.
[25] SMITH M A, WOODLEY N E, JANZEN D H, HALLWACHS W, HEBERT P D. DNA barcodes reveal cryptic host-specificity within the presumed polyphagous members of a genus of parasitoid flies (Diptera: Tachinidae). Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(10): 3657-3662. doi:10.1073/pnas.0511318103.
[26] 潘建飞, 史兆国, 成述儒, 王川, 赵生国. 甘肃主要马群体遗传多样性及系统发育研究. 农业生物技术学报, 2014, 22(2): 210-218. doi:10.3969/j.issn.1674-7968.2014.02.010.
PAN J F, SHI Z G, CHENG S R, WANG C. The study of genetic diversity and phylogenetic evolution in indigenous horses () of Gansu. Journal of Agricultural Biotechnology, 2014, 22(2): 210-218. doi:10.3969/j.issn.1674-7968.2014.02.010. (in Chinese)
[27] 中国畜禽遗传资源志家禽志. 北京: 中国农业出版社, 2011, 331-333.
Animal genetic resources in China Poultry. China agriculture press. Beijing. 2011, 331-333. (in Chinese)
[28] FUMIHITO A, MIYAKE T, SUMI S, TAKADA M, OHNO S, KONDO N. One subspecies of the red junglefowl () suffices as the matriarchic ancestor of all domestic breeds. Proceedings of the National Academy of Sciences, USA. 1994, 91, 12505-12509.
[29] KANGINAKUDRU S, METTA M, JAKATI R D, NAGARAJU J. Genetic evidence from Indian red jungle fowl corroborates multiple domestication of modern day chicken. BMC Evolutionary Biology, 2008, 8: 174. doi:10.1186/1471-2148-8-174.
[30] 贾晓旭, 唐修君, 樊艳凤, 陆俊贤, 黄胜海, 葛庆联, 高玉时, 韩威. 华东地区地方鸡品种mtDNA控制区遗传多样性. 生物多样性, 2017, 25(5): 540-548. doi:10.17520/biods.2017012.
JIA X X, TANG X J, FAN Y F, LU J X, HUANG S H, GE Q L, GAO Y S, HAN W. Genetic diversity of local chicken breeds in East China based on mitochondrial DNA D-loop region. Biodiversity Science, 2017, 25(5): 540-548. doi:10.17520/biods.2017012. (in Chinese)
Genetic Diversity and Origin Characteristics of Chicken Species Based on Mitochondrial DNA D-loop Region
TANG XiuJun1,2, FAN YanFeng1, JIA XiaoXu1, GE QingLian1, LU JunXian1, TANG MengJun1, HAN Wei1, GAO YuShi1
1Institute of Poultry, Chinese Academy of Agricultural Sciences/Key Laboratory for Poultry Genetics and Breeding of Jiangsu Province, Yangzhou 225125, Jiangsu;2College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095
【Objective】The purpose of this study was to investigate the genetic diversity and origin characteristics of the whole sequence of mitochondrial DNA D-loop region in chicken breeds (complete set line) with different growth rates, so as to provide a theoretical basis for breeding and traceability of broiler breeds. 【Method】15 broiler breeds with different growth rates were used as research materials, including eight yellow-feathered broiler lines (5 medium-fast and 3 slow lines), two local chicken breeds (Gushi chicken and Tibetan chicken), two introduced chicken breeds (Recessive White and Anka), one white-feathered broiler (Ross 308), 817 hybrid broiler and one commercial layer line (Dawu Brown Eggshell Hens). Chicken blood was collected, and DNA was PCR amplified. The full sequences of mtDNA D-loop region of 683 individuals from 15 chicken breeds were sequenced, and the genetic diversity and haplotype characteristics of each chicken breed were analyzed using DnaSP 5.10 software. The genetic distance between breeds was calculated using MEGA 4.0 software, and then a phylogenetic tree was constructed between different haplotypes and the red original chicken. 【Result】The full sequence size of the D-loop region of 15 chicken breeds ranged from 1 231 to 1 232 bp, and individuals with sequence length of 1 231 bp had C-base deletion at 859 bp. 45 variant loci were detected in 683 individuals, which were combined into 53 haplotypes and could be divided into four haplotype groups, including A, B, C and E. Among them, the medium-fast broilers, 817 hybrid broilers and high-yielding laying hens were all haplotype E as the dominant haplotype (≥48.89%); the dominant haplotypes were B haplotypes for Hongguang black chickens, A haplotypes for Jinghai yellow chickens, and four haplotypes were relatively balanced for Xueshan chickens (the proportion of E haplotypes ≤38.46% for three chicken breeds); the haplotypes of local chicken breeds were A and C haplotypes for Gushi chickens and A and B haplotypes for Tibetan chickens. The genetic diversity of the 15 chicken breeds ranged from 0.496 to 0.853 forand from 0.00146 to 0.00673 for. The relatively rich genetic diversity was found in the Xinxing Dwarf Yellow Chicken, Xueshan Chicken, Jinghai Yellow Chicken and Ross 308; the relatively low genetic diversity was found in the Tibetan Chicken, the High Laying Chicken, the Anka Chicken, the Xinxing partridge Chicken No. 4 and the Xugang Yellow Chicken No. 1. The range of Kiumura two-parameter distance of 15 chicken breeds was 0.0016-0.0113, among which the intra-breed genetic distance of Ross 308 was the largest while the intra-breed genetic distance of 817 hybrid broiler and high-yielding chicken was the smallest; the inter-breed genetic distance was the largest between high-yielding chicken and Tibetan chicken, and the smallest between high-yielding chicken and 817 hybrid broiler; the genetic distance between medium-fast broiler was relatively small while the genetic distance between medium-fast broiler, slow-fast and local chicken breeds was relatively large; the genetic distance between Jinghai and local chicken breeds was relatively large. Cluster analysis showed that the haplotypes A, B, andwere clustered in one group. Haplotype E andwere clustered in another group. Haplotype C was clustered with four subspecies of jungle fowl, including,,and. 【Conclusion】The genetic diversity of mitochondrial D-loop region varied among different chicken breeds; E haplotypes were strongly correlated with broiler growth rate, and E haplotypes were the dominant haplotypes in all medium and fast populations, while the proportion of E haplotypes in slow populations was less than 40%; the national chicken population had multiple red proto-chicken maternal origins, indicating that it was domesticated under neutral selection. The results of the study provided a theoretical basis for broiler breed selection and tracing as well as resource exploitation.
chicken; mitochondrial DNA; D-loop region; genetic diversity; genetic origin

2020-08-14;
2021-10-15
国家自然科学基金(31702079,31672382,31501917,31372277)、江苏省六大人才高峰资助项目(NY-011)、江苏省现代农业—重点及面上项目(BE2018363)、江苏省家禽遗传育种重点实验室资助项目(JQLAB-ZZ-202002)
唐修君,E-mail:tangxj0918@126.com。樊艳凤,E-mail:fanyanfeng@126.com。唐修君和樊艳凤为同等贡献作者。通信作者高玉时,E-mail:gaoys100 @sina.com
(责任编辑 林鉴非)

