物质结构和元素周期律知识检测题
■雷范军
一、选择题(本题共7 个小题,每小题6分,共42分,在每小题给出的四个选项中,只有一项是符合题目要求的)

A.H2NCONH2与H2O2是通过氢键结合的
B.H2O2分子中只含共价键,不含离子键
C.H2NCONH2·H2O2属于离子化合物
D.H2O2既有氧化性又有还原性
2.氯及其化合物的“价—类”二维图(见图1)体现了化学变化之美。下列说法错误的是( )。
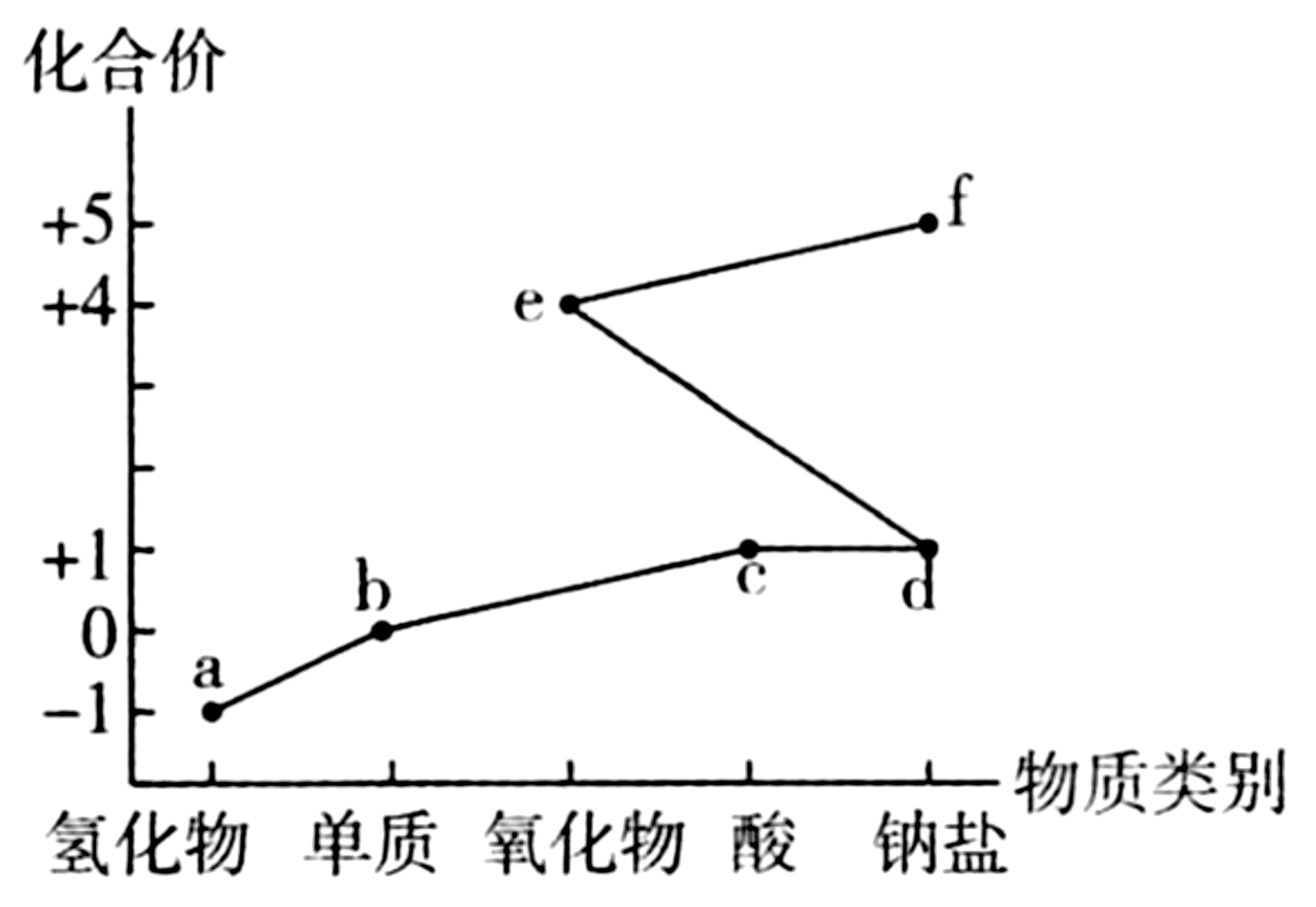
图1

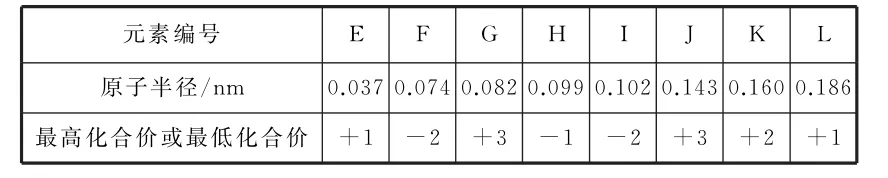
表1
A.最高价氧化物对应水化物的酸性:H>I
B.简单离子半径:K>F
C.同温下,形状、大小相同的单质与等浓度、等体积的稀硫酸反应的速率:L>K>J
D.J、K、L 的单质可以通过电解法冶炼获得
5.中科院电子学研究所的研究人员已经掌握了锶原子光钟研究的一系列关键技术,为显著提高卫星导航系统的定位精度奠定了基础。锶(元素符号Sr)的原子序数为38,下列说法中不正确的是( )。
A.84Sr、86Sr、87Sr、88Sr互为同位素
B.由Sr的原子序数可知,其在周期表中的位置是第五周期第ⅡA 族
C.根据元素周期律可知,Sr(OH)2的碱性强于Ca(OH)2,弱于Ba(OH)2
D.根据元素周期律可知,Sr的还原性强于Mg,因此可以从MgCl2溶液中置换出Mg
6.最新文献报道,有机小分子可催化多氟芳香化合物的取代反应,机理如图2所示。

图2
下列说法错误的是( )。
A.物质2是催化剂
B.物质4和物质7都是反应中间体

D.物质2向物质4的转化过程中有非极性键与极性健的断裂与形成
7.M、W、X、Y、Z 是同周期主族元素,X原子的最外层电子数是W 原子次外层电子数的3倍。它们形成的化合物可用作新型电池的电极材料,结构如下所示。化合物中除M+外,其他原子均满足8电子稳定结构。下列说法正确的是( )。

A.M 的单质通常保存在煤油中
B.上述五种元素中Y 的原子半径最小
C.Z的氢化物的沸点一定低于X 氢化物的沸点
D.W 的最高价氧化物对应的水化物是三元酸

Ⅱ.(1)比较酸性溶液中的氧化性强弱:MnO2(填“>”“<”或“=”)Fe3+;用一个离子方程式说明MnO2与Fe3+氧化性的相对强弱:___。
(2)苯酚是一种重要的化工原料,在工业合成、医疗消毒等方面都有着广泛的应用。苯酚官能团的电子式是____;从试剂瓶中取出的苯酚晶体往往略带红色的原因是_____。
9.(14分)X、Y、Z、W、P 为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X 元素形成的单质是自然界中含量最多的气体,1molY 的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标准状况下均为33.6L。W 的原子最外层电子数与核外电子总数之比为3∶8,X 的原子序数是Z的原子序数的一半。
(1)Z的原子结构示意图为_____,W 与P可形成原子个数比为1∶2的化合物,其电子式为____。
(2)经测定,在2.5×1.01×105Pa下,Y与P形成的化合物的熔点为190 ℃,沸点为178℃,则该化合物的类型为____(填“离子化合物”或“共价化合物”)。
(3)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是____(填化学式)。
(4)Y 与W 形成的化合物遇水分解,发生反应的化学方程式为____。
10.(15分)氮及其化合物在工农业生产、生活中被广泛使用,造福人类。
Ⅰ.元素X、Y、Z位于同一周期且原子序数依次增大,它们和氢元素、硫元素组成的含氮化合物(结构如下)常用作丝绸漂白剂。回答下列问题:

(1)Y 的元素符号为____。
(2)下列说法错误的是_____(选填序号)。
A.原子半径:X>Y>Z
B.简单气态氢化物稳定性:Y<Z
C.该化合物可溶于水
D.该化合物中所有原子均为8电子稳定结构
Ⅱ.工业上用氨气来制造硝酸,NH3转化关系如图3所示。
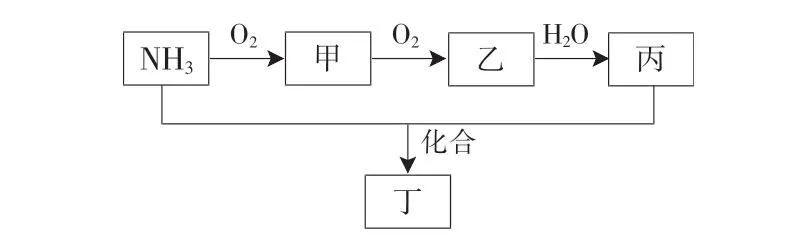
图3
(4)乙转化为丙的离子方程式为_____。
(5)检验化合物丁中阳离子的方法:取少量待测液于试管中,加入____并加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝。
(6)工业上常使用NH3处理甲,生成无污染的N2,则NH3与甲完全反应的物质的量之比为_____。
11.(14分)图4为元素周期表的一部分,参照元素①~⑧在周期表中的位置,回答下列问题:
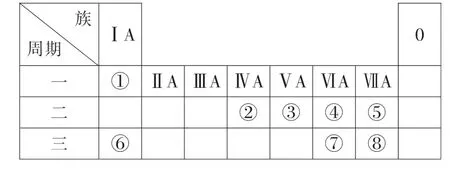
图4
(1)④⑥⑦的离子半径由大到小的顺序为____(填离子符号)。
(2)②⑦⑧的最高价含氧酸的酸性由强到弱的顺序为_____(用化学式表示)。
(3)由元素①~⑧形成的物质可发生图5中的反应,其中A 含有离子键,D、F 是单质,E 是⑦的最高价氧化物对应的水化物,B是温室气体的主要成分。
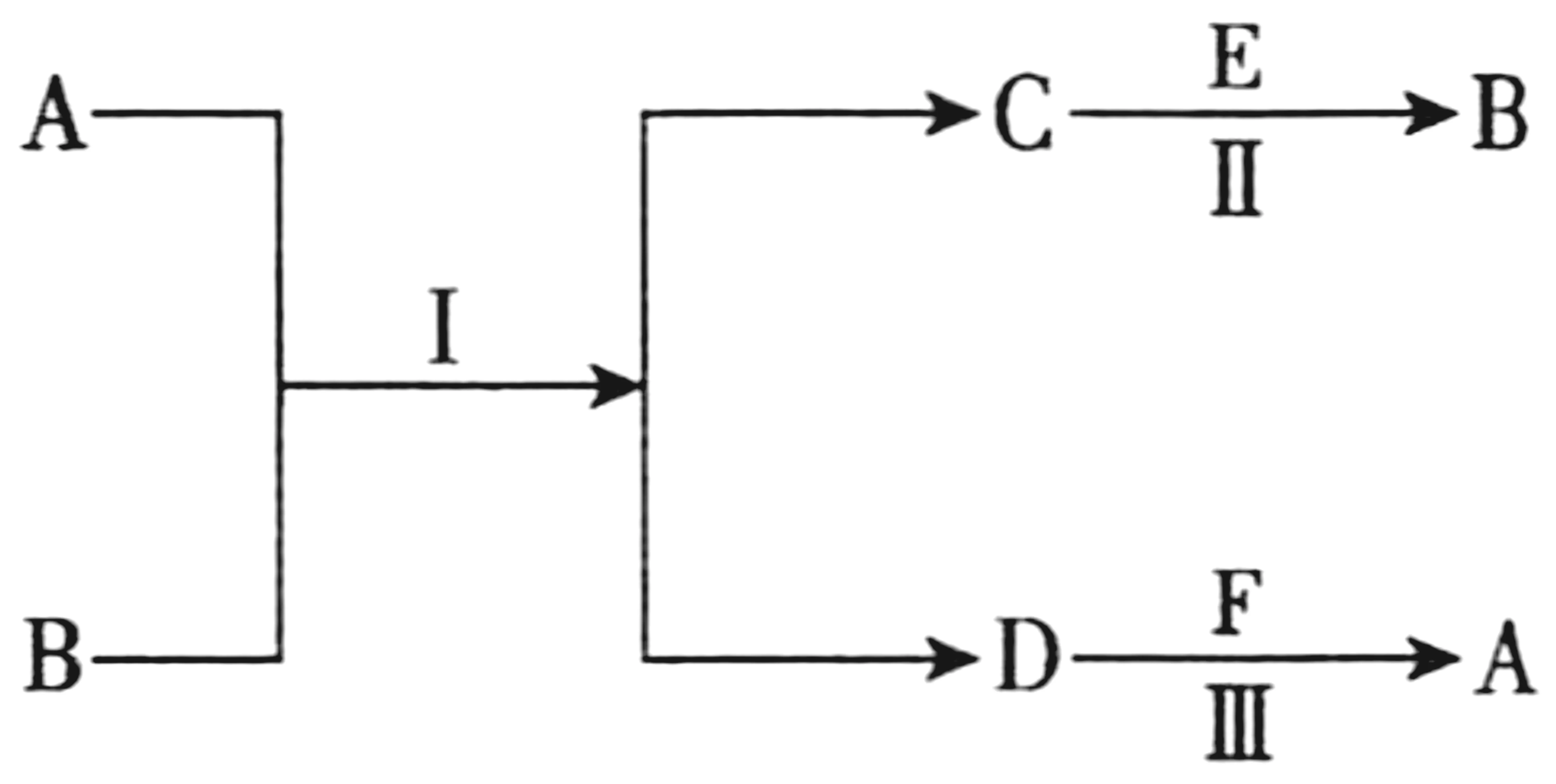
图5
①A 的电子式为_____。
②反应Ⅱ的反应类型为____。
甘肃省农业科学院蔬菜研究所副所长张玉鑫介绍说,武威地区全年降水量102-200毫米,蒸发量却在2000毫米以上,这是其土壤严重干旱缺水的重要原因。十几年来,在当地农业部门的大力支持引导下,设施农业蓬勃发展,尤其是依托当地日照资源发展的日光大棚,为农户带来了可观的收入,此时的大漠已是欣欣向荣。据统计,武威日光温室和塑料大棚面积已达到17.2万亩,其中,日光温室就占到了14.1万亩,是甘肃重要的蔬菜产区。但同我国其他省份一样,由于多年来肥料的不合理使用,武威地区土壤板结严重,瓜果蔬菜品质逐年下降,农户们看在眼里,急在心上。
③反应Ⅰ中消耗标准状况下1.12LB时,转移的电子数约为_____。
(4)⑧的某种氧化物是常见的消毒剂,等物质的量时其消毒能力是单质⑧的2.5 倍,实验室制取该消毒剂的常用方法为向含元素⑧的含氧酸钠盐中加入甲醇和稀硫酸,生成67.5g该消毒剂时,转移NA个电子,则该反应的化学方程式为。



4.B 提示:F、I两元素的最低化合价都为-2价,则F、I位于元素周期表第ⅥA 族,由原子半径可知,F为O 元素,I为S元素;H元素的最低化合价为-1 价,原子半径大于O 的原子半径,则H 为Cl元素;G、J两元素的最高化合价都为+3 价,G 的原子半径小于J,则G 为B 元素,J为Al元素;E、L 两元素的最高化合价都为+1价,E 的原子半径小于O 的原子半径,L的原子半径大于Al的原子半径,则E 为H 元素,L 为Na元素;K 元素的最高化合价为+2价,原子半径介于Na和Al之间,则K 为Mg元素。非金属元素的非金属性越强,最高价氧化物对应水化物的酸性越强,氯元素的非金属性强于硫元素,则高氯酸的酸性强于硫酸,A 项正确。电子层结构相同的离子,核电荷数越大,离子半径越小,氧离子和镁离子的电子层结构相同,则氧离子的离子半径大于镁离子,B 项错误。金属元素非金属性越强,单质与酸反应越剧烈,金属性Na>Mg>Al,则同温下,形状、大小相同的单质与等浓度、等体积的稀硫酸反应的速率Na>Mg>Al,C项正确。Na、Mg、Al均为活泼金属,工业上用电解法冶炼获得Na、Mg、Al的单质,D 项正确。
5.D 提示:84Sr、86Sr、87Sr、88Sr等几种原子都是Sr元素的不同原子,互为同位素,A项正确。由Sr的原子序数可知,其各个电子层排布的电子数依次为2、8、18、8、2,共有5个电子层,最外层有2个电子,其在周期表中的位置是第五周期第ⅡA 族,B 项正确。Ca、Sr、Ba位于同一主族,其金属性依次增强,根据元素周期律可知,Sr(OH)2的碱性强于Ca(OH)2,弱于Ba(OH)2,C 项正确。根据元素周期律可知,Sr的还原性强于Mg,Mg能与冷水反应,Sr也能与冷水反应,因此不能从MgCl2溶液中置换出Mg,D 项错误。

7.B 提示:M、W、X、Y、Z是同周期主族元素,X 的最外层电子数是W 次外层电子数的3倍,则W 有两个电子层,次外层有2 个电子,X 为氧元素;由盐的结构可知,Z 可以形成四个共价键,且能与氧形成双键,则Z的最外层电子数为4,Z 为碳元素;四种元素位于同周期,且Y 能形成一个共价键,Y 为氟元素;W 能形成4个共价键,则W 为硼元素;化合物中除M+外均满足8 电子稳定结构,则M 形成+1价离子,为锂元素。锂单质密度比煤油小,不可以保存在煤油中,一般保存在石蜡油中,A 项错误。同周期元素,从左到右原子半径依次减小,则上述五种元素中氟原子的原子半径最小,B 项正确。碳元素的氢化物为烃,固态烃的沸点比水和过氧化氢的沸点高,C 项错误。硼元素的最高价氧化物对应的水化物为硼酸,硼酸为一元弱酸,D项错误。
8.(15分)Ⅰ.(1)锂离子和氢负离子核外电子排布相同;锂离子核电荷数(或质子数)比氢离子核电荷数(或质子数)多(4分)
(2)9(2分)
(3)2∶3(2分)

提示:Ⅰ.(1)核外电子排布相同的离子,半径比较方法是原子序数大的半径小,因为原子序数越大,核电荷数越大,对核外电子吸引力越强,所以半径比较小,Li+半径小于H-。
(2)通过类比法,苯分子是平面型分子,苯中12个原子共平面,而取代苯上的氢原子也是在其平面上。一定共面的碳原子是苯上的6个,甲基1个,苯与苯相连的碳原子和苯分子对位上的碳原子,至少有9个碳原子。
(3)根据白磷分子中的原子和共价键可以直接判断磷原子与共价键数目之比为2∶3。
Ⅱ.(1)由于MnO2可以氧化Fe2+,发生反应 MnO2+2Fe2++4H+Mn2++2Fe3++2H2O;根据氧化剂的氧化性大于氧化产物的氧化性,可知酸性溶液中的氧化性强弱:MnO2>Fe3+。

(2)共价化合物(2分)
(3)HCl、H2S、SiH4(3分)
(4)Al2S3+6H2O2Al(OH)3↓+3H2S↑(3分)
提示:X 为N 元素,Y 为Al元素,Z为Si元素,W 为S元素,P为Cl元素。


因为氯最外层有7 个电子,因此需要共用1对电子,硫最外层有6个电子,需要共用2对电子,所以是一个硫和2个氯一边共用一对。
(2)Y 与P形成的化合物为AlCl3,在2.5的大气压下熔点为190℃,沸点为178℃(易升华),说明AlCl3不是离子化合物,而是由分子构成的共价化合物,分子间的作用力很弱,具有较低的熔点、沸点、硬度小、易挥发等性质。
(3)气态氢化物中稳定性强弱取决于元素非金属性的强弱,元素的非金属性越强,对应氢化物越稳定,Z、W、P 三种元素的气态氢化物稳定性由高到低的顺序是HCl、H2S、SiH4。
(4)铝离子和硫离子发生相互促进的水解反应,可以得到氢氧化铝和硫化氢Al2S3+6H2O2Al(OH)3↓+3H2S↑。
10.(15分)(1)N(1分)
(2)D(4分)

(4)3NO2+H2O2H++2NO-3+NO(3分)
(5)NaOH 溶液(2分)
(6)2∶3(3分)
提示:Ⅰ.(1)Y 为氮元素,元素符号为N。
(2)X 为碳元素,Y 为氮元素,Z 为氧元素,同周期自左向右原子半径减小,即原子半径:X(碳)>Y(氮)>Z(氧),A 项正确;非金属性Y(氮)<Z(氧),则简单气态氢化物稳定性Y<Z,B 项正确;该化合物的分子中含有多个氧原子和氮原子,可与水形成多个氢键,可溶于水,C项正确;该化合物中H 原子为2电子稳定结构,并不是所有原子均为8 电子稳定结构,D 项错误。
Ⅱ.由转化关系可知,甲为NO,乙为NO2,丙为HNO3,丁为NH4NO3。
(3)NH3为共价化合物,氮原子和每个氢原子之间形成一个共用电子对,电子式为

(4)NO2与水反应生成HNO3和NO,反应的离子方程式为3NO2+ H2O2H++2NO-3+NO。

(6)工业上常使用NH3处理甲(NO),生成无污染的N2,二者反应的化学方程式为4NH3+6NO5N2+6H2O,则NH3与甲(NO)完全反应的物质的量之比为2∶3。
11.(14分)(1)S2->O2->Na+(2分)
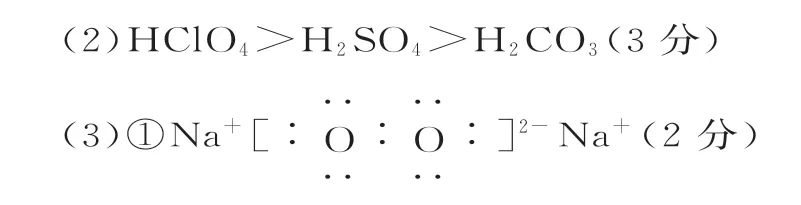
②复分解反应(2分) ③3.01×1022(2分)
(4)6NaClO3+3H2SO4+CH3OHCO2↑+6ClO2+3Na2SO4+5H2O(3分)
提示:根据元素周期表的位置关系可知,①为H,②为C,③为N,④为O,⑤为F,⑥为Na,⑦为S,⑧为Cl,结合元素周期律分析作答第(1)(2)问。
(3)由元素①~⑧形成的物质可发生图中的反应,其中A 含有离子键,B是温室气体的主要成分,则B为CO2,能与CO2反应生成单质且含离子键的A 应是Na2O2,则另一个产物C为Na2CO3;E 是⑦的最高价氧化物对应的水化物,则E 为H2SO4,可与Na2CO3反应生成B(CO2);单质D 为O2,与单质F 反应可生成A(Na2O2),则推出F为Na,据此分析作答。
(4)⑧的某种氧化物是常见的消毒剂,设该氧化物中氯的化合价应为x,等物质的量时其消毒能力是Cl2的2.5倍,则转移电子数是氯气的2.5倍,即[x-(-1)]NA=2×2.5NA,解得x=+4,即该氧化物为ClO2,再根据氧化还原反应的规律书写离子方程式即可。

