TGF-β1受体对ClC-3氯通道在正畸骨代谢中表达的影响
卢晓琳,王 欢,曹 猛,金作林
牙槽骨改建是维持颅颌面骨骼正常形态结构的重要环节,也是正畸牙齿移动的生物学基础。牙槽骨在正畸力的作用下处于骨吸收和骨形成的动态平衡过程,压力侧破骨细胞分化成熟,促进骨吸收;张力侧成骨细胞增殖分化,增强新骨形成[1]。但是关于牙槽骨代谢的具体作用机制目前尚不明确。ClC型氯通道是一种电压门控型氯通道。其中,ClC-3作为电压门控型氯通道之一,存在于细胞膜或细胞器膜上,参与调节细胞容积、细胞迁移、增殖与凋亡以及细胞器酸化等多种生物活动[2-3]。而且,ClC-3氯通道在骨代谢方面也发挥着重要的调节作用,其基因敲除小鼠自出生后就表现出发育迟缓、钙磷代谢异常等骨骼畸形,伴随较高的死亡率[4-6]。转化生长因子-β1(TGF-β1)调控相应靶基因表达的前提是通过TGF-β1受体(TGF-β1 receptor,TβR)介导的,即处于活化状态的TGF-β1分子与细胞膜上的TβR相结合。TβR主要包括Ⅰ、Ⅱ、Ⅲ型三种,其中Ⅰ型和Ⅱ型受体位于细胞膜上,直接参与信号的转导[7-8]。研究发现,在ClC-3氯通道调控成骨分化过程中,TGF-β1信号分子的表达与ClC-3氯通道有十分密切的联系[9]。
ClC-3氯通道和TβR在促进成骨分化中是否具有某种内在的联系,目前还不明确。本研究旨在初步探索TβR对ClC-3氯通道在成骨细胞中的促成骨分化作用,拟通过观察成骨细胞中不同表达水平的ClC-3氯通道和TβR表达的相互影响,为ClC-3氯通道在促成骨分化机制方面研究提供新的思路。
1 材料与方法
1.1 材料
α改良伊格尔基本成分(α-MEM)培养液、胰蛋白酶、青霉素及链霉素(Hyclone公司,美国);MC3T3-E1细胞系(此细胞株是小鼠成骨前体细胞,可以分化为成熟的成骨细胞。由西安飞扬生物科技有限公司提供);TGF-β1受体抑制剂(LY2109761,Selleck公司,美国);CCK-8试剂(Sigma公司,美国);Trizol(Invitrogen公司,美国);逆转录试剂盒(TaKaRa公司,日本);Real-Time PCR试剂盒(TaKaRa公司,日本);脂质体2000(LipofectamineTM2000,Invitrogen公司,美国);ClC-3抗体(CST,美国);二抗(CST,美国)。
1.2 TβR抑制剂(LY2109761)的配制
将5 mg TβR抑制剂(LY2109761)溶解于1.132 45 mL的二甲基亚砜(DMSO)溶液中,得到浓度为10 mmol/L的储存液,以每管20 μL分装于EP管中,-80 ℃保存备用。工作液是将储存液按浓度梯度稀释到所需的20、2、0.2 μmol/L的浓度。
1.3 细胞培养与分组
将细胞系MC3T3-E1以1×104个/mL的密度接种于六孔板中,选取细胞生长状况良好,融合面积为80%左右的细胞给予LY2109761的刺激。分为三大组,A:空白对照组;B:0.2、2、20 μmol/L作用24 h组;C:0.2、2、20 μmol/L作用48 h组。
1.4 LY2109761细胞毒性检测(CCK-8比色法)
以每孔约100 μL的细胞悬液(2×104个/mL)接种到96孔板中,在37 ℃、5%CO2的培养箱中培养24 h使细胞贴壁。向培养板中加入10 μL三种浓度的抑制剂(LY2109761)分别培养24和48 h。向每孔中分别加入10 μL的CCK-8溶液后在培养箱中继续孵育4 h,测定各组细胞在450 nm处的吸光度值,以上实验步骤重复至少三次。其中细胞死亡率=100%-细胞活力,细胞活力=(A(加药)-A(空白))/(A(0加药)-A(空白))×100%。A(加药)为具有细胞、CCK-8溶液和药物溶液的孔的吸光度;A(空白)为具有培养基和CCK-8溶液而没有细胞的孔的吸光度;A(0加药)为具有细胞、CCK-8溶液而没有药物溶液的孔的吸光度。
1.5 RNA 提取和Real-time PCR
按照Trizol试剂盒说明提取细胞总RNA,将LY2109761不同浓度不同作用时间处理后的各组细胞提取总RNA:选取生长良好的细胞,弃去培养液,使用PBS轻轻冲洗两遍;在每孔中加入Trizol,裂解,静置。转移上清液至新的EP管。在上清液中加入氯仿,至样品分为透明上清、白色蛋白和有机物三层。吸出透明血清,加入异丙醇,弃去上清液。向沉淀物中加入75%的乙醇,弃去上清液。向沉淀中加入焦碳酸二乙酯(DEPC)水,使用分光光度计将提取物定量。
按照TaKaRa逆转录试剂盒说明合成cDNA,然后将其稀释10倍,将稀释后的cDNA进行Real-time PCR反应。特异性引物序列如下(表1)。

表1 PCR引物序列及引物大小
1.6 Western Blot检测
将细胞置于冰上,加入蛋白裂解液,离心,提取细胞总蛋白,蛋白质定量试剂盒(BCA)法进行蛋白定量。将蛋白放至100 ℃加热5 min使其变性,凝胶电泳,转膜,孵育一抗4 ℃过夜,孵育二抗,化学发光试剂盒(ECL)发光,使用Image-J软件对蛋白进行扫描及灰度值分析。
1.7 siRNA基因转染
将MC3T3-E1细胞以2×104个/mL接种于六孔板中,待细胞密度融合至70%左右时进行siRNA的转染。分别使用Opti-MEM稀释ClC-3 siRNA和Lipo2000转染试剂,使转染细胞的最终浓度为50 nmol/L,二者轻轻混合,室温下静置20 min。将转染复合物加入到细胞中,孵育6 h,更换常规培养液继续培养48 h。
1.8 统计学方法
以上实验结果应用SPSS 17.0统计学软件对数据进行统计分析,实验数据均以“均数±标准差”表示,采用单因素方差分析各实验组。以P<0.05为差异具有统计学意义。
2 结 果
2.1 不同作用方式的TβR抑制剂细胞毒性的结果
与空白对照组相比,0.2、2、20 μmol/L浓度的TβR抑制剂分别作用24 h和48 h对MC3T3-E1细胞都具有细胞毒性(P<0.05)。相同作用时间时,抑制剂的细胞毒性随作用浓度的增大而增大,不同作用浓度的抑制剂之间对细胞毒性作用均有统计学差异(P<0.05),其中0.2、2 μmol/L浓度的抑制剂作用24 h时的细胞毒性无统计学意义(P>0.05)。TβR抑制剂在相同作用浓度时,作用时间越短,细胞毒性越小(P<0.05),以浓度为0.2 μmol/L的TβR抑制剂作用24 h对细胞的毒性作用最小(图1)。

A:不同作用浓度的TβR抑制剂在相同作用时间对细胞毒性的影响;B:相同作用浓度的TβR抑制剂在不同作用时间对细胞毒性的影响;*:P<0.05,**:P<0.01
2.2 TβR抑制剂对TβRⅠ、TβRⅡ基因表达的影响
Real-Time PCR结果显示,0.2、2 μmol/L浓度的TβR抑制剂作用MC3T3-E1细胞24 h后,都可以抑制TβRⅠ、TβRⅡ基因的表达(P<0.05)。而对TβRⅠ、TβRⅡ基因表达的抑制效果随浓度增大而增强(P<0.05)(图2)。
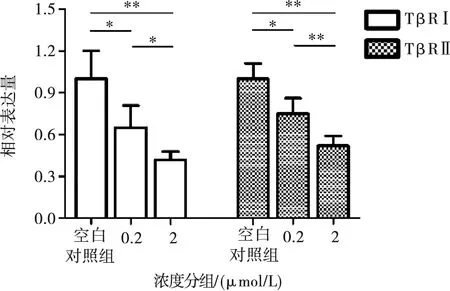
*:P<0.05,**:P<0.01
2.3 TβRⅠ、TβRⅡ对ClC-3氯通道表达的影响
浓度为2 μmol/L的TβR抑制剂对MC3T3-E1细胞作用24 h后的Real-Time PCR和Western结果表明,与空白对照组相比,TβR抑制剂组促进ClC-3氯通道基因和蛋白的表达(图3)。

A:阻断TβRⅠ、TβRⅡ的表达对ClC-3基因的影响;B:阻断TβRⅠ、TβRⅡ的表达对ClC-3蛋白的影响;C:ClC-3蛋白灰度分析;*:P<0.05
2.4 ClC-3氯通道对TβRⅠ、TβRⅡ表达的影响
对MC3T3-E1细胞进行ClC-3 siRNA基因转染,ClC-3 siRNA转染序列如下,Sense:5′-CGA GAG AAG UGU AAG GAC ATT-3′;Anti-sense:5′-UGU CCU UAC ACU UCU CUC GTT-3′。转染序列的有效性在前期实验已得到验证。Real-Time PCR结果显示,阻断ClC-3氯通道的表达,可以促进TβRⅠ和TβRⅡ基因的表达(P<0.05)(图4)。

*:P<0.05,**:P<0.01
2.5 TβR对成骨分化相关基因(Alp、Runx2)表达的影响
分别使用ClC-3 siRNA和TβR抑制剂阻断氯通道和TβR的表达,观察Alp、Runx2的变化。Real-Time PCR结果显示,TβR抑制剂组的Alp和Runx2的表达均升高(P<0.05),而ClC-3抑制剂组的Alp和Runx2基因表达下降(P<0.05)(图5)。
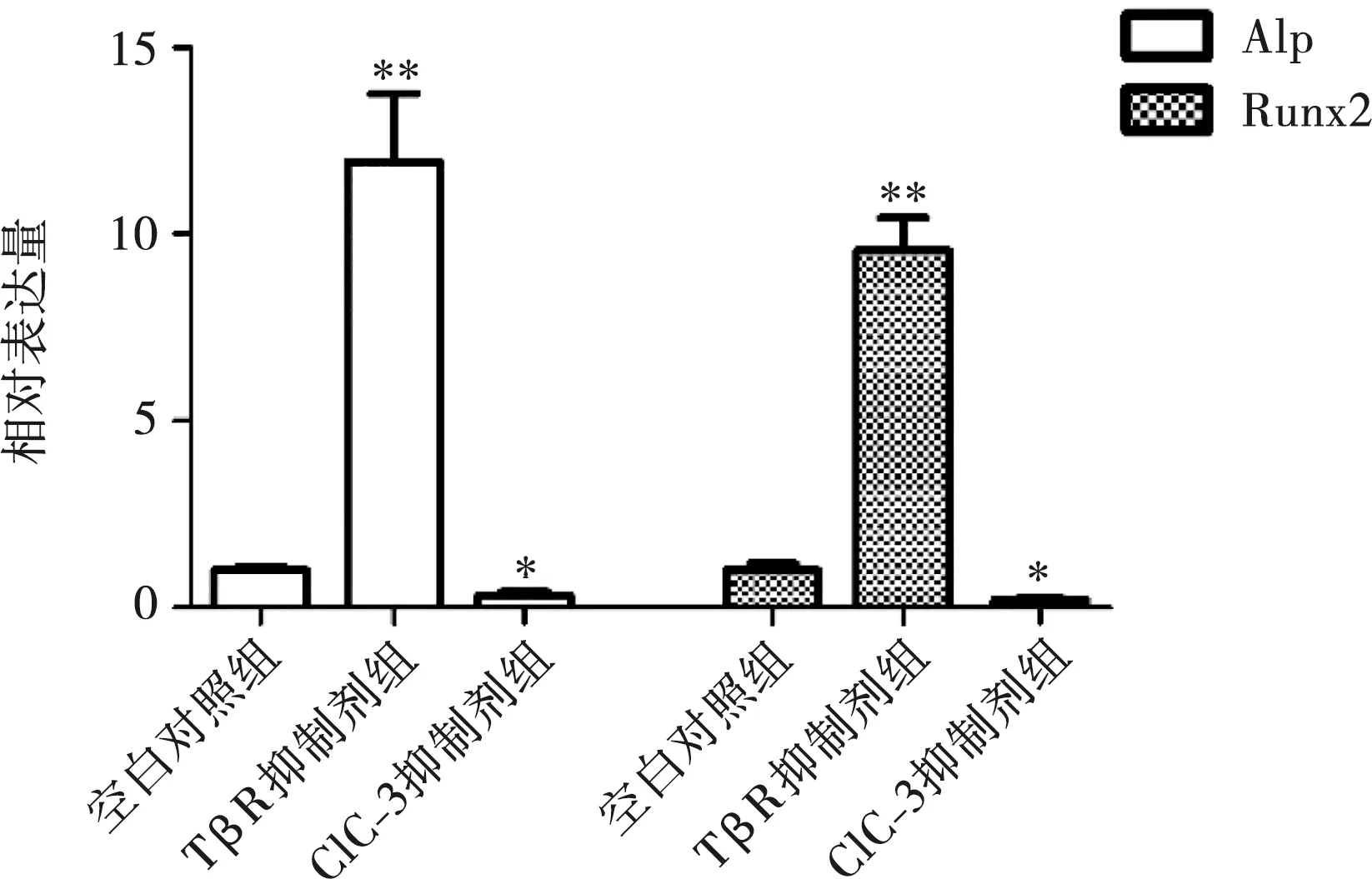
与空白对照相比,*:P<0.05,**:P<0.01
3 讨 论
正畸牙齿的移动是通过压力侧牙槽骨吸收,张力侧牙槽骨新骨形成稳定在新的位置。ClC-3氯通道作为电压门控型氯通道之一,存在于细胞膜或细胞器膜上,在正畸骨改建过程中,ClC-3氯通道被证实参与骨代谢的生物信号传导过程[10]。ClC-3氯通道在小鼠的骨髓间充质干细胞、成骨细胞以及成骨前体细胞系中均可表达, 能够促进成骨细胞的成骨分化[11]。TGF-β1生长因子在骨架形态发生和成骨细胞分化过程中具有重要作用[12-14]。研究表明,TGF-β1与ClC-3氯通道的表达有紧密联系[9]。阻断TGF-β1表达可促进ClC-3氯通道对骨代谢的调控。TGF-β1通常是以异构受体复合体发挥作用,与TβRⅠ、TβRⅡ在细胞表面结合后引发后续的细胞应答[15]。但是关于TβR在ClC-3氯通道调控成骨分化过程中的作用目前还未见相关研究。
TβR抑制剂按作用方式分为选择性单独抑制TβRⅠ或TβRⅡ以及同时抑制TβRⅠ和TβRⅡ表达等几种类型[16]。本研究通过选用同时抑制TβRⅠ和TβRⅡ表达的小分子受体激酶抑制剂(LY2109761)来阻断TGF-β1下游受体,观察对ClC-3氯通道在成骨分化过程中的作用。首先,本实验将TβR抑制剂对TβRⅠ和TβRⅡ基因的最佳作用方式进行筛选,根据细胞的不同,许多文献研究使用了0.2~10.0 μmol/L的浓度范围的同种抑制剂作用不同时间来研究细胞功能[17-18],但是还没有对TβR抑制剂作用于MC3T3-E1细胞进行过多的研究。经过预试验的筛选,最终选取了0.2、2、20 μmol/L三种浓度梯度分别作用24 h和48 h来观察TβRⅠ和TβRⅡ抑制剂对MC3T3-E1的细胞毒性。细胞毒性试验结果表明随着抑制剂浓度增大、作用时间延长其细胞死亡率也在升高,这说明抑制剂对细胞的毒副作用随着剂量和作用时间而增大,并且抑制剂在0.2 μmol/L和2 μmol/L的浓度作用24 h时细胞的死亡率并无统计学意义,这可能说明TβR抑制剂在对MC3T3-E1细胞作用时间较低时,作用浓度在较小的范围之间发生波动对细胞的毒性没有太大影响,而超出一定浓度,则会提高细胞的死亡率。而将0.2 μmol/L和2 μmol/L两种浓度梯度的抑制剂作用24 h来观察TβRⅠ和TβRⅡ两种受体基因的表达结果显示,2 μmol/L的TβR抑制剂对TβR I、TβRⅡ基因表达的抑制效果强于0.2 μmol/L浓度。浓度为2 μmol/L的TβR抑制剂作用于MC3T3-E1细胞24 h对TβRⅠ和TβRⅡ基因的抑制效果已经达到65%左右,并且产生的细胞毒性在可接受的范围内,不会对细胞的生长和增殖产生过度的抑制。
综上,本研究选取浓度为2 μmol/L的TβR抑制剂作用MC3T3-E1细胞24 h作为最佳作用方式抑制TβR的表达,并进一步观察其对ClC-3氯通道的影响。结果显示,当抑制TβR表达时,ClC-3氯通道的基因和蛋白水平表达升高。另一方面,当阻断ClC-3氯通道表达时,同样也会促进TβR的表达。这说明TβR和ClC-3氯通道的表达是相互抑制的。由此猜想,这可能和TβRⅠ、TβRⅡ以及ClC-3氯通道的细胞内定位有关。TβRⅠ、TβRⅡ位于细胞膜上,ClC-3氯通道细胞膜和细胞器膜上也有表达,基于此推测,TβR和ClC-3在细胞膜上的表达存在竞争性关系,当其中一个的表达被抑制时,可促进对方的表达,因此,ClC-3氯通道与TβR的表达可能表现为相互影响的关系。我们在干扰ClC-3氯通道表达时,TβRⅡ的表达与空白对照组相比升高了80%,而TβRⅠ表达升高了50%,这说明,TβRⅡ对不同表达水平的ClC-3氯通道更敏感,这可能和TβRⅡ本身的生物学特性有关,TβRⅡ通常首先通过自身的激活,才能使TGF-β1配体和胞膜上活化的Ⅱ型受体结合,形成异源二聚体,然后再结合Ⅰ型受体形成异三聚体复合物。本研究发现抑制TβR的表达,可促进成骨相关基因(Alp、Runx2)的表达,而ClC-3抑制剂组的成骨相关基因表达与对照组相比却下降,其中TβR抑制剂组的Alp基因升高程度较Runx2基因明显。Alp是成骨分化过程中的早期标志物,在骨形成早期活性较高[19],Runx2是成骨细胞分化过程中关键的转录调控因子,发挥中心调控的作用[20-21]。由此推测TβR在早期对ClC-3氯通道调控成骨分化的影响更显著。综上所述,在正畸骨改建过程中,TβR可抑制ClC-3氯通道对成骨细胞分化的调控,但是其具体的分子机制还有待进一步深入的研究。

