MK2抑制剂PF-3644022对视网膜分支静脉阻塞模型大鼠的治疗作用△
孙 湛 齐 赟 李晶明 崔丽珺 陈 丽 谢安明 康前雁 刘 轩
视网膜静脉阻塞是一种常见的眼科血管疾病,分为视网膜分支静脉阻塞(BRVO)和视网膜中央静脉阻塞。BRVO患病率为0.3%~1.1%,是第二常见的视网膜血管疾病[1]。目前,BRVO的治疗策略包括激光光凝、抗血管内皮生长因子(VEGF)药物和地塞米松玻璃体内注射以减轻视网膜水肿[2]。然而,激光光凝并不能明显提高患者的预后视力[3]。抗VEGF治疗对于需要持续治疗以维持改善视力的患者来说,可能会导致身体疼痛[4]。地塞米松具有抗炎作用,并间接抑制新生血管[5],然而,当使用超过安全范围时,可引起高眼压、白内障和非感染性眼内炎等不良反应[4]。丝裂原活化蛋白激酶激活的蛋白激酶2(MK2)是丝氨酸/苏氨酸蛋白激酶家族中的一员,由p38丝裂原活化蛋白激酶(MAPK)直接磷酸化激活[6-7]。已有研究证实,MK2在炎症细胞因子的生物合成中起关键作用,如促炎症细胞因子、趋化因子和黏附分子[8-9]。MK2的激活在各种疾病的炎症反应中起关键作用,包括肿瘤坏死、胰腺炎和术后肠梗阻[10-11]。局部应用MK2抑制剂可通过抑制干眼的眼表面细胞凋亡和CD4+T细胞介导的炎症反应,有效地减轻眼表损伤[12]。MK2抑制剂可通过阻断MK2的激活,选择性地抑制碱烧伤所致的角膜炎症[10]。然而,目前尚不清楚MK2抑制剂对BRVO的治疗作用。因此,本研究通过建立BRVO大鼠模型,观察MK2抑制剂PF-3644022对BRVO大鼠的治疗效果及作用机制。
1 材料与方法
1.1 材料
1.1.1 实验试剂MK2抑制剂PF-3644022(上海MedChemExpress公司);戊巴比妥钠(美国Sigma公司);速眠新Ⅱ(敦化市圣达动物药品有限公司);孟加拉红钠盐(成都艾科达试剂有限公司);兔抗血管内皮生长因子-α(VEGF-α)、MK2、p-MK2和GAPDH(英国Abcam公司);Cy3标记的羊抗兔IgG(H+L)荧光二抗和辣根过氧化物酶标记的二抗(武汉博士德生物工程有限公司);BCA蛋白检测试剂盒(碧云天生物技术研究所);PVDF膜(美国Millipore公司);增强型ECL化学发光检测试剂盒(南京诺唯赞生物科技股份有限公司)。
1.1.2 实验动物6~8周龄的SPF级健康成年雄性SD大鼠110只,体重180~220 g(北京维通利华实验动物技术有限公司)。所有大鼠均在标准实验室条件下饲养,室温(23±3)℃,湿度40%~65%,光/暗周期12 h,不限制食物和水。
1.2 方法
1.2.1 BRVO模型大鼠的建立BRVO大鼠模型的建立参考文献[13]。大鼠腹腔注射10 g·L-1戊巴比妥钠3 mL·kg-1和50 μL速眠新Ⅱ进行麻醉。将孟加拉红钠盐(50 g·L-1)注入大鼠尾静脉,大鼠右眼用托吡卡胺滴眼液散瞳,待孟加拉红循环至视网膜静脉后,对视网膜分支静脉(距视神经双颞侧3个视盘直径)进行激光光凝。能量:80 mW;持续时间:100 ms;光斑大小:100 μm。可见血流向视盘处坠落,血管变黑,血流停滞。共光凝50个点。右眼为实验眼,左眼为正常对照眼。
1.2.2 动物分组及给药方法将BRVO模型大鼠随机分为5组(n=12):对照组、模型组、低剂量组、中剂量组和高剂量组。低、中和高剂量组大鼠分别按1 mg·kg-1、5 mg·kg-1、10 mg·kg-1给予2 mL的MK2抑制剂PF-3644022灌胃,模型组大鼠给予2 mL生理盐水灌胃,对照组大鼠给予2 mL蒸馏水灌胃。在实验期间,没有观察到任何因MK2抑制剂PF-3644022引起的大鼠临床毒性迹象。治疗后1 d、7 d和14 d进行大鼠眼功能和形态学检查。
1.2.3 光学相干断层扫描和荧光素眼底血管造影检查各组大鼠眼底情况各组大鼠分别在治疗后1 d、7 d和14 d进行光学相干断层扫描(OCT),右眼用5 g·L-1托吡卡胺散瞳,以视盘和激光光凝点为中心进行OCT检查。使用Opto-RIS视网膜成像系统和44D-ISOCT眼科超显微成像系统捕捉眼底和OCT图像。另外,分别在治疗1 d、7 d和14 d进行荧光素眼底血管造影(FFA)。大鼠散瞳后按2 mL·kg-1腹腔注射100 g·L-1荧光素钠注射液,通过眼底荧光造影仪以视盘和激光光凝点为中心对大鼠右眼行FFA检查。
1.2.4 HE染色观察各组大鼠视网膜组织治疗后1 d和21 d,将各组大鼠(n=6)采用颈椎脱臼法处死,快速摘除大鼠眼球。用于组织学分析的眼球用40 g·L-1多聚甲醛在4 ℃下固定至少48 h,石蜡包埋,然后切成5 μm厚切片,进行HE染色,使用奥林巴斯DP71光学显微镜拍摄图像。
1.2.5 免疫荧光染色观察各组大鼠视网膜组织取1.2.3部分大鼠眼球切片,然后脱蜡脱水,用体积分数3% H2O2孵育10 min阻断内源性过氧化物酶活性。切片用PBS(pH 7.2)室温洗涤3次。用体积分数10%山羊血清孵育1 h,然后将切片与兔抗VEGF-A(1200)一抗在4 ℃孵育过夜。然后用PBS洗涤3次,与Cy3标记的羊抗兔IgG(H+L)荧光二抗(1200)室温孵育1 h。PBS洗涤3次后,用DAPI染色细胞核。奥林巴斯BX53荧光显微镜下观察并获取图像。
1.2.6 Western blot检测各组大鼠视网膜中不同基因蛋白表达治疗后1 d和21 d,收集大鼠眼球视网膜组织,并在添加有蛋白酶/磷酸酶抑制剂的RIPA缓冲液中裂解,裂解产物在4 ℃下以12 000 r·min-1离心15 min,取上清液。采用BCA蛋白检测试剂盒测定蛋白浓度。30 μg蛋白质在120 g·L-1SDS-PAGE电泳分离。将蛋白转移到PVDF膜上。将膜与50 g·L-1脱脂奶粉室温孵育2 h后,分别与MK2(12000)、p-MK2(12000)、VEGF-α(11000)和GAPDH(11000)4 ℃孵育过夜。将膜与辣根过氧化物酶标记的二抗(12000)在室温下孵育1 h,然后用增强型ECL化学发光检测试剂盒进行蛋白显影。GAPDH作为内参蛋白。
1.3 统计学分析使用SPSS 21.0软件进行统计分析,数据用均数±标准差表示。所有数据先行正态分布检验,然后进行单因素方差分析(ANOVA)及LSD事后检验。检验水准:α=0.05。
2 结果
2.1 各组BRVO大鼠眼底照相、FFA和OCT检查结果眼底照相结果显示,治疗后1 d,模型组、低剂量组、中剂量组和高剂量组大鼠眼底水肿、视网膜变白、血管排列紊乱、收缩、视盘陷凹消失。随着治疗时间的延长,低剂量组、中剂量组和高剂量组大鼠眼底水肿逐渐减轻、视网膜苍白减少、血管弯曲减轻、视盘陷凹恢复,且不同时期的恢复效果均好于模型组。FFA检查结果显示,治疗后1 d,模型组、低剂量组、中剂量组和高剂量组大鼠眼底血管扩张弯曲严重、部分血管不完整;治疗后14 d,各组大鼠眼底血管弯曲现象均逐渐缓解,并且低剂量组、中剂量组和高剂量组大鼠眼底血管弯曲现象缓解程度明显高于模型组。OCT检查结果显示,治疗后1 d和14 d,与模型组相比,低剂量组、中剂量组和高剂量组大鼠眼底损伤处视网膜厚度以及损伤250 μm 处视网膜厚度均显著降低,并呈剂量依赖性降低(均为P<0.05)(表1)。

表1 各组 BRVO大鼠治疗后14 d视网膜厚度
2.2 MK2抑制剂对BRVO大鼠视网膜结构的影响治疗后1 d,与对照组大鼠相比,模型组、低剂量组、中剂量组和高剂量组大鼠视网膜内核层和外核层厚度明显增加,视网膜光凝部位在治疗后1 d已经完全紊乱。治疗后21 d,与对照组大鼠相比,模型组、低剂量组、中剂量组和高剂量组大鼠视网膜内核层和外核层厚度明显减小,视网膜光凝部位基本恢复正常(图1)。
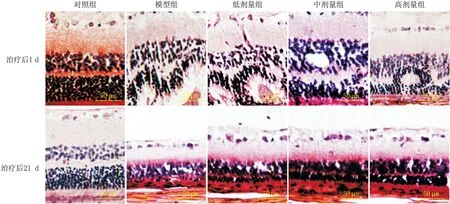
图1 各组 BRVO大鼠视网膜HE染色结果
2.3 MK2抑制剂对各组BRVO大鼠视网膜组织中VEGF-α表达的影响治疗后1 d,与模型组相比,低剂量组、中剂量组和高剂量组大鼠视网膜组织中VEGF-α的相对荧光强度和蛋白表达水平均显著降低,并呈剂量依赖性降低(均为P<0.05)。治疗后21 d,各组大鼠视网膜组织中VEGF-α的相对荧光强度和蛋白表达水平均无明显差异(均为P>0.05)(图2、表2和表3)。
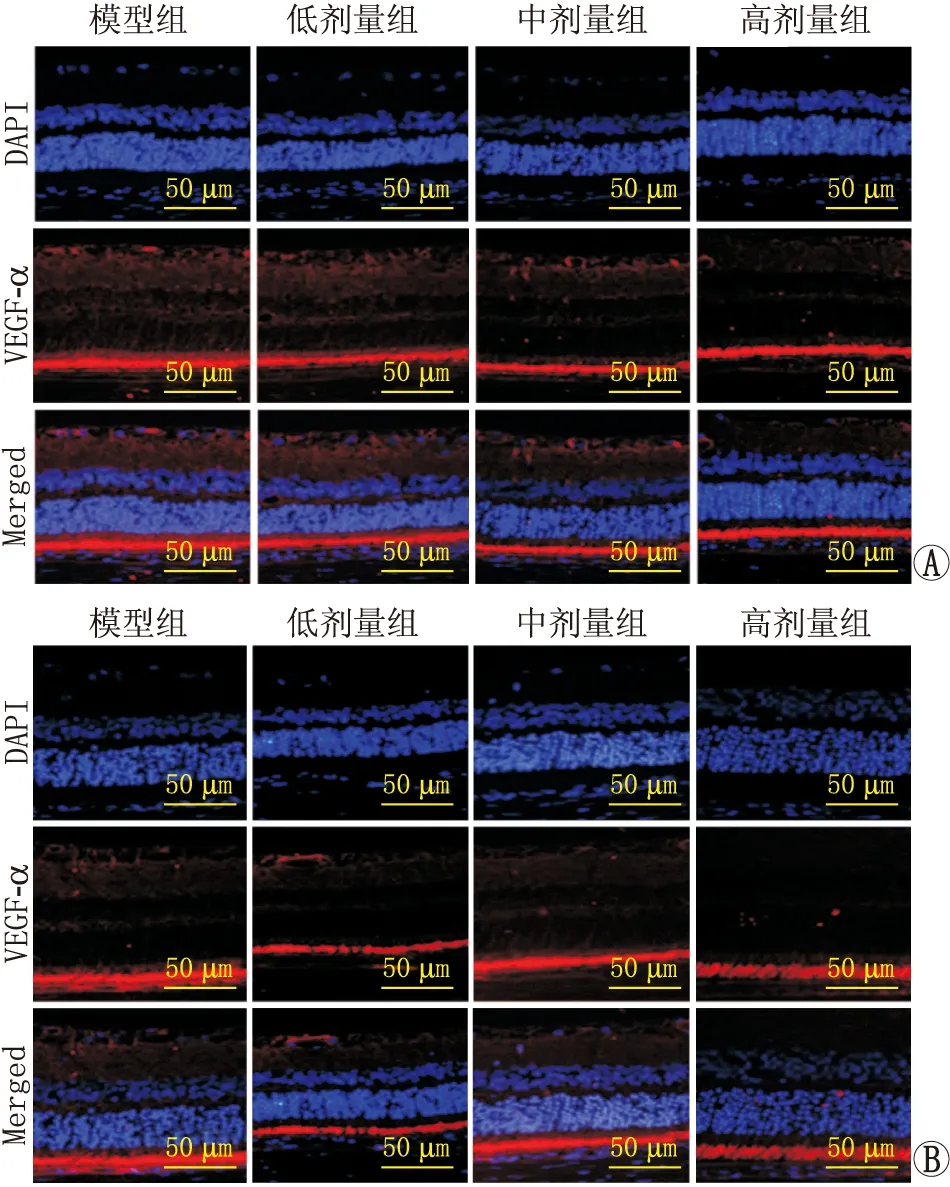
图2 BRVO大鼠视网膜组织中VEGF-α的免疫荧光染色 A:治疗后1 d;B:治疗后21 d

表2 各组BRVO大鼠视网膜组织中VEGF-α的相对荧光强度
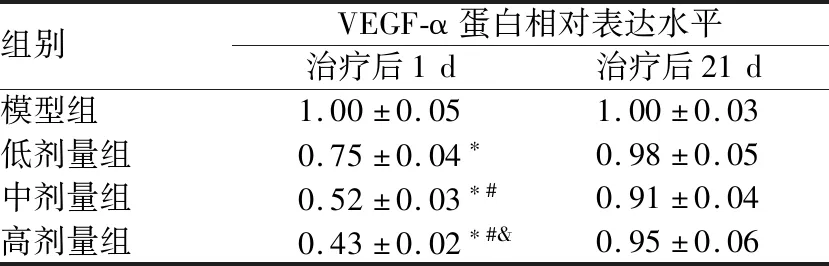
表3 各组BRVO大鼠视网膜组织中VEGF-α蛋白相对表达水平
2.4 MK2抑制剂对各组BRVO大鼠视网膜组织中MK2活性的影响Western blot检测结果显示,治疗后1 d、21 d,与模型组相比,低剂量组、中剂量组和高剂量组大鼠视网膜组织中MK2磷酸化水平均显著降低,并呈剂量依赖性降低(均为P<0.05)(表4)。
3 讨论
BRVO是一种常见的眼科疾病,严重损害患者视力,且患病率随患者年龄增加而增大,给社会带来了极大负担。为了探讨BRVO的进展和视网膜结构和功能的变化,迫切需要一种合适的BRVO动物模型。建立BRVO动物模型的方法有几种,包括手术干预、凝血酶玻璃体内注射和激光光凝[14-15]。早期的激光光凝方法没有模拟视网膜水肿或视网膜无灌注区。本研究中使用了一种改良的激光光凝。首先,选择了一条大小合适的静脉作为靶点,以避免严重的损伤,并确保静脉迅速再通;其次,选择了功率80 mW、持续时间100 ms、光斑大小100 μm作为合适的参数,成功建立了BRVO模型大鼠。应用MK2抑制剂PF-3644022治疗BRVO大鼠21 d,HE染色、眼底照相、FFA和OCT检查结果均证实,MK2抑制剂以剂量依赖性方式减轻了大鼠视网膜水肿、血管排列紊乱和收缩、视盘陷凹消失等病理现象,提示MK2抑制剂PF-3644022是一种潜在的治疗BRVO药物。
目前,抗VEGF-α治疗是治疗BRVO的有效手段。然而,VEGF治疗的效果与阻塞部位、干预时间、间隔时间以及个体特异性有关[16]。VEGF-α在不同阶段发挥不同的作用,在发病初期不利于新生血管的生长,在后期有利于自我愈合[17-18]。在本研究中,免疫荧光染色和Western blot检测结果均显示,治疗后1 d,MK2抑制剂PF-3644022以剂量依赖性方式抑制BRVO大鼠视网膜组织中VEGF-α的表达;然而,治疗后21 d,各组大鼠视网膜组织中VEGF-α的表达均无明显差异(均为P>0.05)。以上结果提示,MK2抑制剂在BRVO早期阶段(即阻塞后1 d)通过抑制VEGF-α的表达来改善血管生成,抑制血管紊乱。而在BRVO的晚期阶段(即阻塞后21 d),MK2抑制剂未影响VEGF-α的表达,从而有助于重建侧支循环,使阻塞的视网膜血管再通。MK2抑制剂可能通过调节VEGF-α的表达来控制BRVO不同阶段的血管生成和再通。值得注意的是,虽然抗VEGF是治疗BRVO的重要手段,但并非唯一手段。本研究中MK2抑制剂调节了VEGF-α的表达并改善了BRVO,但MK2抑制剂是否还通过其他途径治疗BRVO尚未可知,有待于进一步研究。
BRVO引起的缺血缺氧的微环境可导致胶质细胞激活和细胞因子释放,从而促进黄斑水肿形成[19]。研究表明,炎症在BRVO发病中具有重要作用[20],抗炎治疗在BRVO防治中具有非常重要的作用[21]。免疫细胞中p38激酶通路的激活导致促炎细胞因子的转录和翻译调节。MK2是p38激酶的直接下游底物,通过调节脂多糖刺激的TNF-α和IL-6的稳定性和翻译来调节这些mRNA的产生。还有学者报道,MK2抑制剂PF-3644022对TNF-α的产生具有类似的抑制作用,PF-3644022可阻断脂多糖刺激的人全血中TNF-α和IL-6的产生[22]。本研究Western blot结果显示,治疗后1 d和21 d,MK2抑制剂以剂量依赖性方式抑制BRVO大鼠视网膜组织中MK2的磷酸化。这些结果提示,MK2抑制剂对BRVO的治疗作用可能与其本身的抗炎功能有关。
综上所述,本研究发现,MK2抑制剂PF-3644022通过减轻BRVO模型大鼠视网膜水肿、调节VEGF-α的表达、抑制MK2活性等作用对BRVO动物模型发挥治疗作用。MK2抑制剂PF-3644022可能是治疗BRVO的具有较高应用价值的药物。

