黑果枸杞原生质体培养及植株再生
宁晓春,高思丹,杨莉娜,陈生蓉,何 涛*
(1 青海大学 生态环境工程学院,西宁 810016;2 青海省园林植物与观赏园艺重点实验室,西宁 810016;3 省部共建三江源生态与高原农牧业国家重点实验室,西宁 810016;4 青海大学 农牧学院,西宁 810016)
黑果枸杞(Lyciumruthenicum),属茄科(Solanaceae)枸杞属(Lycium)植物,为多棘刺灌木,主要分布于西北荒漠地区,具有非常高的药用价值、营养价值及经济价值[1]。黑果枸杞是原花青素含量最高的天然野生果实,是最有效的原生态天然抗氧化剂[2]。果实成熟后呈紫黑色,藏药中称其为“旁玛”,可清心热,治疗妇科疾病[3]。黑果枸杞果实中氨基酸种类丰富,含有7种必需氨基酸[4],对降血脂[5]、降血糖[6]、抗氧化[7]、抗肿瘤等有一定的功效。黑果枸杞抗旱性、耐盐性较好,且高度耐贫瘠,可正常生长于沙地、盐碱地、荒漠化地区,对水土保持、防风固沙具有重大意义[8]。近年来,随着商业利益的驱动,野生黑果枸杞的生存空间受到严重威胁,野生资源远远满足不了市场需求。因此,众多学者利用人工种植、引种驯化、组织培养等方法对野生黑果枸杞的资源保护和品种改良展开研究[9-10]。
植物原生质体是去除了细胞壁的裸露细胞,在适宜培养条件下能够细胞壁再生、分裂分化从而发育成完整植株[11]。原生质体的分离和再生在植物遗传育种、遗传转化、性状改良、分子鉴定、基因重组等领域具有重要的意义[12-14]。目前这种技术手段已成功应用于蔷薇科(Rosaceae Juss.)、十字花科(Brassicaceae Burnett)、伞形科(Apiaceae)、豆科(Leguminosae sp.)、茄科(Solanaceae)等数十个科的植物中[15-19],宁夏枸杞(Lyciumbarbarum)原生质体的分离与再生已有报道[20],而与之同属的黑果枸杞原生质体再生尚未建立成熟的实验体系。
本研究以野生黑果枸杞无菌苗为外植体,以愈伤组织为游离材料,在获得高产量、高活力原生质体的基础上开展培养条件优化,并对分化得到的再生植株进行遗传稳定性分析。此研究为原生质体水平上枸杞的生理生化和基因转移创建了新的实验系统,为利用体细胞杂交技术转移野生植物抗逆遗传性状奠定基础,并为枸杞优良品种的选育提供材料。
1 材料和方法
1.1 实验材料
野生黑果枸杞(Lyciumruthenicum)采自青海省柴达木盆地都兰县。
1.2 实验方法
1.2.1 愈伤组织的诱导将野生黑果枸杞种子消毒,置于不含植物生长调节剂的MS培养基中萌发,待无菌苗生长30 d后,切取叶片、叶柄及茎段作为外植体,接种于含有不同浓度2,4-二氯苯氧乙酸(2,4-D)和6-苄氨基腺嘌呤(6-BA)的MS培养基中,于24 ℃、16 h光照/8 h黑暗光周期、2 000 Lx光照强度下培养,30 d后观察愈伤组织诱导情况。
1.2.2 原生质体的游离分别取3 g幼嫩叶片和愈伤组织(叶片、叶柄、茎段诱导得到)作为游离材料,置于10 mL酶液中(含1.5%纤维素酶,1%离析酶,0.5% 半纤维素酶,0.5 mol·L-1甘露醇,0.1% MES和0.05 mol·L-1CaCl2),在摇床上以70 r·min-1转速25 ℃黑暗处理11 h,用150目细胞网筛过滤,洗液(含0.5 mol·L-1甘露醇,0.1% MES和0.05 mol·L-1CaCl2)洗涤,18%蔗糖纯化,培养液洗涤并离心收集原生质体。
1.2.3 原生质体培养及植株再生将纯化后的原生质体密度调整至104~105个·g-1左右,使用液体浅层和固液双层两种方式培养,培养基选用MS1和MS2(表1);24 ℃黑暗静置培养,每2周添加1次新鲜培养基,待形成小愈伤组织后,转移至固体培养基中培养(先弱光后正常)。30 d后,将固体培养基上生长较好的愈伤组织,转移至含有不同浓度6-BA(0~2.0 mg·L-1)和IBA(0~0.2 mg·L-1)的MS分化培养基上,45 d后观察不定芽的形成情况。不定芽长至2 cm左右后,移入不含植物生长调节剂的MS培养基中进行生根培养。取根系生长健壮的再生苗炼苗1周,移栽至混有营养土和蛭石(2∶1)的基质中,30 d后观察再生植株生长情况。
1.2.4 再生植株遗传稳定性分析(1)流式细胞仪检测。参照高思丹等[21]的方法,以野生黑果枸杞亲本植株作为参照样本用于裂解和染色处理,植物倍性检测试剂盒购自上海月下生物科技中心,采用美国Beckman公司的Cytoflex LX流式细胞仪,激发波长为405 nm,检测结果用CytExpert软件分析。
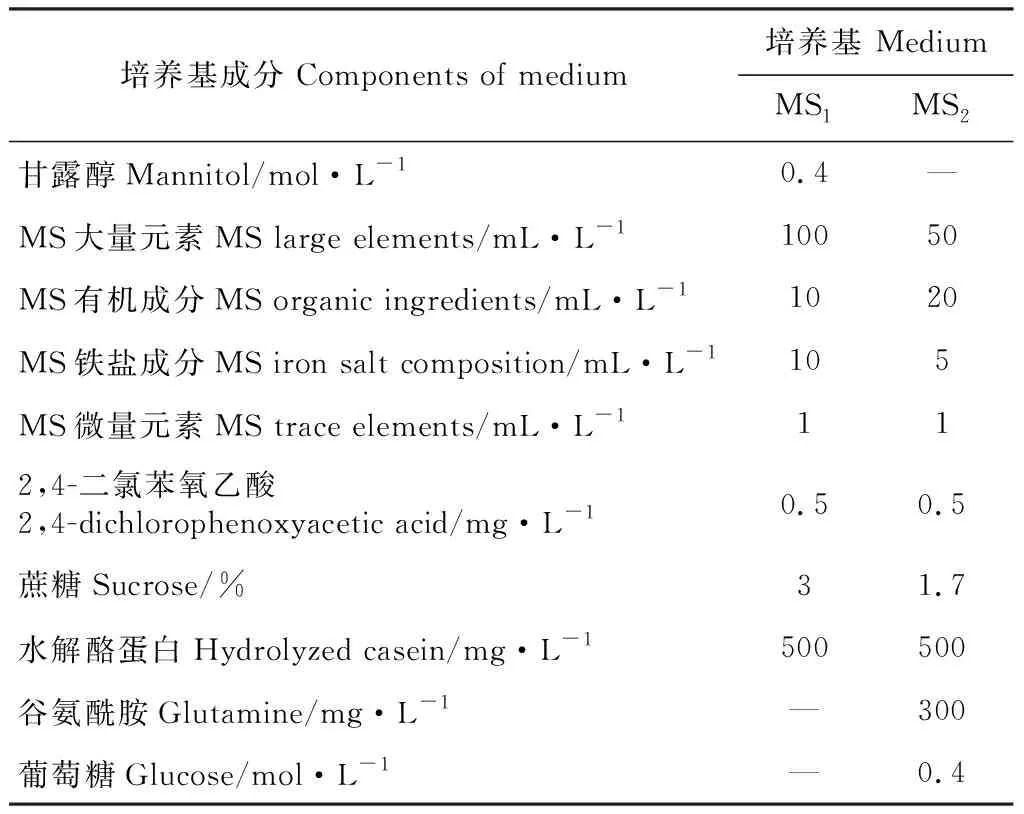
表1 原生质体培养所需培养基
(2)ISSR分子检测。以野生黑果枸杞亲本植株作为对照,随机选取6株原生质体再生植株进行ISSR分子检测。DNA提取采用CTAB法,引物UBC 824(TCTCTCTCTCTCTCTCG)和UBC 834(AG-AGAGAGAGAGAGAGYT)由上海生工生物工程有限公司合成,退火温度分别为48.4和48.7℃。PCR反应程序为:94 ℃预变性5 min,94 ℃变性45 s,退火45 s,72 ℃延伸2 min,36个循环,72 ℃延伸7 min。扩增产物在1×TAE配制的1.5%琼脂糖凝胶中进行电泳分离,电压150 V,时间60 min。电泳结束后用凝胶成像仪拍照并分析。
1.2.5 统计分析数据处理和分析采用Excel和SAS软件。
(1)原生质体活力检测使用荧光双醋酸酯(FDA)法。原生质体活力(%)=发黄绿色荧光原生质体数/视野中的原生质体总数×100%,原生质体产量(个·g-1)=(悬浮液中原生质体数/mL×总体积)/材料总鲜重(g)。
(2)倍性计算公式:待测样本倍性=参照样本倍性水平×(待测样本峰荧光均值/参照样本峰荧光均值)。
(3)ISSR只计算清晰稳定的条带,在同一迁移率位置有谱带记为“1”,无谱带记为“0”,记录谱带构建“0,1”矩阵。
GS=2Nij/(Ni+Nj)
GS为遗传相似系数,Nij为亲本植株和再生植株中相同条带数,Ni为亲本植株条带数,Nj为再生植株条带数。
2 结果与分析
2.1 不同外植体愈伤组织的诱导
叶片、叶柄和茎段3种外植体在含有单一2,4-D(0.5~1.5 mg·mL-1)的MS培养基上,均可诱导出愈伤组织(表2)。叶片外植体接种2~3 d后,外植体出现卷曲(图1,A2);15 d左右边缘膨大,在切口周围有愈伤组织产生(图1,A3);25 d后,形成大量黄绿色颗粒状愈伤组织,质地均一、松散(图1,A4)。叶柄及茎段外植体接种后,15 d左右外植体膨大;25 d后大量愈伤组织形成,颜色较叶片愈伤组织浅,质地较松散(图1,B4、C4)。
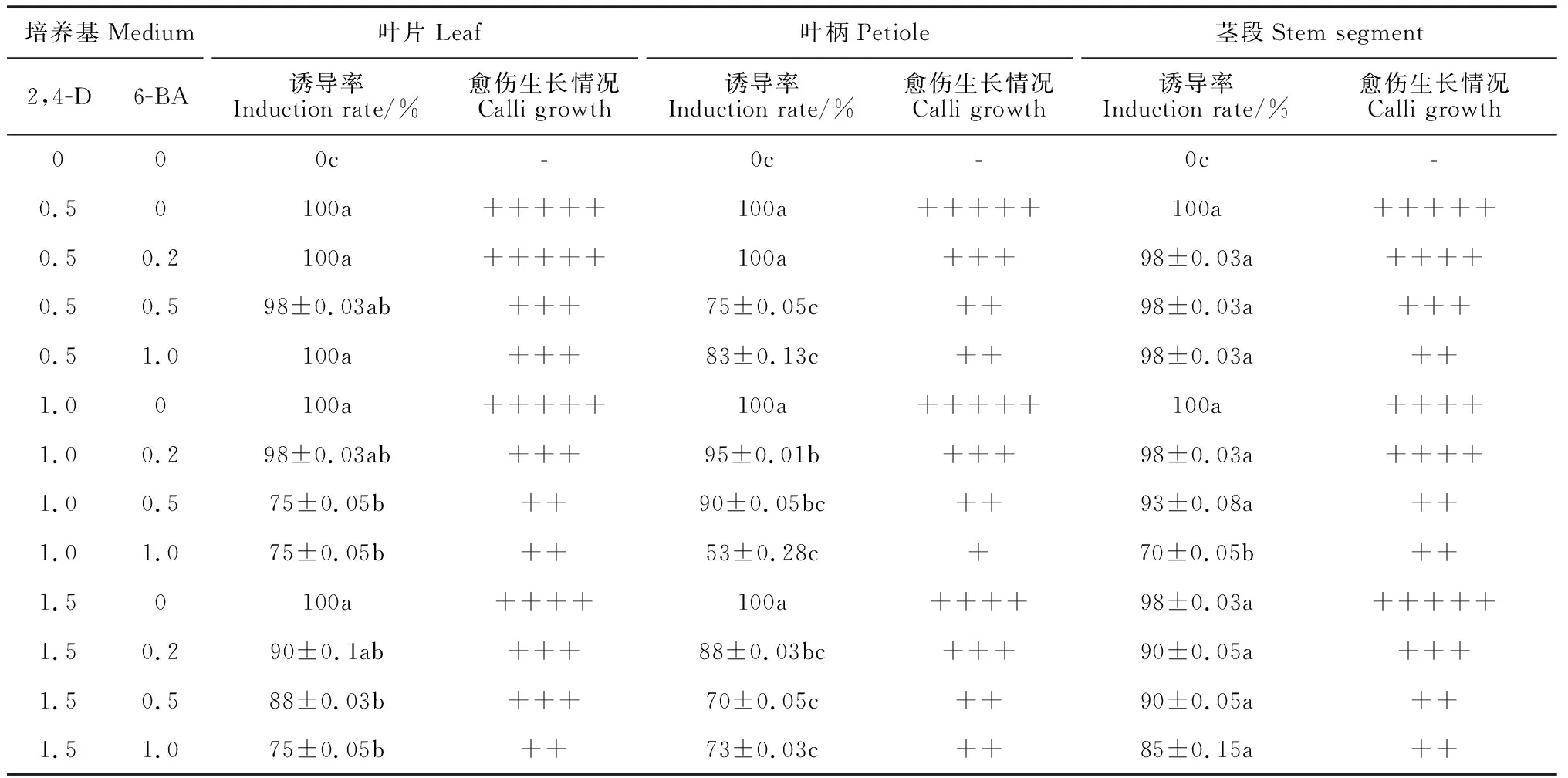
表2 不同外植体愈伤组织诱导率及生长情况
在含有2,4-D(0.5~1.5 mg·mL-1)的MS培养基中添加6-BA(0.2~1.0 mg·mL-1)后,愈伤组织的诱导率和生长情况不及只有单一2,4-D的MS培养基(表2)。在含有同一浓度2,4-D的培养基中,随着6-BA浓度的增加,愈伤组织的诱导率下降,这一现象在叶片、叶柄和茎段外植体中均存在。在含有6-BA的MS培养基中,诱导的愈伤组织少,颜色浅,生长缓慢,质地较软,有的褐变或水渍化(图1)。
综合比较,黑果枸杞叶片为诱导愈伤组织的最适外植体,含有0.5 mg·mL-12,4-D的MS培养基为诱导愈伤组织的最适培养基。在该培养条件下,愈伤组织的诱导率可达100%,愈伤组织呈黄绿色颗粒状,质地松散,生长迅速。
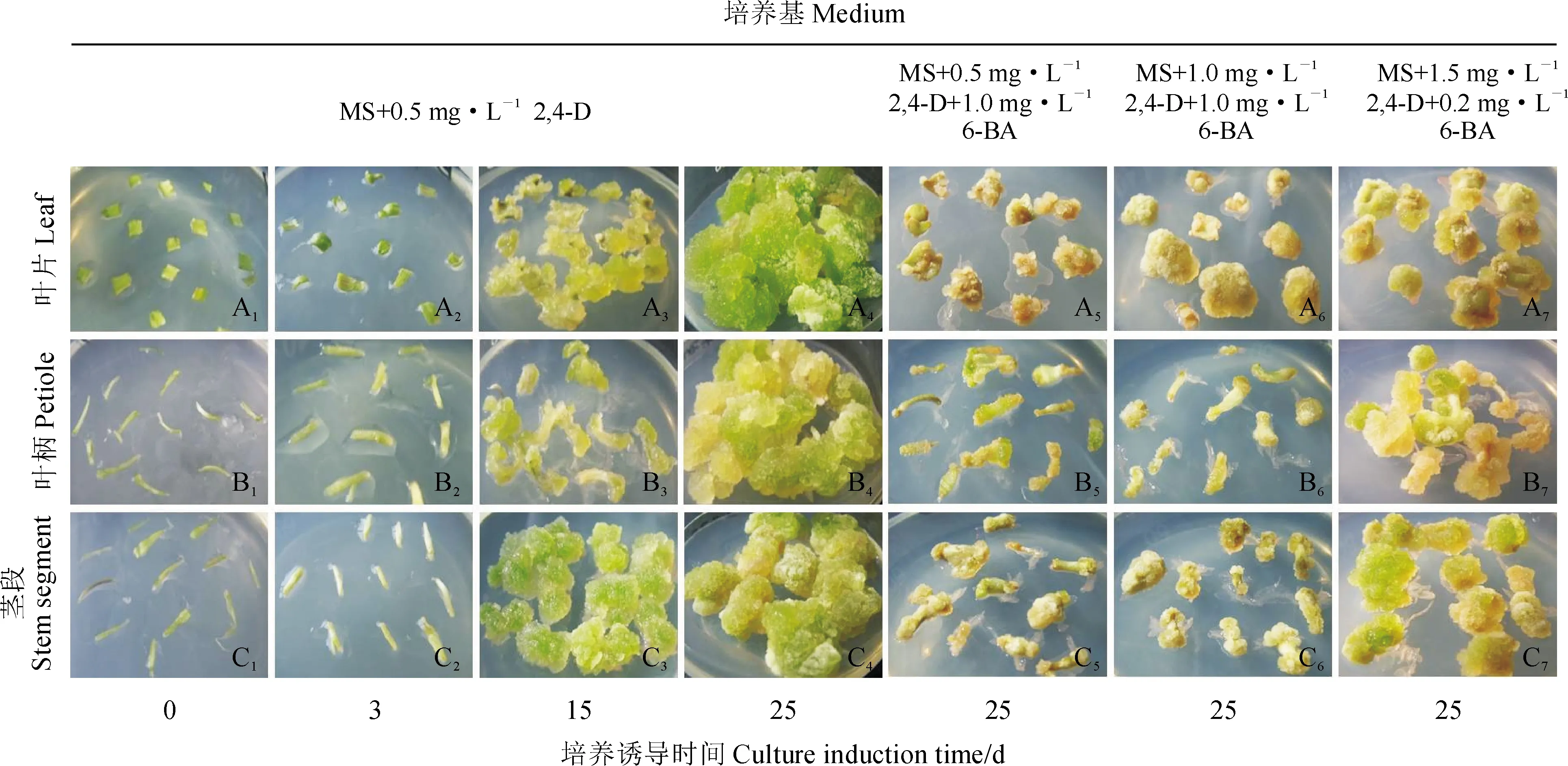
A1-A7. 叶片愈伤组织在不同培养基上处理不同天数;B1-B7. 叶柄愈伤组织在不同培养基上处理不同天数;C1-C7. 茎段愈伤组织在不同培养基上处理不同天数图1 黑果枸杞不同外植体在不同培养基上诱导的愈伤组织A1-A7. The leaf calli were treated on different media for different days;B1-B7. The petiole calli were treated on different media for different days;C1-C7. The stem segment calli were treated on different media for different daysFig.1 Calli induced from different explants of L. ruthenicum on different media
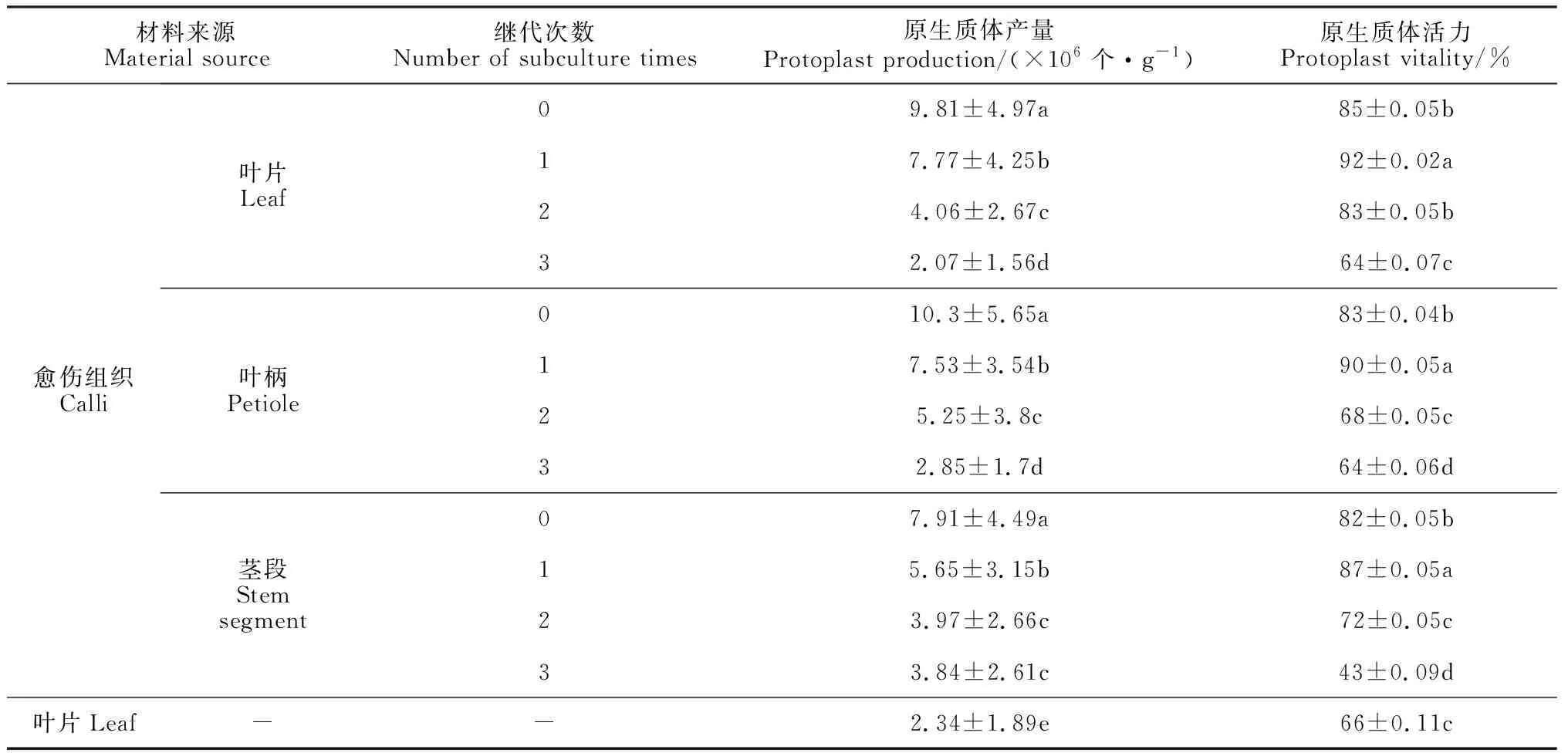
表3 不同外植体及不同继代次数愈伤组织的原生质体产量和活力
2.2 外植体来源及愈伤组织继代次数对原生质体游离的影响
在外植体来源上,用叶片和愈伤组织游离产生的原生质体存在显著差异(表3)。以叶片、叶柄、茎段的愈伤组织作为外植体,继代1次后产生的原生质体在产量和活力上均显著高于叶片,其中叶片愈伤组织原生质体产量和活力最高,分别为7.77×106个·g-1和92%;而直接用叶片游离产生的原生质体产量只有2.34×106个·g-1,活力为66%。
在愈伤组织继代上,叶片、叶柄、茎段的愈伤组织随着继代次数的增加,游离产生的原生质体产量和活力逐渐降低(表3)。继代1次的叶片愈伤组织游离产生的原生质体产量和活力分别为7.77×106个·g-1和92%;继代2次时,原生质体产量和活力分别下降为4.06×106个·g-1和83%;继代3次时,原生质体产量和活力分别下降到2.07×106个·g-1和64%。综合比较,继代1次的叶片愈伤组织是黑果枸杞原生质体游离的最适外植体。
2.3 不同甘露醇浓度对原生质体的影响
酶液中不同甘露醇浓度对原生质体产量和活力有显著影响(表4)。当甘露醇浓度较低时(0.3 mol·L-1),原生质体产量和活力均较低,分别只有1.44×106个·g-1和71%,且溶液中细胞团多、细胞碎片多,存在大量脱壁不全的原生质体。当甘露醇浓度为0.5 mol·L-1时,原生质体产量和活力最高,分别为7.77×106个·g-1和92%,游离产生的原生质体为规则的球形。
2.4 原生质体培养
在培养方式上,固液双层培养优于液体浅层培养(表5)。在相同培养方式下,不同培养基(MS1、MS2)产生的培养效果也不同(表5)。以固液双层培养为例,使用MS2培养基,2 d时出现第一次细胞分裂,培养10 d后的分裂频率为45.9%,培养20 d后形成细胞团的比例为22.9%;而使用MS1培养基,3 d时才出现第一次细胞分裂,培养10 d后的分裂频率为32.7%,培养20 d后形成细胞团的比例为25%。综合比较认为,MS2-固液双层培养适于黑果枸杞原生质体培养。在该培养方式下,培养第2天可观察到第1次细胞分裂(图2,D),5 d左右进行第二次细胞分裂(图2,E),接着开始第三次细胞分裂(图2,F),培养10 d时的分裂频率为45.9%,14 d左右形成细胞团(图2,G),培养20 d时形成细胞团的比例达到22.9%,此时可在培养皿中看到肉眼可见的小愈伤组织(图2,H)。
2.5 植株再生
将培养皿中的小愈伤组织转移至含有0.5 mg·mL-12,4-D的 MS固体培养基中(图2,I),约30 d后形成质地松散的黄绿色愈伤组织(图2,J);将长势较好的愈伤组织转移至含有1.5 mg·mL-16-BA和0.1 mg·mL-1IBA的MS分化培养基中,4周后愈伤组织分化出不定芽(图2,K);将不定芽转移至不含植物生长调节剂的MS固体培养基中(图2,L),10 d左右不定芽开始生根(图2,M);经炼苗后,将再生苗移栽至土壤基质中,再生苗可正常生长(图2,N)。
2.6 遗传稳定性分析
2.6.1 ISSR分子检测对琼脂糖凝胶电泳结果进行数据统计并分析。只对清晰条带进行统计,UBC824引物在黑果枸杞亲本植株和原生质体再生植株中共扩增出7条谱带,其中多态性谱带为2条(图3,A);UBC834引物在黑果枸杞亲本植株和原生质体再生植株中共扩增出9条谱带,多态性谱带有3条(图3,B)。经计算,6株再生植株与亲本植株之间的遗传相似系数在0.815~0.929之间,平均遗传相似系数为0.875,说明由原生质体培养获得的再生植株能较好地保持亲本的遗传性状。

表4 不同甘露醇浓度下原生质体的产量和活力
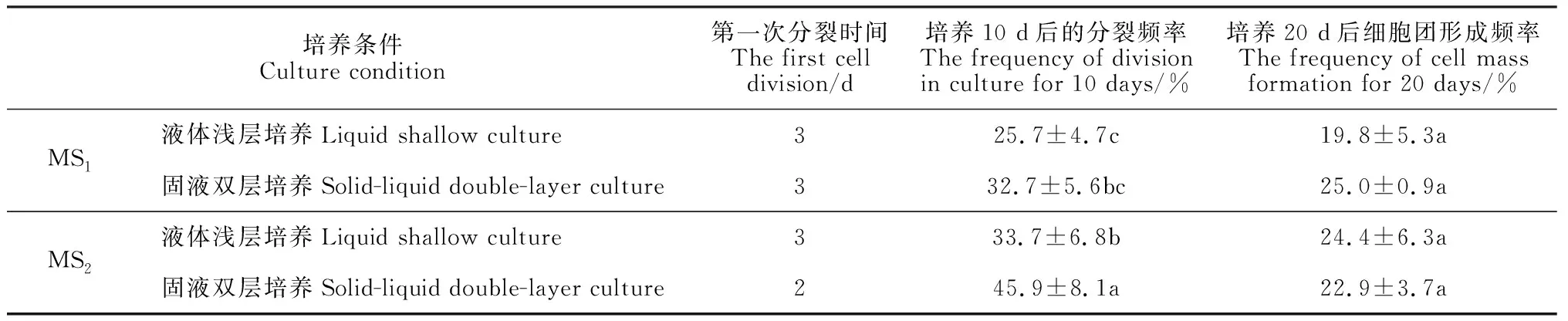
表5 不同培养条件原生质体培养
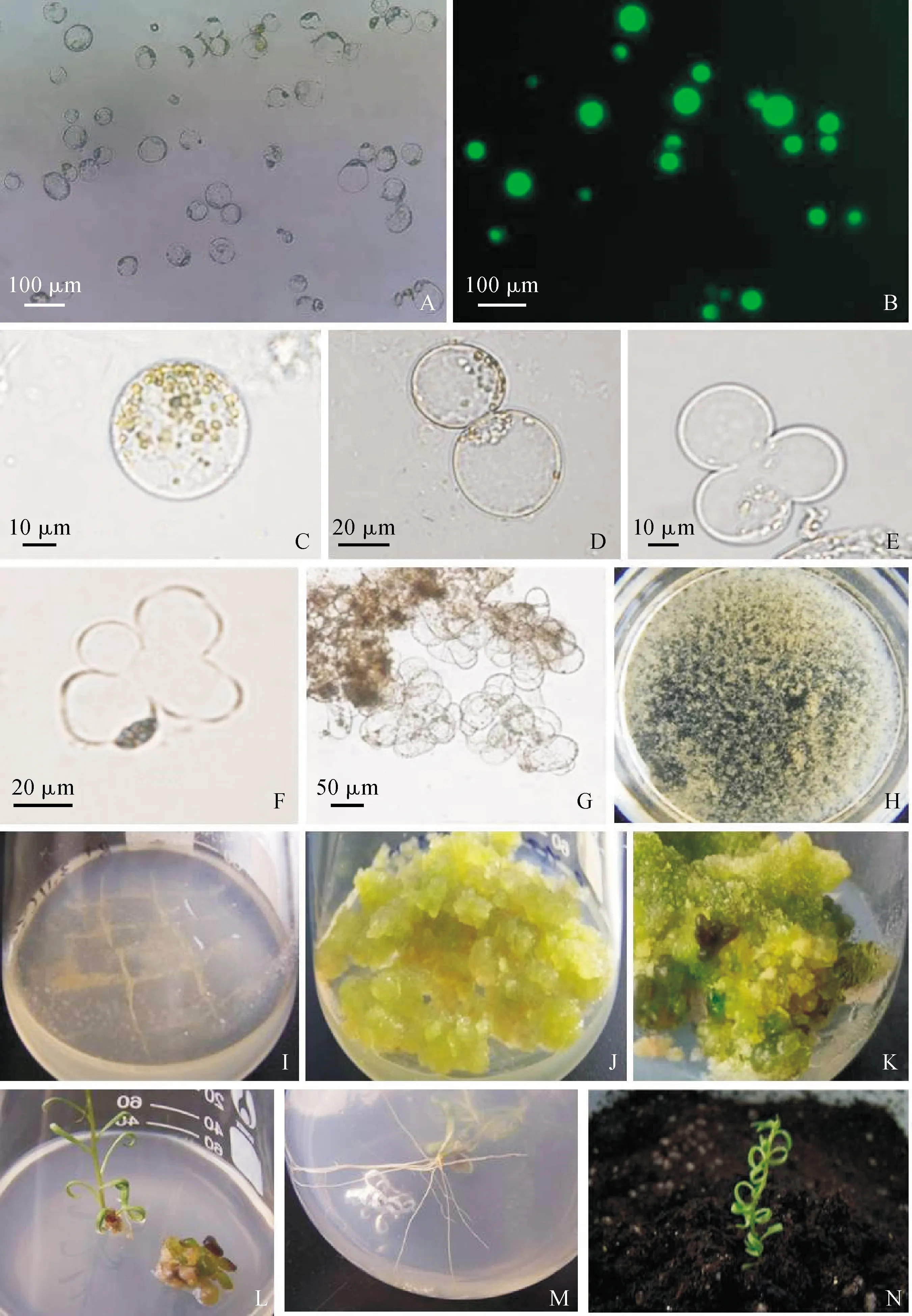
A. 黑果枸杞原生质体;B. FDA活力检测;C. 叶片愈伤组织游离的原生质体;D. 第一次细胞分裂;E. 第二次细胞分裂;F. 第三次细胞分裂;G. 细胞团的形成;H. 小愈伤组织的形成;I. 转移至固体培养基中的愈伤组织;J. 生长30 d的愈伤组织;K. 愈伤组织分化出不定芽;L. 原生质体再生植株;M. 再生植株生根;N. 移栽后正常生长的再生植株图2 黑果枸杞原生质体的培养A. Protoplast of L. ruthenicum;B. Viability of freshly isolated protoplasts stained by FDA;C. Protoplast derived from leaf calli;D. The first cell division;E. The second cell division;F. The third cell division;G. Microcolony formation;H. Micro-calli formation;I. Regenerating calli transferred to the solid medium;J. Regenerating calli grown for 30 days;K. Adventitious buds differentiated by regenerating calli;L. Complete regenerated plant from protoplasts;M. Rooting of regenerated plant;N. Regenerated plants normal grow after transplantingFig.2 Protoplast culture of L. ruthenicum

A. 引物UBC824;B.引物UBC834;M. DL5000;Q. 黑果枸杞(亲本植株);1-6. 由原生质体培养获得的再生植株图3 野生黑果枸杞ISSR检测结果A. Primer UBC824;B. Primer UBC834;M. DL5000;Q. L. ruthenicum (parent plant);1-6. Regenerated plant from protoplast cultureFig.3 ISSR results of L. ruthenicum
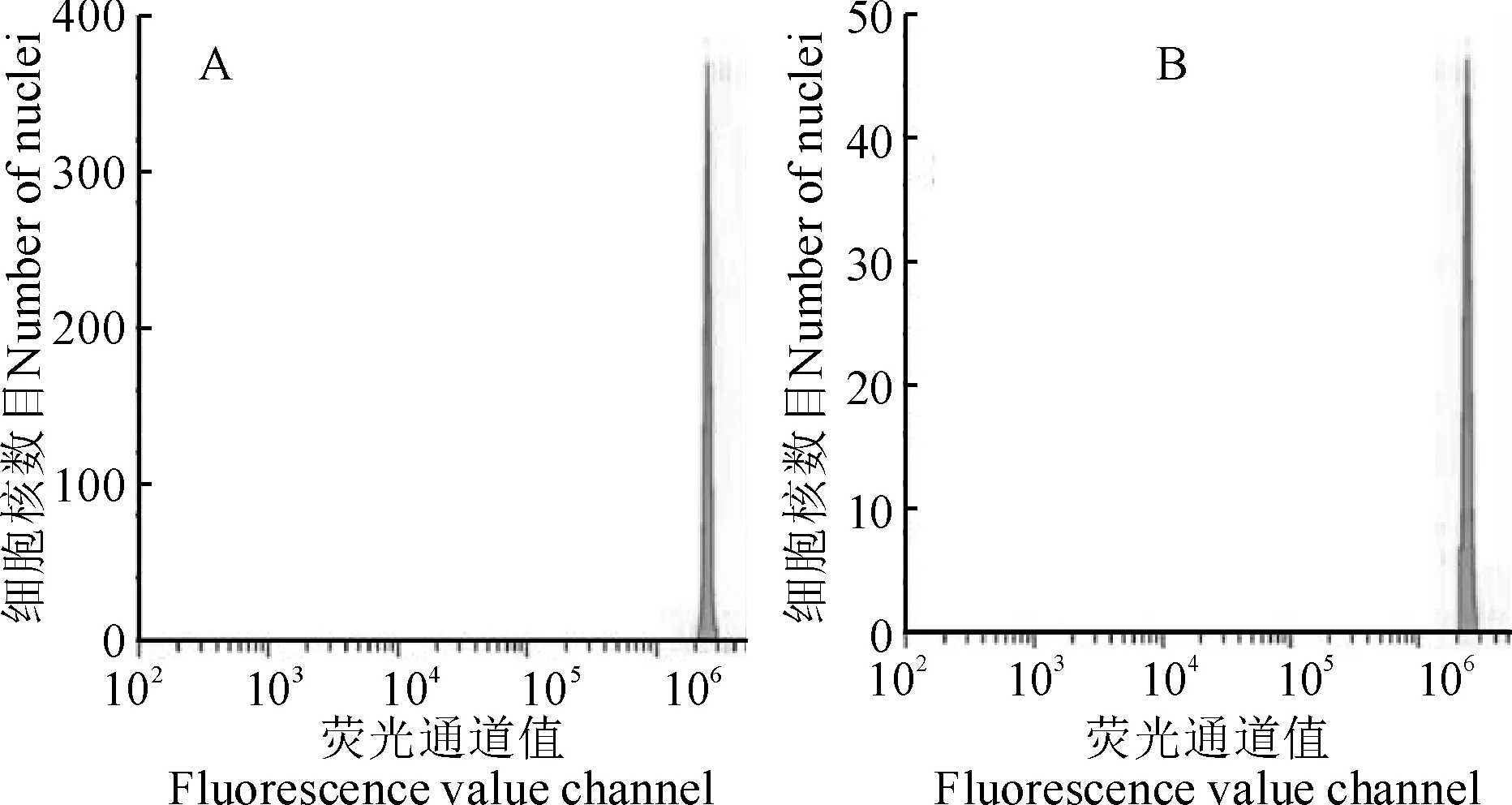
A. 亲本植株(参照样本);B. 原生质体再生植株图4 流式细胞仪检测结果A. Parental plant (control sample);B. Regenerated plant of L. ruthenicumFig.4 Flow cytometry test results
2.6.2 流式细胞检测根据流式细胞仪检测原理,峰的平均荧光强度可以反映细胞核中DNA总量的变化。结果显示,原生质体再生植株的荧光均值为2 294 178.3,变异系数为5.67;而亲本植株的荧光均值为2 387 634.8,变异系数为4.55。通过计算可知,原生质体再生植株为二倍体,与亲本植株相同,在倍性上没有发生改变(图4)。
3 讨 论
制备原生质体的材料来源是影响原生质体培养成功的关键因素。目前,悬浮培养或愈伤组织培养最为广泛,相比之下,愈伤组织是建立高效原生质体分离体系的必要条件,而悬浮培养具有较高的胚胎发生能力,是极好的原生质体来源,但实验条件要求严格,耗时耗力。Li等[22]首次成功建立油茶(Camelliaoleifera)悬浮培养的原生质体分离方法时是在高质量的愈伤组织基础上进行的,Taylor等[23]发现一些品种的悬浮培养周期甚至达到10~14周,而且并不一定会获得再生植株。本研究利用不同外植体诱导愈伤组织,在此基础上直接分离原生质体,既缩短了培养周期,也简便了培养方法,而且能获得高产高效的原生质体细胞,是一种更加快捷高效的培养体系。另外,较植物本身而言,叶片组织是能够释放大量原生质体的宝贵材料,在原生质体培养初期为细胞密度、再生愈伤组织形成等都具有一定的贡献。舒小娟等[24]分离葡萄(VitisviniferaL.cv.‘Heixiangjiao’)原生质体时发现叶片愈伤组织来源的原生质体产量和活力都较高;Chand等[25]分离龙葵(Solanumdulcamara)原生质体时也得出一致结论,并发现继代3次的叶片愈伤组织产量和活力最高;本研究对比了3种不同外植体的愈伤组织,同样发现叶片愈伤组织是分离优质原生质体的最佳材料来源,且继代1次后的叶片愈伤组织产量和活力最高,随着继代次数的增加,游离得到的原生质体产量和活力逐渐降低。因此,推测愈伤组织继代次数可影响原生质体产量和活力变化,未经继代的初始愈伤组织因存在外植体,其愈伤组织形态多变且稳定性较差,对原生质体纯化及培养形成干扰,初始愈伤组织经过1~3次继代后逐渐稳定,且指数生长期阶段的愈伤组织正处于细胞分裂旺盛期,选取该阶段愈伤组织可大大提高原生质体的产量和活力,但二者存在的正相关关系还有待进一步研究证明。
原生质体培养的另一个关键因素是培养方法与培养基的选择。Borgato等[26]发现利用液体浅层直接培养时,原生质体细胞壁无法再生和分裂。本研究发现液体浅层培养黑果枸杞原生质体时,细胞大多聚集于培养皿周围,细胞团形成率相对较低,且易褐化、易污染。Yang等[27]认为双层培养体系是棉原生质体培养的最佳方法。本研究以固液双层的培养方法,让原生质体在既含有液体培养基营养成分的同时又能吸收到固体培养基营养物质,同时又将次生代谢物被固体培养基所吸附,不仅迅速提高了原生质体第一次分裂时间,降低了褐化程度,而且增加了细胞的透气性,培养效果优于单一液体浅层培养的方式。培养基成分对原生质体培养时的细胞分裂水平起关键作用[28],决定了离体细胞能否持续分裂并生长[29]。Xu Ziqin等[30]发现无机盐浓度过高后原生质体在培养时出现严重褐变现象;Zhao Kongnan等[29]研究芸苔属(Brassica)原生质体时提出,添加过多氨基酸以及核苷酸等营养物质并不一定会引起原生质体的高频率分裂,反而容易引起褐变,因此认为改良MS培养基是大多数芸苔属原生质体培养的最佳培养基;本研究利用MS1和MS2培养基(表1)培养黑果枸杞原生质体时改变了培养基成分,适量添加谷氨酰胺、葡萄糖等成分参与蛋白质合成及细胞代谢,有效降低了原生质体褐化,但本研究发现经过培养的原生质体分裂率保持在最高水平的状态下时其细胞团形成率却呈现较低水平,这可能与MS2培养基中添加的成分有很大关系,猜测黑果枸杞原生质体第一次分裂时间、培养后的分裂率及细胞团形成率都可能受MS2培养基成分的影响。
植物由亲本到再生的整个过程中遗传的完整性也十分关键,微小的突变很可能造成植株的遗传变异[31]。Irene等[32]、Karp等[33]检测原生质体培养过程中各阶段DNA含量时发现愈伤增殖阶段、不定芽再生阶段均可能发生变异。本研究通过ISSR以及FCM技术分析再生植株时并未发现明显变异现象,再生植株在遗传相似系数以及倍性检测中均与亲本保持一致,但值得注意的是,高思丹等[21]研究黑果枸杞叶片再生植株时发现叶片再生植株与亲本植株在DNA总量上表现出差异,这一现象在本研究结果中也有体现,推测是造成ISSR条带部分增加或缺失的原因之一。植物体细胞发生变异一方面可培育产生新品种,另一方面为遗传稳定性研究增加困难。遗传稳定性研究常见的有ISSR、FCM等技术,ISSR技术在小麦(TriticumaestivumL.)、水稻(OryzasativaL.)、辣椒(CapsicumannuumL.)等多个品种的遗传鉴定中都发挥出重要作用[34],FCM技术可清楚地体现亲本植株与再生植株之间遗传倍性的稳定性水平,可靠且快速,Jedrzejczyk等[35]、Faisal等[36]在鉴定遗传稳定性时都用到该方法。本研究以这两种为主要鉴定方法,发现黑果枸杞再生植株与亲本植株之间有不明显差异,再生植株由原生质体生长为完整植株的过程中,需经过细胞培养、愈伤形成以及不定芽产生等,这一系列过程都需要激素诱导,上述提到细胞在愈伤增殖阶段以及不定芽再生阶段都可能发生变异,因此产生这一结果可能的原因有多种,是植物激素的相互作用还是培养过程中植株本身存在的变异,需要利用细胞、分子等手段进一步研究。

