基于网络药理学及分子对接技术研究人参治疗非小细胞肺癌的潜在分子机制
王小龙,张春晶*,于海涛,孙晓杰,李林,赵正林,李淑艳,彭瑶,刘冬阳
(1.齐齐哈尔医学院医学技术学院,黑龙江 齐齐哈尔 161006;2.齐齐哈尔医学院研究生处,黑龙江 齐齐哈尔161006;3.黑龙江中医药大学,黑龙江 哈尔滨 150040)
0 引言
肺癌是世界范围内最常见的恶性肿瘤,随着空气污染日益加重,烟草流行以及老龄化等因素的影响,肺癌的发病率和死亡率越来越高。据国家卫生健康委报道,2015年我国新发肺癌病例73.33万,居恶性肿瘤首位,成为30年来发生率增长最快的恶性肿瘤[1]。从病理和治疗角度,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占80%~85%。对于NSCLC的主要治疗手段为手术、化疗、放疗、分子靶向治疗和免疫治疗等方法,但这些方法均具有一定的局限性,如不良反应大、价格高昂、对患者体力要求较高、且严重影响患者的生活质量。
中药治疗肿瘤在我国有着悠久的历史,在中医药治疗癌症的临床应用中,发现中医药具有很大的优势,特别是在抑制和杀死肿瘤细胞,减少对放疗和化疗的不良反应,提高患者的生活质量和免疫力,减轻临床症状,减少副作用等方面[2]优势显著,而且药食同源类中药具有安全性高、副反应小、可作为辅助疗法参与肺癌患者治疗,且疗效显著[3,4]。人参(Panax ginseng C.A.Meyer),微苦,性甘,作为我国名贵中药材之一,号称“百草之王”[5],富含人参皂苷、人参多糖、挥发油等成分,具有多种药理活性而且临床上被广泛应用于癌症等多种疾病的治疗[6-9],如人参多糖注射液、益肺散结方辅助治疗晚期NSCLC,能降低化疗不良反应,提高化疗效果,改善免疫功能,延长患者生存时间[10-12]。而人参从整体网络层次治疗肺癌的整体药效活性成分及其作用机制研究尚不明确。
网络药理学是一门基于药理学,系统生物学,生物信息学,计算科学等学科的跨学科科学,能够从整体角度分析药物对生物体或细胞的作用机制、探寻药物的多靶点作用以及指导开发设计新药[13]。网络药理学应用于我国传统中药研究,可从系统水平和分子水平揭示中药与疾病的关联性,即多分子、多靶点、多途径的分子机制,促进中药研究的发展[14]。药物活性物质与目标靶蛋白分子的间的相互作用的结合模式和亲和力可以运用分子对接(molecular docking)模拟进行验证[15]。本研究将运用网络药理学和分子对接技术研究人参在治疗非小细胞肺癌的作用机制、为开发人参抗肿瘤产品提供了科学依据。
1 材料与方法
1.1 人参药效成分和作用靶点收集
从中药系统药理学数据库和分析平台(TCMSP,https://tcmspw.com/tcmsp.php)以“renshen”人 参 为 检 索 词,Ingredients 参数设置:口服生物利用度(Oral bioavailability,OB)OB≥30%,类 药 性(Drug-likeness)DL≥0.18,其 余参数设置为默认值,筛选人参的药效成分及其靶点信息。同时结合中药分子机制在线生物信息学分析工具(BATMAN,http://bionet.ncpsb.org/batman-tcm/)数据库和文献补充相关化学成分及靶点信息。
1.2 非小细胞肺癌相关靶点收集
利用DisGenet(https://www.disgenet.org/),GeneCards (https://www.genecards.org/)和OMIM(https://omim.org)数据库,以“Non-Small cell lung cancer”为检索词,去除重复靶点,筛选非小细胞肺癌相关疾病靶点。
1.3 构建药物-疾病靶点网络
人参药效成分靶点与非小细胞肺癌相关靶点进行交集,获得人参治疗非小细胞肺癌的潜在作用靶点。利用Cytoscape 3.8.1软件构建疾病-化合物-疾病靶点网络模型,并利用软件中的network analyzer功能计算节点的度值(Degree)、紧密中心性( closeness centrality, CC)和介度中心性(betweenness centrality,BC),筛选出degree的中位数2倍值、且满足大于BC中位数和CC 中位数的药物活性成分和靶蛋白分子作为人参治疗NSCLC的关键化合物和靶点。
1.4 GO功能富集和KEGG通路富集分析
利用STRING数据库对潜在作用靶点进行GO功能富集分析和KEGG通路富集分析,物种设置为:Homo sapiens,P<0.05,利用R语言软件包ggplot2绘制柱状图和KEGG通路气泡图。
1.5 人参活性成分和作用靶点分子对接验证
选取KEGG通路中关键的靶点蛋白,同时结合疾病-化合物-疾病靶点网络模型中degree值较高的人参活性成分和靶点,筛选出人参活性成分和靶点蛋白分子进行分子对接分析。根据Pubchem数据库获得人参活性成分的分子结构,从PDB数据库中获得关键作用靶点分子结构信息,利用软件Autodock vina 1.1.2进行分子对接分析,计算出活性成分与靶蛋白的最小结合能,并利用PyMol软件进行可视化。
2 结果
2.1 人参药效成分和作用靶点收集
经数据库检索获得190个药效成分,相关作用靶点748个。经筛选获得符合条件的22个有效成分(表1),其中包含人参二醇、人参皂苷Rh2、人参皂苷Rh4、人参皂苷Rg5、苯代南蛇碱、灌木远志酮A、β-谷甾醇等,其中对应的靶点111个。
2.2 基本靶点的筛选
利用DisGenet和GeneCards对非小细胞肺癌相关靶点进行筛选,共获得靶点2895个,并将其与111个药物作用靶点取交集后,共获得药物成分-疾病共同潜在靶点63个,其中包括参与细胞凋亡相关的半胱氨酸天冬氨酸蛋白酶(CASP1,CASP3,CASP8,CASP9)、凋亡调控因子Bcl-2(BCL2)、凋亡调控因子Bax(BAX)、细胞程序性死亡相关丝裂原活化蛋白激酶8(MAPK8)、血管内皮生长因子受体(KDR)、转录因子AP-1(JUN)、转录因子P65(RELA)、细胞周期依赖性蛋白激酶1(CDK1)、细胞色素P450家族(CYP3A4,CYP1A1,CYP1A2,CYP1B1)、谷胱甘肽s-转移酶1(GSTM1)等。
2.3 药物-化合物-疾病靶点网络
利用Cytoscape软件将人参有效成分化合物、非小细胞肺癌、疾病与药物共有潜在作用靶点数据计算拓扑学参数,其中度值越大,则通过该靶点治疗非小细胞肺癌的可能性就越大,构建人参有效成分-非小细胞肺癌-潜在作用靶点的网络图,如图1所示。63个潜在作用靶点与人参中17种药效成分存在相关性,经拓扑分析,其degree中位数2倍值为10,BC 中位数为0.000129803, CC 中位数为 0.509433962,共有11个化合物和14个靶点满足筛选要求。
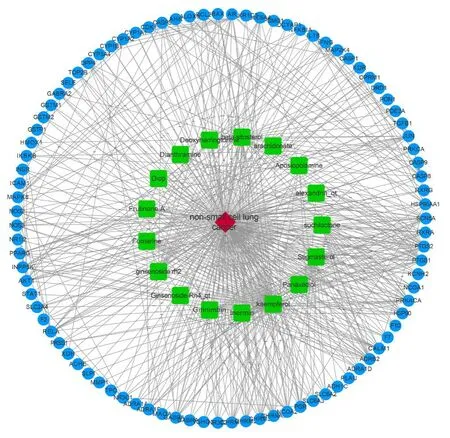
图1 关键药效成分-基因靶点网络
2.4 GO功能富集和KEGG通路富集分析
对63个人参治疗非小细胞肺癌潜在作用靶点导入STRING数据库分别进行GO和KEGG富集分析,结果如图2、图3所示。其中GO富集分析中,共发现888个生物过程,主要涉及细胞对化学物质刺激的反应、对有机物反应、对凋亡过程的调控等生物学过程;分子功能方面共发现96个相关分子功能,主要包括酶结合、蛋白质结合、氧化还原酶活性、细胞凋亡过程中的半胱氨酸型内肽酶活性、谷胱甘肽结合等功能;细胞成分方面共发现26个,主要有膜筏、胞液、质膜穴样内陷、线粒体、内膜系统、死亡诱导信号复合体等。KEGG通路富集共获得137条通路可能与人参活性成分治疗非小细胞肺癌相关,主要包括癌症通路、TNF信号通路、IL-17信号通路、铂耐药、细胞凋亡、NF-κB信号通路、MAPK信号通路、cAMP信号通路、p53信号通路等代谢通路。
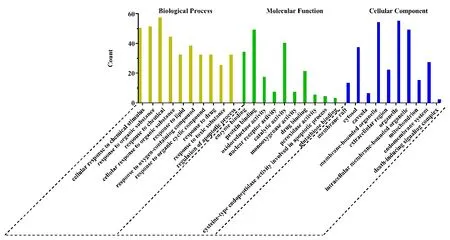
图2 GO富集分析
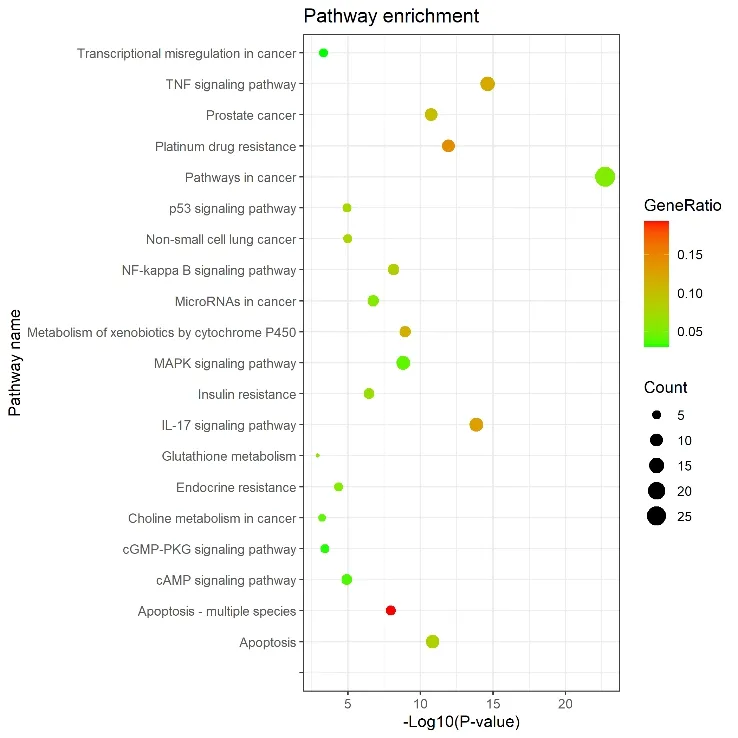
图3 KEGG通路富集分析
2.5 分子对接
结合KEGG通路、疾病-化合物-疾病靶点网络模型共筛选出关键人参活性物质11个,关键靶蛋白分子14个,对其进行分子对接,计算出活性成分与靶蛋白的最小结合能如表2所示。所有分子和化合物的结合能均低于-5.0 kcal/mol,表明所筛选的药物活性成分与关键目标靶蛋白分子具有较好的结合活性。其中靶点PTGS2、ADRB2、PRKACA、RELA、AKT1、CASP3等与多种化合物的结合能小于-9.0 kcal/mol,表明人参的多种活性成分可能通过作用于这些靶点参与非小细胞肺癌的治疗。
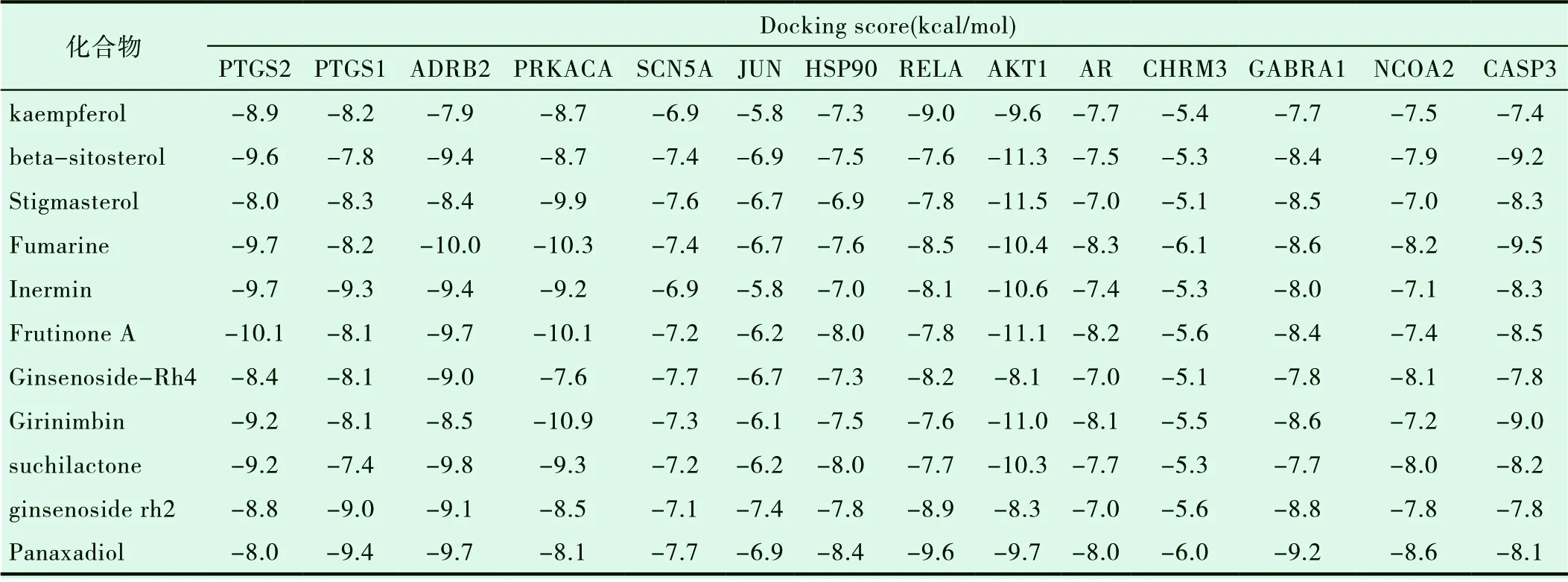
表2 分子对接结果
3 讨论
人参富含多种药效成分,如人参皂苷、多糖、挥发油(萜类、醇类、脂肪酸类等)、氨基酸、多种维生素等[16]。对人参抗肿瘤的药理作用研究发现,其发挥作用的主要药理活性成分为人参皂苷及其代谢产物、人参多糖和人参炔醇等[8]。研究发现人参皂苷Rh2抑制PI3K/AKT/GSK-3β通路,激活p53信号通路,激活caspase-3,诱导结肠癌细胞凋亡[17],人参皂苷Rh2通过抑制Wnt/β-catenin信号通路活性以及线粒体信号通路抑制肺癌A549细胞增殖并诱导其凋亡[18,19]。原人参二醇可抑制血管紧张素II刺激人非小细胞肺癌A549细胞分泌TGF-β1,下调SIRT1,从而抑制上皮间质转化,而发挥抗迁移及抗转移作用[20]。β-谷甾醇可诱导A549细胞和人肝癌细胞SMMC-7721于G2/M期细胞周期阻滞,而豆甾醇则可诱导肝癌细胞同时在S期和G2/M期阻滞并引起细胞凋亡[21,22]。山奈酚可以通过上调p53、Bax的表达水平,降低Bcl-2的表达水平,并促进细胞阻滞于S期及G2/M期,诱导人肺癌H446细胞株凋亡[23],能够通过调控miR21/PTEN/AKT信号通路抑制A549细胞增殖[24]。本文筛选出的人参治疗NSCLC的靶点也包含细胞凋亡相关的半胱氨酸天冬氨酸蛋白酶(CASP1,CASP3,CASP8,CASP9)、凋亡调控因子Bcl-2(BCL2)、凋亡调控因子Bax(BAX),与筛选的人参活性成分单体治疗NSCLC机制一致。江冠铭等[25]研究发现人参皂苷Rg3联合奥希替尼治疗一代EGFR-TKI耐药型晚期NSCLC患者的疗效确切,其机制可能是人参皂苷Rg3改善肿瘤微环境,下调TGF-α、TGF-β1和VEGF水平,促使肿瘤细胞凋亡,起到减毒增效的作用。人参皂苷Rh2通过调控JNK/MAPK通路,激活NF-κB和AP-1转录活性,上调转录因子AP-1的磷酸化水平,激活I-κB/NF-κB信号通路促进NF-κB核转位,并上调转录因子NF-κB和AP-1共同的靶基因凋亡相关细胞因子TNF-α的mRNA表达,调节膜受体通路(Caspase-8)和/或自噬相关基因Beclin 1表达,下调转录因子E2F1和c-Myc以及G1/S的调控点重要正性调控因子细胞周期蛋白CyclinD1和周期蛋白依赖性蛋白激酶CDK4蛋白表达水平,从而发挥抑制肿瘤细胞增殖、促进肿瘤细胞凋亡的生物学功能[26]。
经网络药理学和分子对接研究发现,人参通过人参皂苷类化合物、黄酮类物质、生物碱类物质作用于前列腺素G/H合酶(PTGS1, PTGS2)、蛋白激酶C(PRKCA)、转录因子p65(RELA)、转录因子AP-1(JUN)、热休克蛋白(HSP90)等多个蛋白质靶点,参与癌症通路、TNF信号通路、IL-17信号通路、NF-κB信号通路、MAPK信号通路、铂耐药、细胞凋亡等多条通路发挥治疗NSCLC的作用。体现了中药的多组分、多环节、多靶点的整体作用特点,为人参在治疗NSCLC上的开发利用提供了科学依据。

