耐硒菌株Lysinibacillus fusiformis D1的鉴定及清除自由基能力研究
段玉桦,余雍和,杨锐,王一丹,周欣,王璋倩
1(武汉轻工大学 生命科学与技术学院,湖北 武汉,430023)2(武汉轻工大学 硒科学与工程现代产业学院,湖北 武汉,430040) 3(武汉轻工大学,国家富硒农产品加工技术研发专业中心,湖北 武汉,430040)
硒是人和动物必需的微量元素,硒与人类和动物正常机体代谢和健康密切相关。微量的硒具有较强的生物活性,是很好的抗氧化剂[1],有抗肿瘤[2]、防衰老和增强机体免疫力等多种功能[3]。人体不能合成硒,其摄入途径主要是通过食用来自富硒土壤的作物。土壤环境中硒含量异常会引起人类的地方性疾病。硒在生物活性和毒性之间范围非常狭窄,容易进入硒的毒性范围[4]。20世纪60年代初在湖北恩施,发现人们食用了高硒土壤上生长的蔬菜后出现脱发,掉指甲,皮肤损坏等硒中毒症状[5]。
土壤硒污染会给当地的人和动物带来重大伤害。采用传统的土壤污染治理方法成本高、效果差,而近年来兴起的生物修复技术是治理土壤硒污染的既有效又经济的方法[6-7]。硒在土壤中按形态主要分为元素硒、硒化物、有机硒、亚硒酸盐和硒酸盐。土壤中无机硒的毒性要大于有机硒及纳米硒。土壤硒污染生物修复可以借助微生物自身作用分解土壤中的有毒无机硒,转化得到的纳米硒比无机硒或有机硒更能被生物有效利用,近年来使用纳米硒处理的植物有银杏[8]、小麦和水稻[9]等,使用生物纳米硒处理银杏幼苗,银杏叶叶绿素、可溶性糖和总黄酮醇苷含量大幅提高,产量和品质均有提升[8],现阶段耐硒菌株耐受能力普遍在0~20 mg/mL[10-11],因此筛选高耐硒并能转化无机硒为生物纳米硒的微生物具有广阔前景。
近年来,环境持久性自由基(environmental persistent free radicals, EPFRs)因具有环境毒性而受到广泛关注,EPFRs的潜在危害主要归因于其在环境中诱导产生活性的次生自由基如羟自由基等,可攻击细胞膜、脂质蛋白、DNA等,造成氧化损伤。LIAO等[12]研究表明持久性自由基具有抑制多种作物发芽率、质膜损伤等现象。因此在处理土壤污染的时候要充分考虑到存在EPFRs,对EPFRs的清除可以通过清除过程中的次生自由基中间体的方法,研究土壤中微生物是否具有清除自由基能力,对修复环境、人类健康具有重要的意义。因此本文也对筛选得到耐硒菌株所制备的纳米硒(nano-Se,SeNPs)以及次生代谢产物在体外清除自由基能力进行初步研究。
1 材料与方法
1.1 实验材料
2020年9月在江汉平原富硒带(湖北武汉东西湖区)采集土壤深度10 cm以下的土样。
1.2 试剂
酵母抽提物、蛋白胨,OXIOD;琼脂粉,Biosharp;亚硒酸钠,Sigma;DPPH,Phygene;ABTS底物,BOSF;水杨酸,SCR;FeSO4,天津永晟精细化工。
1.3 仪器与设备
FA-45-12-17Eppendorf 离心机,德国艾本德公司;BXM-30R立式压力蒸气灭菌器,上海博迅实业有限公司;725G紫外可见分光光度计,Biobase。
1.4 耐硒菌株分离与筛选
1.4.1 菌株分离
将采集土样颗粒均匀分散到LB固体培养基上,37 ℃培养。次日将单菌落转接。
1.4.2 耐硒能力筛选
1.4.2.1 初筛
从上述分离的单菌落分别接种到含9、17、26、35、43、52 mg/mL亚硒酸钠的LB平板中。根据平板是否出现微红至深红色菌落,挑选能产生深红色菌落的菌株进行复筛。
1.4.2.2 复筛
将初筛后的不同菌株种子液分别接种于含9、17、26、35、43、52 mg/mL亚硒酸钠的LB液体培养基中。37 ℃恒温振荡培养,观察液体颜色是否转变为微红至深红色,挑选能转变为深红色时亚硒酸钠浓度最高的菌株。
1.5 耐硒菌株D1鉴定
1.5.1 D1菌株形态学鉴定
将D1接种到LB平板上,37 ℃培养24 h后观察并记录菌落形态;进行革兰氏染色,在×100进行显微观察菌体形态。
1.5.2 D1菌株生理生化鉴定
生理生化实验分别从细菌的氧化酶实验、V-P实验、吲哚实验、明胶液化实验、碳源利用情况等几个方面进行。该实验参考《常用细菌系统鉴定手册》[13]。
1.5.3 D1菌株16S rRNA序列测定和系统发育树构建
提取D1菌株的DNA送至上海生工生物工程股份有限公司进行16S rRNA序列测定。将测序所得序列通过BLAST软件在GenBank基因库中进行同源性比较,应用Clustal X和MEGA软件进行多重比较后构建系统发育树。
1.6 D1菌株生长动力学实验
菌株D1种子液按1%的接种量分别接种于含0、9、17、26 mg/mL亚硒酸钠的LB液体培养基中,37 ℃恒温振荡培养。每隔2 h进行取样。将上述取出的菌液,以灭菌水作为对照,测定OD600nm值,绘制生长曲线。
1.7 SeNPs及次生代谢产物的制备
1.7.1 纳米硒纯化
将活化好的D1菌株接种于含9 mg/mL亚硒酸钠的LB培养基中,连续摇培48 h。收集红色菌液,9 000 r/min,离心20 min,收集沉淀。沉淀用液氮研磨,超声,将红色悬液分别过20、10、5、3、1.2、0.8 μm的滤膜,将过滤后红色悬液用正己烷充分萃取,收集下层,10 000 r/min离心10 min,收集沉淀即为产品,烘干称重[14]。
1.7.2 菌株次生代谢产物的收集
将D1菌株接种于LB培养基中,连续摇培48 h。将上述培养液8 000 r/min离心10 min,收集上清液。用等体积的乙酸乙酯萃取,收集乙酸乙酯层并干燥称重。
1.8 D1菌株制备的纳米硒表征
将分离纯化的纳米硒通过动态光散射法(dynamic light scattering,DLS)对粒径进行测定。
1.9 D1菌株的清除自由基能力测定
1.9.1 供试品的制备
取适量纯化后的纳米硒,超纯水溶解,配制为10 mg/mL的样品母液。取适量D1菌株的乙酸乙酯萃取物,无水乙醇溶解,配制为10 mg/mL的样品母液。并将样品母液逐级稀释成质量浓度为15、30、75、150、745、1 045 μg/mL的样品溶液备用。
1.9.2 DPPH自由基清除率的测定
参考都鹏程等[15]的方法稍作修改。利用无水乙醇配制浓度为0.25 mmol/L的DPPH溶液。吸取DPPH溶液600 μL,加入不同浓度的纳米硒及次生代谢物样品溶液70 μL,于暗处反应30 min,测定OD517nm值,计算如公式(1)所示:
(1)
式中:DC,DPPH自由基清除率,%;As,样品与DPPH溶液混合后的吸光值;Ac,样品与无水乙醇混合后的吸光值;Ab,DPPH溶液与水混合后的吸光值。
1.9.3 ABTS阳离子自由基清除率的测定
配制7.4 mol/L ABTS溶液以及2.6 mmol/L过硫酸钾溶液,等比混合,室温避光反应12 h,用无水乙醇溶液稀释至OD734nm值为0.75,即为ABTS工作液。吸取ABTS工作液600 μL,加入不同浓度的纳米硒及次生代谢物样品溶液70 μL,于37 ℃恒温反应30 min,测定OD734nm值,计算如公式(2)所示:
(2)
式中:DC,ABTS阳离子自由基清除率,%;As,样品与ABTS工作液混合后的吸光值;Ac,样品与水混合后的吸光值;Ab,ABTS工作液与水混合后的吸光值。
1.9.4 羟自由基清除率的测定
参考范三红等[16]方法稍作修改,在试管中依次加入9 mmol/L FeSO4溶液200 μL、9 mmol/L水杨酸-乙醇溶液200 μL,不同浓度的纳米硒及次生代谢物样品溶液70 μL,再加入30%(体积分数)的H2O2溶液200 μL,静置30 min,测定OD510nm值,计算如公式(3)所示:
(3)
式中:DC,羟自由基清除率,%;As,样品与羟自由基的反应体系混合后的吸光值;Ac,样品与水混合后的吸光值;Ab,羟自由基的反应体系与水混合后的吸光值。
2 结果与分析
2.1 耐硒菌株分离与筛选
2.1.1 菌株分离
从江汉平原富硒带土壤样品中共分离到具有不同菌落特征的微生物菌株85株。
2.1.2 耐硒能力筛选
2.1.2.1 初筛
经过加硒浓度递增筛选,能够在硒质量浓度43 mg/mL的LB固体培养基上生长较好的菌株有6株,分别命名为D1、R16、D131、ESW18、ESD9、ESD14。这些菌株均能将亚硒酸钠还原成红色单质硒,在含硒平板上呈现红色菌落(图1)。

图1 D1菌株在含硒平板红色菌落形态Fig.1 Red-colored colonies of the D1 on agar plates that containing Na2SeO3
2.1.2.2 复筛
将初筛后的菌株活化后经耐硒液体浓度梯度筛选,比较菌株在富硒培养液中产生的颜色变化,如表1所示,筛选1株耐硒能力最强的菌株,该菌株编号为D1。该菌株对亚硒酸钠的耐受范围为0~35 mg/mL。

表1 不同菌株在含硒LB液体培养基中的颜色变化Table 1 Color changes of different strains in LB broth containing selenite
2.2 耐硒菌株D1鉴定
2.2.1 D1菌株形态学鉴定
D1菌株菌落形态如图2-a所示。菌株D1生长良好,菌落为圆形,中间有凸起,边缘不光滑,黏稠不透明,白色。菌株D1革兰氏染色后镜检结果如图2-b所示,其细胞呈杆状,两端椭圆形,芽胞端生,卵圆形。

a-菌落形态;b-革兰氏染色图2 D1菌株菌落形态及革兰氏染色Fig.2 Colony morphology and gram staining of the Dl
2.2.2 菌株生理生化鉴定
由表2可知,菌株D1的已测特征与Lysinibacillusfusiformis菌株的主要特征基本一致,可从其形态特征和生理生化特征初步判断该菌属于Lysinibacillus属。

表2 D1菌株与纺锤形赖氨酸芽孢杆菌生理生化特性比较Table 2 Differential characteristics of strain D1 and Lysinibacillus fusiformis
2.2.3 D1菌株16S rRNA序列测定和系统发育树构建
2.2.3.1 16S rRNA序列测定
L.fusiformisNBRC 15717是D1菌株16S rDNA序列在GenBank上Blastn同源性为99%的1株菌株。
2.2.3.2 系统发育树构建
结果如图3所示,D1菌株与各种Lysinibacillus属菌株的遗传距离很小,且D1与L.fusiformisNBRC 15717在同1个分支中。
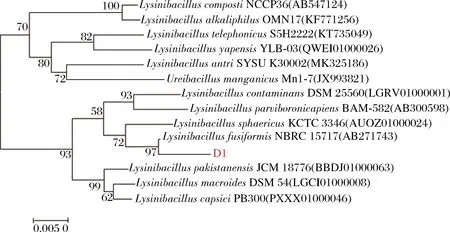
图3 菌株D1 16S rRNA基因序列系统发育树Fig.3 Phylogenetic tree of the D1 based on 16S rRNA sequences
2.3 D1菌株生长动力学实验
D1菌株在不同亚硒酸钠浓度条件下的生长曲线(图4)显示,D1菌株生长在4 h进入指数期,约28 h进入稳定生长期。亚硒酸钠浓度的增加对细菌的生长的抑制作用也逐渐增强,亚硒酸钠浓度变大导致菌株生长的滞后阶段持续时间增加。
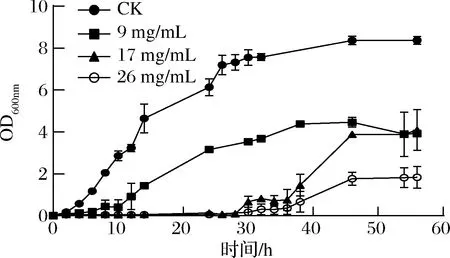
图4 菌株D1在含不同浓度亚硒酸钠培养基中的生长曲线Fig.4 The growth curve of D1 in culture medium with different concentrations of sodium selenite
2.4 D1菌株制备纳米硒表征
DLS分析表明红色产物为纳米单质硒,粒径为(306.20±1.64) nm(图5)。
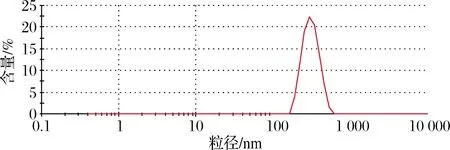
图5 菌株D1制备SeNPs粒径大小Fig.5 Preparation of SeNPs Particle size by Lysinibacillus fusiformis Dl
2.5 D1菌株的自由基清除能力测定
2.5.1 DPPH自由基清除率的测定
如图6所示,D1次生代谢产物(图6-b)具有一定的DPPH自由基清除能力,其质量浓度为1 045 μg/mL时,DPPH自由基清除率达(66.38±0.67)%,且次生代谢产物呈现明显的剂量依赖性。D1菌株制备的SeNPs(图6-a)和亚硒酸钠(图6-c)均具有较弱的DPPH自由基清除能力。

a-纳米硒;b-次生代谢产物;c-亚硒酸钠图6 DPPH自由基清除能力Fig.6 DPPH radical scavenging ability注:ns表示无显著性差异(P>0.1);**表示差异显著(P<0.05);同一行不同小写字母表示差异显著(下同)
2.5.2 ABTS阳离子自由基清除率的测定
如图7所示,D1次生代谢产物(图7-b)和亚硒酸钠(图7-c)均具有较强的ABTS阳离子自由基清除能力。次生代谢产物质量浓度为150 μg/mL时,ABTS阳离子自由基清除率达(99.94±0.08)%。D1菌株制备的SeNPs(图7-a)具有一定的ABTS阳离子自由基清除能力,在1 045 μg/mL的质量浓度下,ABTS阳离子自由基清除率为(59.81±5.09)%。该3个样品自由基清除能力均随样品溶液浓度增大而增强。

a-纳米硒;b-次生代谢产物;c-亚硒酸钠图7 阳离子自由基清除能力Fig.7 ABTS radical scavenging ability
2.5.3 羟自由基清除率的测定
如图8所示,D1菌株的次生代谢产物(图8-b)和亚硒酸钠(图8-c)具有一定的羟自由基清除能力。次生代谢产物在质量浓度为745 μg/mL时,羟自由基清除率达(36.16±0.16)%。D1菌株制备的SeNPs(图8-a)具有较弱的羟自由基清除能力。自由基清除能力均随这3个供试品溶液浓度增大而增大。

a-纳米硒;b-次生代谢产物;c-亚硒酸钠图8 羟自由基清除能力Fig.8 Hydroxyl free radical scavenging ability注:*表示差异显著(0.05 本研究从江汉平原土壤中分离得到了1株高耐硒菌株D1,鉴定为纺锤形赖氨酸芽孢杆菌(Lysinibacillusfusiformis)。已见报道的L.fusiformis主要分离自土壤,污染水体[17],它们在环境中具有降解石油[18]、还原铬和降解纤维素[19]等功能,但其关于耐硒能力的报道较少。D1对35 mg/mL高质量浓度亚硒酸盐有一定的耐受性。该菌株制备的Se0粒径大小为306.20 nm。研究表明D1能够将高浓度亚硒酸钠转化为高安全性的纳米硒,对硒污染地域的微生物修复具有重要的意义,而且转化产物生物纳米硒可以更好地促进土壤中植物的生长发育[8]。D1的次生代谢产物对DPPH自由基、ABTS阳离子自由基和羟自由基的清除能力较强,D1菌株制备的纳米硒具有一定的ABTS阳离子自由基和羟自由基清除能力,较次生代谢产物活性较弱,这可能是因为纳米硒粒径大小对清除自由基能力有一定的影响[20]。有待进一步探究该菌株后续分离纯化及活性物质,为菌株的综合利用以及研究清除持久性自由基能力奠定基础。3 结论与讨论

