高效液相色谱法同时检测肥料中9种植物生长调节剂
王庆彬, 孟 慧, 彭春娥, 周大发, 耿全政,陈大印, 张 民
(1.土肥资源高效利用国家工程实验室,山东农业大学资源与环境学院,山东泰安 271018;2.山东蓬勃生物科技有限公司,山东泰安 271000;3.作物生物学国家重点实验室,山东农业大学生命科学学院,山东泰安 271018;4.山东蓬创农业技术开发有限公司,山东泰安 271000)
植物生长调节剂(Plant Growth Regulators,PGRs)是一种具有与植物内源性激素相同生理功效和相似化学结构的一类合成化合物,可以参与调控植物内多种代谢通路,促进生长发育,提高作物产量或提高抗逆抗病能力[1 - 3]。在农业生产中该类物质的合理施用可以显著提高作物产量[4],提高作物的肥料利用率[5]。但随着植物生长调节剂的应用增多,其安全问题也受到广泛关注[6]。肥料中植物生长调节剂的不合理施用可能会造成农作物产量的下降[7],其残留也对人体健康造成威胁[8,9]。因此,研究肥料中植物生长调节剂的检测方法成为行业热点。
当前对植物生长调节剂的检测方法主要有免疫检测[10]、色谱-质谱[11,12]和高效液相色谱(HPLC)[13,14]等方法。HPLC法虽广泛应用于植物生长调节剂含量的检测[15,16],但鲜有检测肥料中植物生长调节剂的报道[17]。目前,我国国家标准方法可同时检测3~5种植物生长调节剂[18,26 - 30]。但现有植物生长调节剂种类繁多,常规大田使用种类在20种左右,现有国家标准方法未完全涵盖;或者需要联合使用多种分离富集技术,涉及色谱柱多样;或者样品前处理复杂[19]。本实验建立了同时检测反式玉米素、赤霉素A3、水杨酸、吲哚乙酸、茉莉酸、多效唑、脱落酸、芸苔素内脂和胺鲜酯9种植物生长调节剂含量的HPLC法。肥料样品用超声波辅助甲醇提取,有效去除样品中的干扰物类,利用230 nm和260 nm双波长检测,拓宽了检测范围。本方法检出限及精确度与标准方法相比并没有降低,为植物生长调节剂行业规范的制定和在农作物上的施用提供参考。
1 实验方法
1.1 仪器与试剂
LC-20A高效液相色谱仪(日本,岛津公司),配紫外检测器;Centrifuge 5810 R高速冷冻离心机(美国,EPPENDORF公司);KQ3200DE超声仪器(昆山超声仪器有限公司)。
植物生长调节剂标准品:茉莉酸、多效唑、反式玉米素、赤霉素A3、水杨酸、吲哚乙酸、芸苔素内脂、胺鲜酯和脱落酸,均购自上海源叶生物科技有限公司(纯度>99%)。植物生长调节剂标准溶液:分别称取反式玉米素、吲哚乙酸、脱落酸、水杨酸适量(精度0.1 mg),用甲醇配制成2 mg/mL的单标准储备溶液;称取赤霉素A3、茉莉酸、芸苔素内脂、胺鲜酯、多效唑适量(精度0.1 mg),用甲醇配制成10 mg/mL的单标准储备溶液。根据每个单标进样响应值情况,分别移取反式玉米素、吲哚乙酸、脱落酸、水杨酸、赤霉素A3、茉莉酸、芸苔素内脂、胺鲜酯和多效唑9种标准储备溶液,用甲醇稀释成混合标准工作液,其中反式玉米素、脱落酸均为0.2 mg/mL,吲哚乙酸为0.4 mg/mL,芸苔素内脂、水杨酸、胺鲜酯均为1 mg/mL,多效唑为1.5 mg/mL,赤霉素A3为2 mg/mL,茉莉酸为5 mg/mL,现用现配。甲醇、乙酸均为色谱纯,购自赛默飞世尔科技有限公司。实验用水为超纯水(18.2 MΩ·cm)。
1.2 肥料样品的制备
混合标准溶液:分别称取适量的反式玉米素、吲哚乙酸、脱落酸、水杨酸、赤霉素A3、茉莉酸、芸苔素内脂、胺鲜酯和多效唑标准品,用甲醇配制成5个水平的混合标准工作液,混标编号及配制见表1。
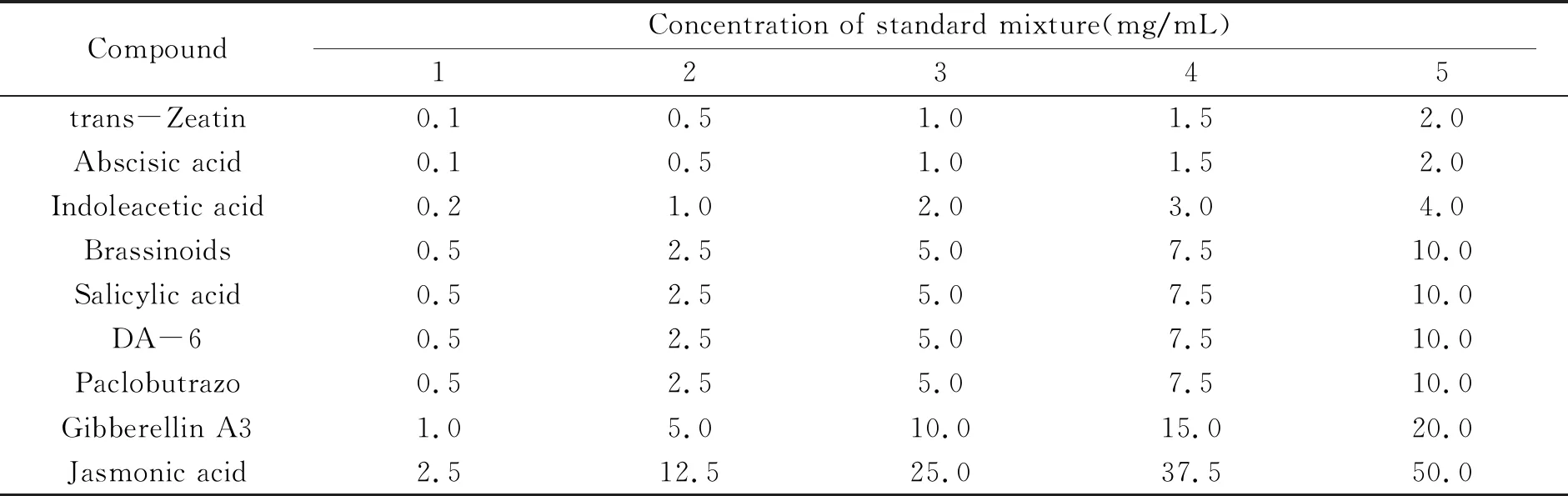
表1 不同混合标准品水平和浓度
固体样品制备:准确称取10 g空白肥料,在表面喷施上述混合标准品溶液1 mL,颠倒混匀后,40 ℃烘干,待测。每个混合标准品水平做3个样品平行。
液体样品制备:准确加入10 mL空白样品,加入1 mL混合标准样品,振荡混匀后待测。每个混合标准品水平做3个样品平行。
1.3 样品前处理
称取1 g肥料样品(精度0.1 mg),置于10 mL离心管中,加入8 mL甲醇,涡旋振荡1 min,超声提取30 min。冷却至室温,用甲醇定容至10 mL,转移至15 mL离心管,以10 000 ×g离心10 min,取1 mL上清液,0.22 μm有机相滤膜过滤后,待测。
1.4 液相色谱条件
Venusil XBP C18色谱柱(100 mm×4.6 mm×5 μm,艾杰尔中国公司);流动相:A为0.1%冰HAc溶液,B为甲醇。梯度洗脱条件:0~4.0 min,70%A;4.1~12.0 min,65%A;12.1~30.0 min,60%A;30.1~40.0 min,30%A;40.1~45.0 min,60%A;45.1~60.0 min,70%A。流速:0.5 mL/min;检测波长:茉莉酸和多效唑最佳检测波长为230 nm,芸苔素内脂、胺鲜酯、反式玉米素、赤霉素A3、水杨酸、吲哚乙酸和脱落酸最佳检测波长为260 nm;柱温35 ℃;进样量:10 μL。
2 结果与讨论
2.1 色谱条件的选择
2.1.1 检测波长的优化考察9种目标物紫外吸收值[20 - 22]。结果表明:220 nm和222 nm处,水杨酸和吲哚乙酸吸收值大,但接近甲醇的最大吸收波长,无法满足定量分析要求;230 nm、255 nm和268 nm波长分别适用于茉莉酸和多效唑、胺鲜酯以及云苔素内酯,但其他目标物吸收值过小;260 nm波长处反式玉米素、赤霉素A3、水杨酸、吲哚乙酸、芸苔素内酯、胺鲜酯、脱落酸出峰良好且基线平稳。综合分析,选择用230 nm和260 nm双波长模式检测。其中,以230 nm波长检测茉莉酸、多效唑;以260 nm波长检测反式玉米素、赤霉素A3、水杨酸、吲哚乙酸、芸苔素内酯、胺鲜酯和脱落酸。
2.1.2 流动相的选择植物生长调节剂的HPLC法测定一般以甲醇和水为流动相[23]。本实验采用不同含量甲醇作流动相洗脱样品,结果表明当甲醇含量为30%时,整体分离度最好,但反式玉米素和赤霉素A3特征峰拖尾、峰肩交叉严重,容易与样品中其它杂质重叠。加入冰HAc可以有效抑制样品的解离,改善峰拖尾情况,将水相更换成不同梯度浓度的HAc水溶液,实验结果表明其浓度为0.1%时各特征峰实现完全分离[24],结果见图1。
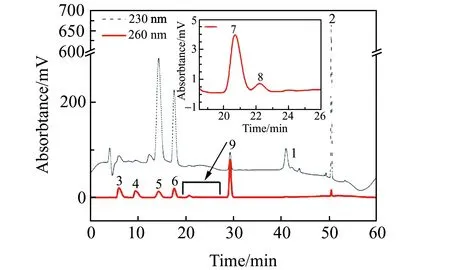
图1 标准品的色谱图
2.1.3 流速的选择设置0.5、1.0、1.5 mL/min 3个流速,分别考察样品的分离度[25]。结果表明,升高流速分离度变差,出峰时间缩短,柱压升高;降低流速分离度提高,出峰时间延长,柱压下降。当流速大于1.0 mL/min时,反式玉米素与赤霉素A3的色谱峰部分重叠,水杨酸与吲哚乙酸的色谱峰重叠;当流速为0.5 mL/min时,各色谱峰分离度改善,基线平稳,出峰时间适当。综合考虑,实验选择0.5 mL/min的流速。
2.2 方法学评价
2.2.1 方法回收率在空白肥料样品中,分别添加5个浓度水平的9种植物生长调节剂混合标准溶液,按照上述色谱方法测定,计算各个添加浓度下的回收率,结果见表2。可以看出,该方法平均回收率在91.92%~104.68%之间,相对标准偏差(RSD,n=3)<5%。表明本方法具有良好的准确度。
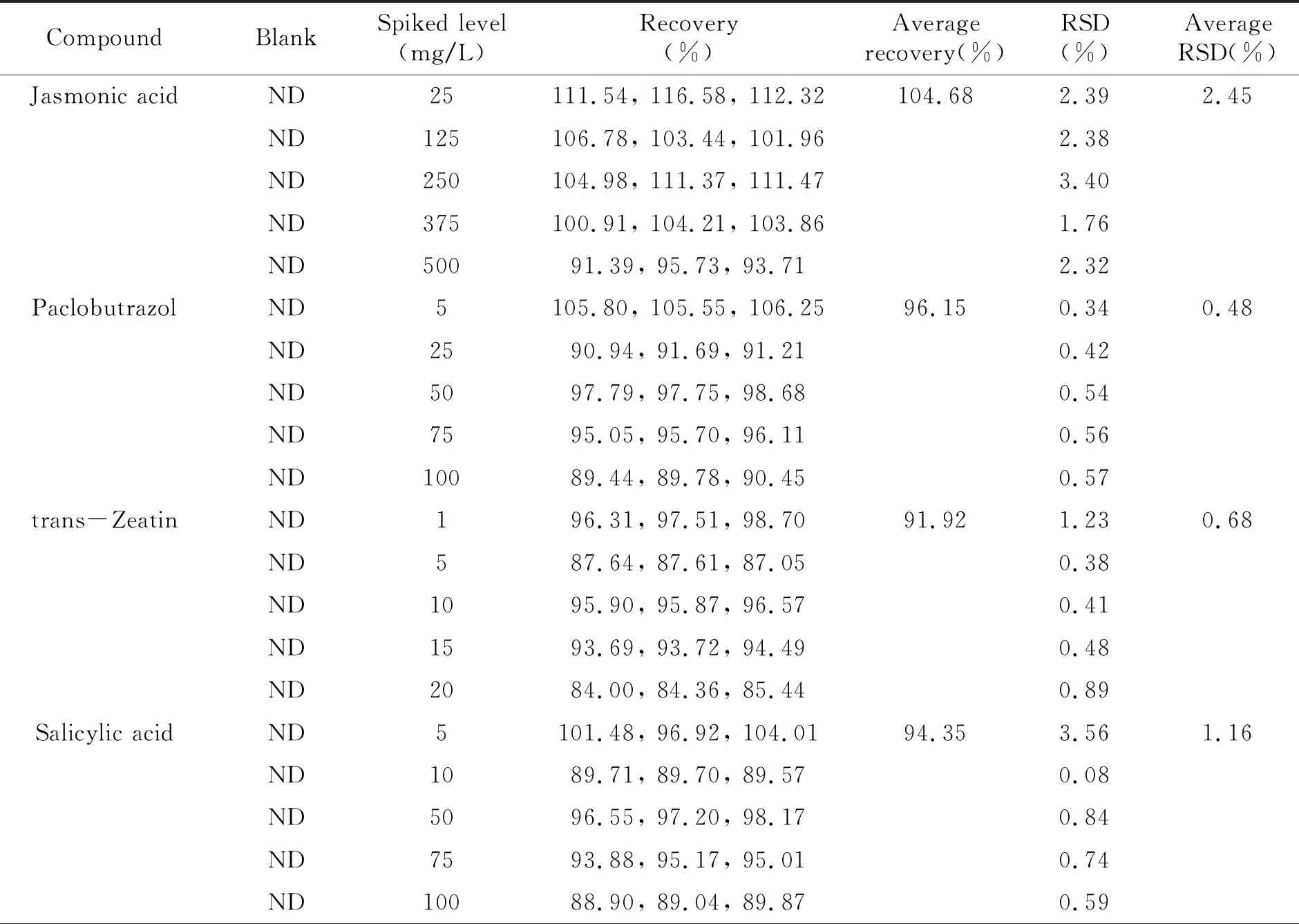
表2 肥料样品中9种植物生长调节剂的加标回收率(n=3)
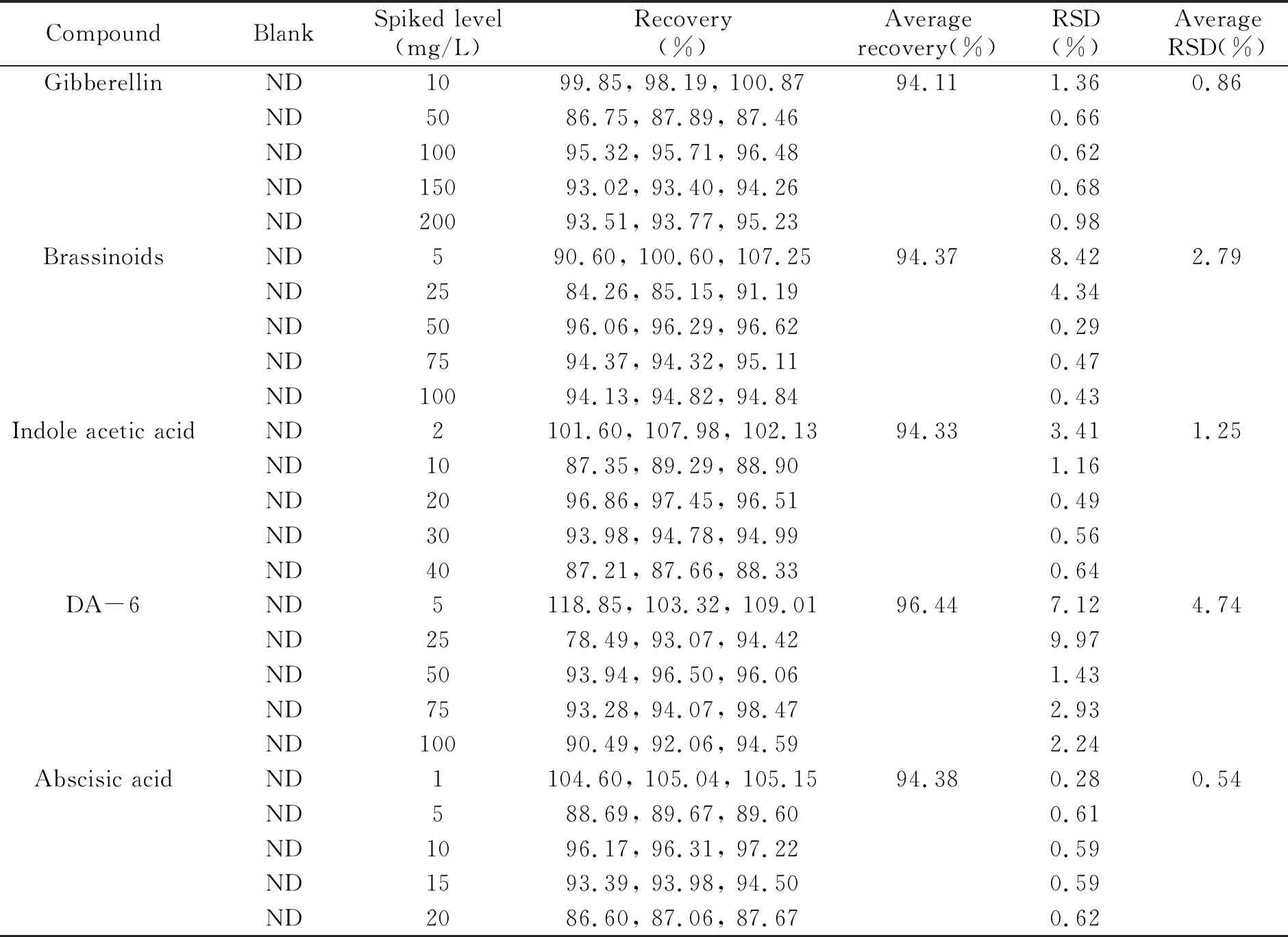
(续表2)
2.2.2 线性方程和线性范围分别吸取不同体积的混合标准溶液,用甲醇定容,配制成系列标准溶液,根据上述肥料处理方法处理,按上述色谱条件进样,以溶液质量浓度(x,μg/mL)为横坐标,其对应的色谱峰峰面积(y)为纵坐标,绘制标准工作曲线。9种植物生长调节剂的线性方程、线性范围、相关系数和检出限列于表3。
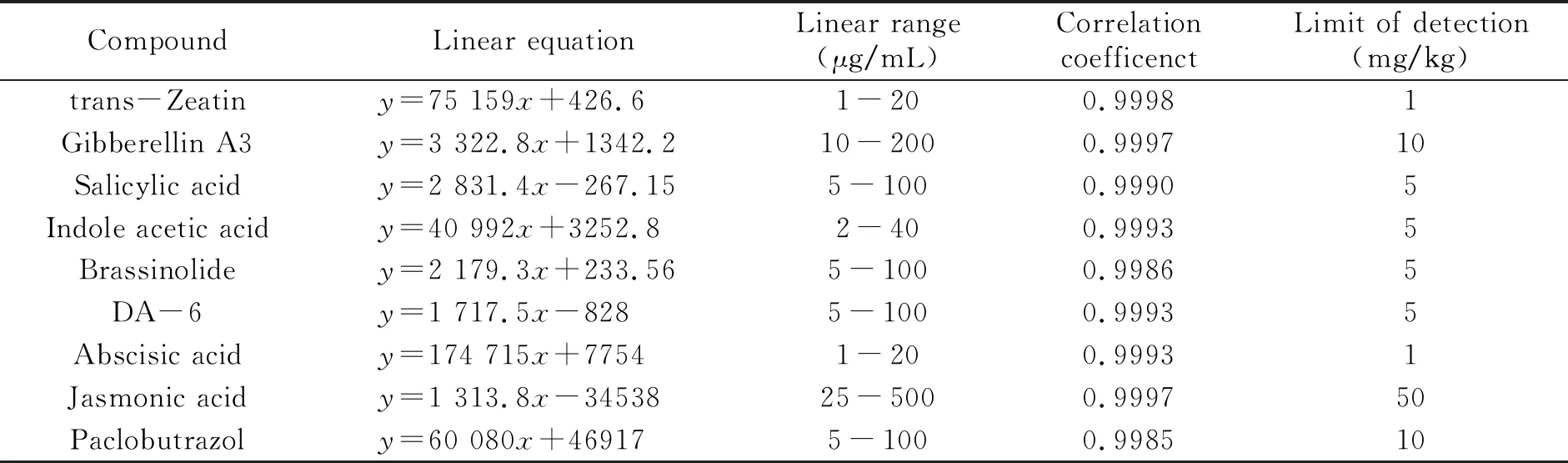
表3 线性方程、线性范围及相关系数和检出限
2.2.3 方法精密度利用同一空白样品,准确称取5个平行试样,分别添加不同浓度的9种植物生长调节剂混合标准溶液,在上述色谱条件下进行检测,结果见表4。
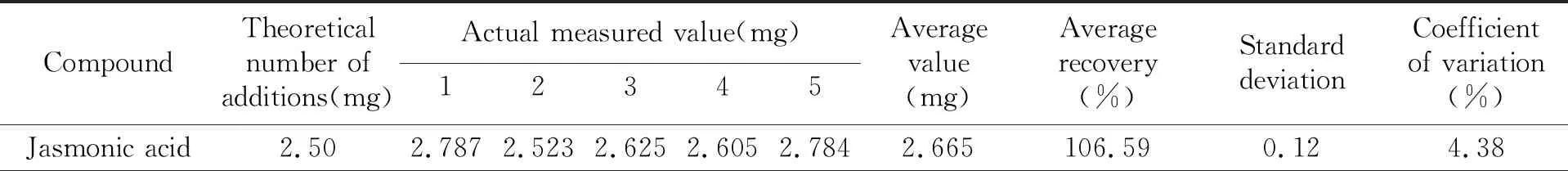
表4 分析方法的精密度试验结果
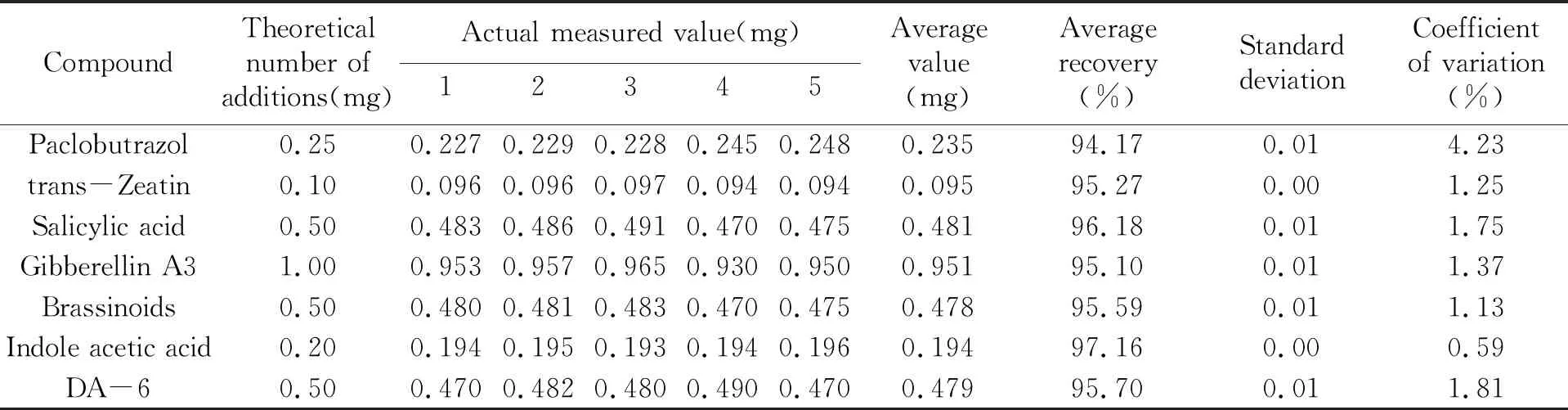
(续表4)
3 结论
本方法可同时检测肥料中反式玉米素、赤霉素A3、水杨酸、吲哚乙酸、茉莉酸、多效唑、脱落酸、芸苔素内脂和胺鲜酯9种植物生长调节剂,方法检测种类多,色谱分离效果好,基线平稳,线性范围内线性关系良好,相关系数R2均达到0.998以上,平均加标回收率在91.92%~104.68%之间,相对标准偏差(RSD,n=3)<5%,准确度和精密度都满足方法学指标,是对植物生长调节剂的市场推广和行业规范的一种可靠的检测方法。

