一株虹鳟源枯草芽孢杆菌的分离鉴定及生物学特性研究❋
樊 丹, 邓福容, 李绍戊, 卢彤岩, 刘红柏, 王 荻❋❋
(1. 中国水产科学研究院黑龙江水产研究所, 黑龙江 哈尔滨 150070;2. 黑龙江省水生动物病害与免疫重点实验室, 黑龙江 哈尔滨 150070;3. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306;4. 上海海洋大学国家水生动物病原库, 上海 201306)
虹鳟(Oncorhynchusmykiss)是世界上广泛养殖的重要冷水性鱼类,因肉质鲜美、营养价值高而广受消费者喜爱。近年来,国内虹鳟养殖行业发展迅速,在满足人们日益增长的蛋白质营养及风味需求等方面发挥了不可替代的重要作用,具有广阔的市场前景。随着虹鳟养殖规模快速增大,片面追求经济效益的同时忽略了科学管理进而引发一系列水质环境恶化、密度胁迫、营养失衡等问题,导致细菌性疾病暴发风险提高。目前抗菌药物的使用仍是虹鳟养殖过程中细菌性疾病的主要治疗手段[1],尽管抗菌药物具有见效快、成本低等优点[2],但易导致药物残留、耐药菌株产生及环境污染和食品安全等问题,对养殖业发展甚至人类健康具有潜在危害。
益生菌(Probiotics)作为一种新型绿色饲料添加剂,在提高动物生产性能和抗病力方面有良好的效果,广泛应用于畜牧养殖、水产养殖、医药等领域[3-5]。益生菌被粮食及农业组织(FAO)和世界卫生组织(WHO)定义为对宿主具有一定的积极作用的微生物。Basoulis等[6]认为益生菌是活的微生物,足量使用可对宿主产生积极作用,而Balcázar等[7]认为益生菌是对宿主健康有益生效果的微生物或化合物,包括酵母菌、细菌和藻类。随着益生菌及其产品的不断筛选和研发,其在促进水产养殖动物的生长、提高机体免疫力和改善肠道菌群结构等方面均表现出较好的效果[8]。益生菌的作用机制包括竞争肠道黏膜的结合位点、抑制致病菌的增殖、刺激免疫系统、产生抑菌物质、提高消化酶活性、调节肠道菌群结构、为宿主提供细胞营养成分等[9-11]。其中有关虹鳟的研究报道表明,益生菌在促生长及提高免疫力等方面具有显著效果[12-15]。Vazi-rzadeh等[16]发现酿酒酵母(Saccharomycescerevisiae)显著提高了虹鳟成鱼的增重率。Merrifield等[17]和Mohammadian等[18]研究结果表明枯草芽孢杆菌(Bacillussubtilis)、保加利亚杆菌(Lactobacilluselbrueckiisubsp.bulgaricus)、嗜酸乳杆菌(L.acidophilus)和柠檬酸杆菌(Citrobacterfarmeri)可提高虹鳟的特定生长率,增强免疫功能,降低饲料系数。虽然国外已有针对虹鳟的益生菌研究[19-20],但国内尚缺乏冷水性鱼类益生菌相关研究报道。因此,分离筛选适用于虹鳟养殖的益生菌菌株是亟待解决的问题之一。
本研究从辽宁省虹鳟主养区养殖场的健康虹鳟幼鱼肠道中筛选到1株细菌,并对菌株进行了形态和分子特征、产酶性能、抑菌性、抗逆性和安全性研究,以期为虹鳟益生菌制剂的研发与应用提供菌种资源。
1 材料与方法
1.1 实验材料
用于筛选益生菌的健康虹鳟幼鱼购自辽宁省本溪艾格莫林实业有限公司,初始平均体质量为(35.30±3.20) g,于循环养殖箱(160 cm×60 cm×60 cm)中饲养,养殖温度(15.0±1.0) ℃。用于人工感染实验的健康虹鳟初始体质量为(10.00±0.89) g,养殖温度(15.0±1.0) ℃,暂养14 d。
实验用温和气单胞菌(Aeromonassobria)、杀鲑气单胞菌(A.salmonicida)、维氏气单胞菌(A.veronil)、嗜水气单胞菌(A.hydrophila)和鲁氏耶尔森菌(Yersiniaruckeri)等菌株作为本实验室鉴定保存菌株。芽孢染色液购自北京雷根生物技术有限公司;蛋白酶和纤维素酶测试试剂盒购自上海杰美基因医药科技有限公司;细菌基因组DNA提取试剂盒、荧光染色剂5(6)-羧基荧光素二乙酸酯(CFDA-SE)购自北京天根生化科技有限公司;枯草芽孢杆菌培养基(BSOM)购自招远拓普生物工程有限公司;药敏纸片购自杭州微生物试剂有限公司。
1.2 样品采集和菌株分离培养
在无菌条件下对虹鳟((35.30±3.20) g)体表进行消毒,解剖获取虹鳟消化道,无菌生理盐水冲洗3次后,采用组织匀浆器破碎肠道组织,将匀浆液收集于1 mL无菌生理盐水中,梯度稀释后分别取100 μL涂布于BSOM固体培养基表面,28 ℃倒置培养。挑取优势菌落划线纯培养,直到获得纯培养物。将纯培养物接种到LB液体培养基内,28 ℃,120 r/min振摇16 h,菌悬液与80%灭菌甘油按3∶1混合均匀后分装于1.5 mL的EP管中,-80 ℃冰箱保存,便于后续生物学研究。
1.3 产酶能力测定
选取生长良好的3株优势菌株,分别命名为RT-BS07、RT-BS08、RT-BS09,于LB液体培养基中振摇培养24 h后,4 000 r/min离心30 min。取上清液用蛋白酶和纤维素酶试剂盒测定其相应酶活,操作步骤按照试剂盒说明书进行。
1.4 菌株形态和分子鉴定
1.4.1 菌株形态学观察 选取产酶性能良好的菌株接种到LB固体平板上,28 ℃恒温箱中倒置培养过夜,观察菌落形态特征。分别用革兰氏染液与芽孢染色液进行处理,在光学显微镜下观察革兰氏染色与芽孢染色后的菌株形态特征。
1.4.2 16S rRNA基因及同源性比对分析 选取16S rRNA基因作为目标基因,采用分子生物学方法进行菌株种属鉴定。将候选菌株接种于LB肉汤培养基中,28 ℃,120 r/min振摇16~20 h后离心收集菌体,按照试剂盒说明书提取细菌基因组DNA作为PCR模板。16S rRNA基因通用引物序列:27F(5’-AGAGTTTGATCCTGGCTCA-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)。PCR扩增体系为:DNA模板1 μL,2×Premix 25 μL,引物27F(10 μmol/L)和1492R(10 μmol/L)各2 μL,加水补足至50 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,35个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测及纯化后委托吉林省库美生物科技有限公司进行测序分析。16S rRNA基因拼接序列与EzBioCloud基因数据库进行同源性比对分析(https://www.ezbiocloud.net/)。
1.5 体外抑菌特性分析
参照秦春秀等[21]的研究方法并改进,将过夜培养的致病菌悬液加入半冷却的LB培养基中并调整菌终浓度为1.0×108CFU/mL,倒板,待培养基凝固后用牛津杯打孔。取100 μL受试菌悬液添加至牛津孔内,以无菌PBS为阴性对照,于28 ℃下培养24 h后利用十字交叉法测量抑菌圈直径并计算抑菌面积。
1.6 耐受性实验
1.6.1 酸碱耐受 分别用1 mol/L HCl与1 mol/L NaOH溶液调节LB肉汤培养基pH为2、3、4、6、8和10,对照组培养基pH为7。取0.5 mL受试菌悬液(1.0×108CFU/mL)分别接种到实验组及对照组的50 mL培养基中,28 ℃,120 r/min振摇24 h后测量菌液OD600值,进行3次重复试验。相对存活率(RS)计算公式:RS=Nχ/N0×100%;式中:Nχ为pH为2、3、4、6、8和10时的OD600值,N0为pH为7时的OD600值。
1.6.2 盐度耐受 配置NaCl含量为2%、3%、4%、6%和8%的LB液体培养基,以1%为对照组。取0.5 mL受试菌悬液(1.0×108CFU/mL)分别接种到实验组及对照组的50 mL培养基中,28 ℃,120 r/min振摇24 h后测量菌液OD600值,进行3次重复试验。相对存活率(RS)计算公式:RS=Nχ/N0×100%;式中:Nχ为盐度为2%、3%、4%、6%和8%时的OD600值,N0为盐度为1%时的OD600值。
1.7 体外黏附实验
解剖获取健康虹鳟的肠道组织,用无菌PBS缓冲液反复冲洗肠道组织内部直至肠黏膜表面无黏附物。以无菌PBS洗涤菌液3次去除培养基干扰,调整菌悬液终浓度为1.0×109CFU/mL。添加荧光标记物CFDA-SE后,于37 ℃下避光孵育20 min。利用注射器分别在健康虹鳟的前、中、后肠注入菌悬液200 μL,用细线结扎浸于PBS缓冲液中,37 ℃孵化6 h后取出肠道组织,以无菌PBS反复洗涤3次,并迅速冷冻保存样品。参照肖立等[22]的方法进行冷冻切片制作及荧光显微观察。
1.8 安全性检测
1.8.1 溶血性检测 参考Williams等[23]的方法稍有改动,用含有无菌500 μL EDTA缓冲液的注射器抽取虹鳟尾静脉血转移至离心管,加入133 μL孟加拉红染料混匀添加至半冷却的LB培养基并倒板。取100 μL过夜培养的受试菌菌悬液涂布于血平板,28 ℃培养48 h,观察溶血现象。
1.8.2 人工感染实验 用PBS调整受试菌浓度为1.0×108CFU/mL,随机选取10尾健康虹鳟((10.00±0.89) g/尾)设置为实验组,每尾灌喂200 μL菌悬液,对照组灌喂同等体积的PBS,持续观察120 h并记录受试鱼游动、摄食、体色及死亡等情况。
1.8.3 药敏实验 采用K-B纸片扩散法测定菌株的药敏反应[24],取100 μL受试菌株菌悬液涂布至MH培养基,将药敏片置放于培养基上,28 ℃培养24 h后利用十字交叉法测量抑菌圈直径。受试菌株对恩诺沙星等10类25种抗菌药物的药敏性结果判定参照美国临床实验室标准(NCCLS)[25]。
1.9 候选菌株投喂实验
选取爱乐银牌鱼饲料(Aller Silver fish feed)作为基础饲料,饲料有效成分包括:45.0%的粗蛋白(Crude protein),20.0%的粗脂肪(Crude fat),17.9%的无氮浸出物(NFE),1.9%纤维(Fibre),7.2%的灰分(Ash),1.1%的总磷(P total),0.3%的总钠(Na total),1.0%的总钙(Ca total)。并含有10.000 IU/kg的维生素A,1.000 IU/kg的维生素D3,3 mg/kg的钙(碘化钙),5 mg/kg的铜(硫酸铜),12 mg/kg的锰(硫酸锰),70 mg/kg的锌(硫酸锌)。根据实验鱼大小选取2 mm口径饲料,并用基础饲料制备含益生菌饵料。在液体LB培养基中震荡培养,28 ℃,120 r/min,培养18 h。于4 ℃条件下4 000 r/min离心10 min收集菌体,PBS重悬,用PBS反复洗涤3次,去除培养基干扰,最终调节PBS菌悬液浓度约为1×1011CFU/mL,取140 mL菌液均匀喷洒至1 400 g饲料上,并反复翻动保持通风阴干,最终获得含有1×108CFU/g益生菌的饵料。随机选取健康、非免疫状态下虹鳟幼鱼((10.00±0.89) g),分别设立对照组和实验组,每组30尾,3个平行。对照组投喂基础饲料,实验组投喂含益生菌的饵料,于水温(14.0±0.2) ℃下,按照2%鱼体质量的投饵量每日投喂2次,分别于实验初始0天和投喂后的第42天,称量实验鱼的体质量,记录数据。
2 结果
2.1 酶活分析结果
由表1可见,RT-BS07株的蛋白酶和纤维素活力最高,分别达到(0.039±0.002)和(0.393±0.002) U/mg。RT-BS08和RT-BS092株的蛋白酶活力相近;RT-BS092株的产纤维素酶活力为(0.256±0.014) U/mg,高于RT-BS08株((0.162±0.011) U/mg)。结果表明,RT-BS07株的产消化酶能力显著高于其他两株菌。

表1 三株菌的酶活分析结果Table 1 The result of enzyme activity on three strains
2.2 菌株鉴定结果
RT-BS07株菌落在LB固体平板上呈乳白色、粗糙不透明,边缘不光滑伴有褶皱隆起。革兰氏染色后在高倍显微镜下可见紫色短杆菌,为革兰氏阳性菌(见图1a);杆状菌体中央有红色膨大的未出芽芽孢,呈圆形或椭圆形,约占菌体体积的1/2~2/3(见图1b)。PCR扩增RT-BS07株的16S rRNA片段大小为1 472 bp(GenBank登录号:MW559564)。将序列与EzBioCloud基因数据库比对发现,RT-BS07株与枯草芽孢杆菌NCBI3610株的亲缘关系最近,其16S rRNA基因的同源性为99.86%。综合形态和分子特征分析结果,将RT-BS07株鉴定为枯草芽孢杆菌。

(a.革兰氏染色;b.芽孢染色。a.Gram staining; b. Spore staining.)
2.3 抑菌效果
RT-BS07菌株对嗜水气单胞菌、维氏气单胞菌、温和气单胞菌、杀鲑气单胞菌和鲁氏耶尔森菌等水产动物病原菌具有较强拮抗和抑菌作用。其中,对温和气单胞菌的抑菌面积最大达5.34 cm2,对杀鲑气单胞菌、鲁氏耶尔森氏菌、嗜水气单胞菌、维氏气单胞菌的抑菌面积分别为3.27、2.40、1.74和1.54 cm2,阴性对照PBS未对致病菌形成抑菌圈(见表2)。

表2 RT-BS07菌株对5种病原菌的抑菌效果Table 2 The antimicrobial effect of RT-BS07 strain to several pathogens
2.4 耐受性分析结果
RT-BS07株在不同pH的LB液体培养基中相对存活率差异显著(P<0.05)。其中,在pH为6时菌株相对存活率最高(82.00%);pH为4和8时,菌株相对存活率分别为75.65%和60.00%;pH为2和10时,菌株相对存活率低,分别为8.33%和9.01%(见表3)。

表3 RT-BS07菌株在不同pH LB培养基中的相对存活率Table 3 Relative survival rate of RT-BS07 strain in LB broth medium with different pH values
菌株耐受盐度范围广,相对存活率差异显著(P<0.05),菌株在低盐度时的相对存活率高,盐度为2%和3%时,相对存活率分别高达93.28%和91.02%;随着盐度的升高,菌株相对存活率降低,盐度为8%时,相对存活率为5.70%。结果表明,RT-BS07株对酸碱和盐度均具有一定耐受力(见表4)。

表4 RT-BS07菌株在不同盐度LB培养基中的相对存活率Table 4 Relative survival of RT-BS07 strain in LB broth medium with different salinity
2.5 黏附效果
利用荧光显微镜观察RT-BS07株在肠道中的黏附效果,结果表明,RT-BS07株可大量黏附于前肠的肠道黏膜上(见图2a),在中肠(见图2b)与后肠(见图2c)部位黏附的菌相对较少,呈稀疏弥散分布。前肠的黏附效果优于中肠与后肠,同时肠道组织结构完整性良好。

(a. 前肠;b. 中肠;c. 后肠。白色箭头所指蓝色区域为肠道组织,红色箭头所指为荧光标记菌。a. Foregut; b. Midgut; c. Hindgut. The blue areas indicated by the white arrows are intestinal tissue, and the red arrows are fluorescent-labeled target bacteria.)
2.6 安全性分析结果
RT-BS07株在血平板上培养48 h后,菌落生长正常且血平板完整性良好,未观察到溶血现象。受试鱼灌喂RT-BS07菌悬液后连续观察120 h,受试鱼与对照组无差异,体色、体型等体征无变化,呼吸、摄食及游动等行为均正常,无死亡,剖检也未见肝、脾、肠等脏器有病变情况,表明RT-BS07菌株对虹鳟安全,无毒副作用。
2.7 药敏分析结果
药敏实验结果显示,RT-BS07株对左氟沙星、环丙沙星、氧氟沙星,链霉素、卡那霉素、阿米卡星、庆大霉素、大观霉素、新霉素、强力霉素、阿莫西林、氨苄西林、头孢哌酮、甲氧嘧啶、氟哌酸、磺胺异恶唑、氯霉素与红霉素均表现为敏感;对恩诺沙星和四环素表现为中度敏感;对呋喃唑酮、呋喃妥因、青霉素G及利福平表现为耐药(见表5)。

表5 菌株药敏实验结果Table 5 The results on the antibiotic susceptibility of different strains

续表
2.8 候选菌株投喂实验分析结果
实验初始实验组与对照组实验鱼体质量差异极小,投喂42 d,实验组体质量73.88 g显著高于对照组的63.18 g(P<0.05)。实验组增重率达到101.42%,对照组为78.98%(见表6)。结果表明,候选菌株在促进虹鳟体质量增长方面具有显著作用。
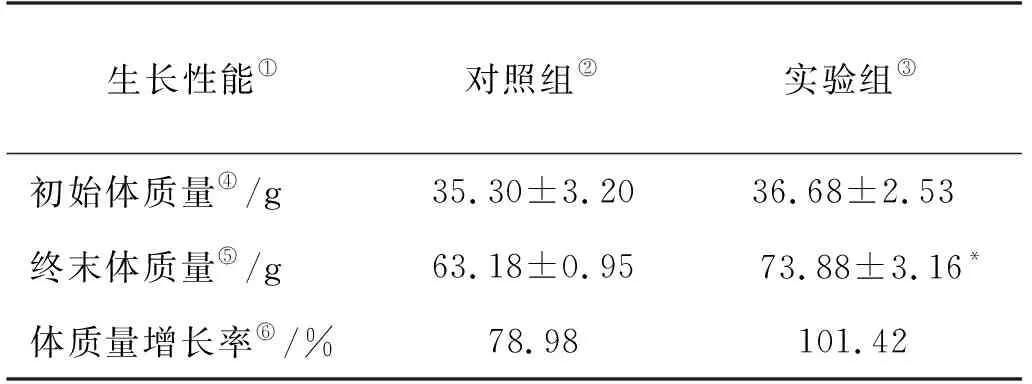
表6 候选菌株对虹鳟鱼体质量变化的影响Table 6 Effects of probiotic on the body weight at rainbow trout
3 讨论
菌株具有产消化酶性能是筛选益生菌的重要因素,此类菌株在动物肠道内产酶协同动物内源性消化酶,促进营养物质的消化与吸收提高饲料利用率,达到促进机体生长的效果[26-27]。窦春萌等[28]据此从凡纳滨对虾(Litopenaeusvannamei)肠道分离筛选获得4株产淀粉酶、蛋白酶及脂肪酶能力强的益生菌候选株。韩旭凯[29]从土壤中筛选获得枯草芽孢杆菌K12株具有良好的淀粉酶活性、纤维素酶活性、蛋白酶活性。巴翠玉等[30]从养鱼塘底泥和健康鲫鱼(Carassiusauratus)肠道中分离获得两株枯草芽孢杆菌B1株和B2株具有产脂肪酶、淀粉酶、蛋白酶和纤维素酶性能。王成强等[31]从健康的珍珠龙胆石斑鱼(Epinephelusfuscoguttatus♀×Epinepheluslanceolatus♂)肠道中分离获得的4株枯草芽孢杆菌都具有产纤维素酶、淀粉酶和蛋白酶的能力。本实验分离获得的枯草芽孢杆菌RT-BS07株与上述结果相似,具有产消化酶性能,其产蛋白酶、纤维素酶性能强,且显著促进虹鳟体质量增长,可作为益生菌候选株进行后续研究。同时研究结果表明,枯草芽孢杆菌具有抑菌作用,如任雨薇[32]发现枯草芽孢杆菌对嗜水气单胞菌具有抑制作用。刘晓燕等[33]发现枯草芽孢杆菌WH1株对金黄色葡萄球菌(Staphylococcusaureus)抑菌效果极显著(P<0.01)。秦瑶等[34]发现枯草芽孢杆菌Q4和Q10株具有抑制大肠杆菌(Escherichiacoli)和沙门氏菌(Salmonella)的作用。根据实际需求在筛选菌株时,抑菌性能也是重要的检测指标。结果表明枯草芽孢杆菌RT-BS07株与上述报道类似,具有良好抑菌性能,对温和气单胞菌、嗜水气单胞菌、杀鲑气单胞菌、鲁氏耶尔森氏菌等几种致病菌具有抑制效果。本次实验结果可为今后水产养殖益生菌的分离筛选提供抑菌性能的理论参考。
根据产酶性能或抑菌性能筛选获得候选益生菌,若要其在肠道内产生消化酶、发挥抑菌作用,该菌必须能够耐受极端条件并黏附定植在肠道内部[35-36]。为了达到补充外源性益生菌、增强虹鳟肠道消化性能、增加益生菌数量和种类、抑制致病菌增殖、降低侵害程度的目的,投喂益生菌成为常见补给方式[37-38]。但研究报道显示益生菌活菌或微生物制剂在到达肠道内部之前已失活或被降解[13]。实际应用中,益生菌发挥生物学作用要考虑动物胃肠道的复杂环境如胃酸的强降解作用、胆汁酸盐杀菌性能及菌株在肠道黏附效果差等,此时筛选耐受性强能够耐酸碱耐胆盐、肠道黏附效果好的菌株尤为重要。实验结果表明,当pH为4~8时,菌株的相对存活率大于60%;pH为2或10时,相对存活率大于8%。盐度≤3%时,菌株相对存活率体大于90%;盐度为6%~8%时,相对存活率大于5%。对于冷水性鱼类肠道的菌株黏附实验,国内未见详细报道,本次体外黏附实验表明枯草芽孢杆菌RT-BS07株可黏附在虹鳟的前、中、后肠黏膜且不损伤肠道组织结构。结果表明枯草芽孢杆菌RT-BS07株具有耐酸碱、耐高盐、黏附肠道黏膜的特点,为其顺利进入并定植在虹鳟肠道中提供了基础。
益生菌从实验分离筛选到生产应用的关键是安全性,此次人工感染实验表明RT-BS07株对虹鳟无致病性,安全性良好。此外,益生菌的耐药性是判定其安全性的重要方面。在养殖过程中,抗生素滥用可导致宿主微生物结构失衡,产生耐药性菌株,对自然环境及人类造成潜在的危害。研究报道称李旭等[39]从鲫鱼肠道中分离获得枯草芽孢杆菌CB-1株对诺氟沙星、庆大霉素及四环素表现为敏感,对洁霉素、甲硝唑及新霉素表现为中度敏感,对头孢克肟、头孢噻肟表现为耐药。刘晓燕等[33]分离的枯草芽孢杆菌WH1株对四环素、庆大霉素及卡那霉素等表现为敏感。贺刚等[40]从草鱼(Ctenopharyngodonidella)肠道中获得枯草芽孢杆菌对诺氟沙星、四环素及青霉素等表现为敏感,对磺胺二甲嘧啶和土霉素表现为耐药。本实验从虹鳟肠道中分离获得的枯草芽孢杆菌RT-BS07株对诺氟沙星、庆大霉素及头孢哌酮等大部分药物敏感,但对恩诺沙星和四环素表现为中度敏感,对呋喃妥因、呋喃唑酮、青霉素G及利福平药物表现为耐药,研究结果与已有报道基本一致,可为今后虹鳟养殖过程中药物的合理使用提供参考。
4 结语
本研究从健康虹鳟肠道组织获得1株具有良好产酶性能、耐酸碱性能、培养温度范围广的枯草芽孢杆菌,且该菌株具有良好的生物安全性和肠道黏附性,能显著促进虹鳟幼鱼体质量增长,该菌株可作为益生菌候选株进行深入研究。

