11C-MET PET/CT代谢参数对胶质瘤术后残留或复发的诊断价值▲
黄华驰 崔惠勤 陈达桂 韦建林 覃丽兰 邓燕云
(广西柳州市工人医院核医学科,柳州市 545000,电子邮箱:347194207@qq.com)
胶质瘤是颅内最常见的原发肿瘤,高级别胶质瘤约占颅内恶性肿瘤的80%[1],其起源于中枢神经系统胶质细胞,发病机制未完全明确。世界卫生组织将胶质瘤分为Ⅰ~Ⅳ级,低级别胶质瘤(Ⅰ~Ⅱ级)多见于儿童、青少年,高级别胶质瘤(Ⅲ~Ⅳ级)多见于中老年人[2]。目前胶质瘤的治疗方法首选手术治疗,其余方法有术后辅助放化疗、免疫治疗、光动力治疗、电场疗法等,胶质瘤通常为浸润性生长,边界不清晰,手术切除难度较大,术后复发率较高[3]。因此胶质瘤需通过有效的检查手段及时诊断术后残留或复发,并与非残留复发病变进行鉴别,从而有效地指导临床后续治疗。
既往研究报道,18F-氟代脱氧葡萄糖(18F-fludeoxyglucose,18F-FDG)在脑实质中摄取较高,在脑部的应用存在局限性,而11C-甲基-L-蛋氨酸(11C-methionine,11C-MET)在正常脑组织中摄取量不高,在胶质瘤中的摄取量明显高于周围正常脑实质,可用于胶质瘤的病理分级预测、治疗靶区划定、治疗后评估,具有较好的显像特点[4]。本研究探讨11C-MET正电子发射断层成像/计算机断层成像(positron emission tomography/computed tomography,PET/CT)对胶质瘤术后残留或复发的诊断价值。
1 资料与方法
1.1 临床资料 回顾性分析2018年1月至2020年7月在柳州市工人医院就诊的34例胶质瘤术后患者的临床资料,所有患者均同意接受11C-MET PET/CT检查并签署知情同意书,其中男性28例,女性6例,年龄21~68(45.06±13.70)岁;弥漫性星形细胞瘤(Ⅱ级)4例,少突胶质细胞瘤(Ⅱ级)2例,间变性星形细胞瘤(Ⅲ级)4例,间变性少突胶质细胞瘤(Ⅲ级)4例,胶质母细胞瘤(Ⅳ级)20例。根据病理检查或临床随访结果将患者分为残留复发组24例与非残留复发组10例。本研究已通过柳州市工人医院医学伦理委员会审查。
1.211C-MET PET/CT检查方法 使用日本住友公司HM-10回旋加速器生产核素11C,经合成模块自动合成显像剂11C-MET。患者平静状态下经手背或前臂浅静脉注射11C-MET,剂量为185~370 MBq,在指定房间静卧30~40 min。采用德国Siemens Biograph S20扫描机进行颅脑CT及PET扫描,采集时间为8 min。嘱咐患者摘除配饰及金属异物等,取仰卧位,将患者置于视野中心,双臂自然下垂,检查过程中体位保持不动。CT成像参数:管电流100~120 mAs,管电压120 kV,螺距1.0,矩阵512×512,采用螺旋式扫描。PET成像参数:开始采集时间为给药后50 min,每床位采集时间5~10 min,矩阵256×256,床位重叠25%~30%,使用3D模式采集。扫描完成后将PET图像及CT图像传送至后处理工作站进行校对、重建和融合。采用有序子集最大期望值迭代法重建11C-MET PET/CT图像。
1.3 图像分析 由2名具有高级职称的核医学科医师共同阅片。通过勾画感兴趣区,测量病变区域的最大标准摄取值(maximum standardized uptake value,SUVmax)、平均标准摄取值(mean standardized uptake value,SUVmean)、标准摄取峰值(peak standardized uptake value,SUVpeak)、肿瘤代谢体积(metabolic tumor volume,MTV),以及镜像侧本底SUVmax、SUVmean、SUVpeak,计算病灶-本底SUVmax比值(maximum tumor-to-background ratio,TBRmax)、病灶-本底SUVmean比值(mean tumor-to-background ratio,TBRmean)、病灶-本底SUVpeak比值(peak tumor-to-background ratio,TBRpeak)。
1.4 胶质瘤术后残留或复发的诊断方法 (1)胶质瘤术后PET/CT检查后,进行病理组织学检查发现肿瘤残留;(2)临床随访(持续至少半年)均满足下列条件时诊断为复发:① 病情明显恶化或进展至死亡,除胶质瘤以外的疾病所致;② 多次MRI复查后发现新发病灶或病灶明显增大(或增多);③ 排除放射性脑疾病或其他炎症性病变(治疗后患者症状改善较明显,MRI复查提示病灶变化不明显或缩小)。
1.5 统计学分析 采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以(x±s)表示,组间比较采用两独立样本t检验;非正态分布的计量资料以[M(P25,P75)]表示,组间比较采用Mann-Whitneyu检验。计数资料以例数或百分比表示,比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价11C-MET PET/CT代谢参数诊断胶质瘤残留或复发的效能。以P<0.05表示差异有统计学意义。
2 结 果
2.1 两组患者的一般情况 34例患者中,最终诊断为胶质瘤术后残留或复发者24例(病理诊断4例,临床随访诊断20例),其中男性18例,女性6例,年龄28~62(44.08±11.05)岁,弥漫性星形细胞瘤(Ⅱ级)2例,少突胶质细胞瘤(Ⅱ级)2例,间变性星形细胞瘤(Ⅲ级)4例,间变性少突胶质细胞瘤(Ⅲ级)3例,胶质母细胞瘤(Ⅳ级)13例,典型病例见图1、图2。非残留复发者10例(病理诊断2例,临床随访诊断8例),全部为男性,年龄52(29.25,65.00)岁,弥漫性星形细胞瘤(Ⅱ级)2例,间变性少突胶质细胞瘤(Ⅲ级)1例,胶质母细胞瘤(Ⅳ级)7例。
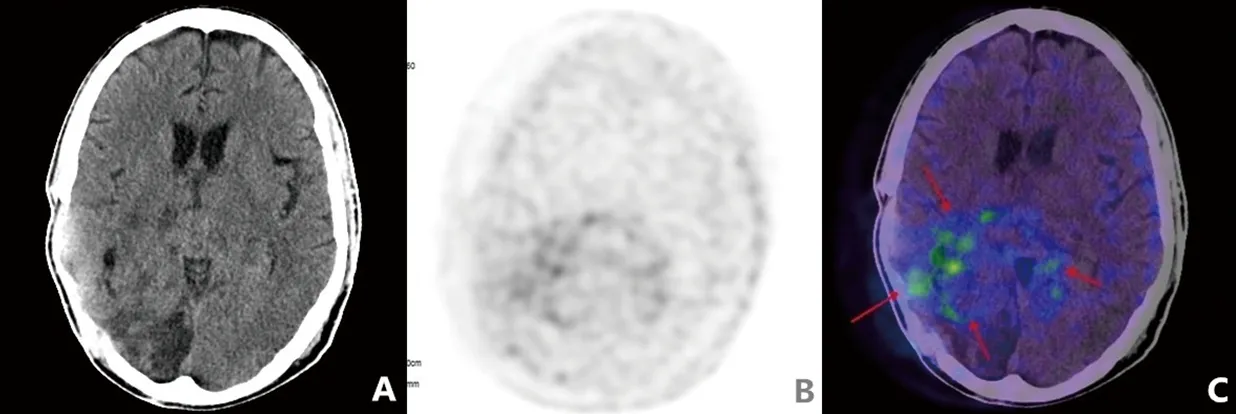
图1 胶质瘤术后残留
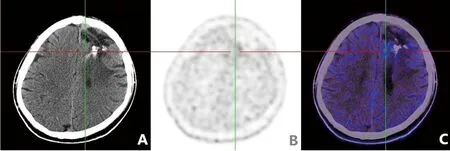
图2 胶质瘤术后复发
2.2 残留复发组与非残留复发组11C-MET PET/CT代谢参数的比较 残留复发组SUVmax、TBRmax、SUVmean、TBRmean、SUVpeak、TBRpeak、MTV均高于非残留复发组(均P<0.05),见表1。

表1 残留复发组与非残留复发组11C-MET PET/CT代谢参数的比较[M(P25,P75)/x±s]
2.311C-MET PET/CT对胶质瘤术后残留或复发的诊断价值 SUVmax、TBRmax、SUVmean、TBRmean、SUVpeak、TBRpeak、MTV诊断胶质瘤术后残留或复发的曲线下面积分别为0.925、0.900、0.896、0.892、0.892、0.975、0.950(均P<0.05)。阈值分别为2.087、1.267、1.437、1.842、1.606、1.648、16.681 cm3时,对应的灵敏度分别为87.5%、91.7%、75.0%、75.0%、79.2%、79.2%、91.7%,特异度分别为90.0%、80.0%、100.0%、100.0%、100.0%、70.0%、90.0%,准确度分别为88.2%、88.2%、82.4%、82.4%、85.3%、76.5%、91.2%。见表2、图3。
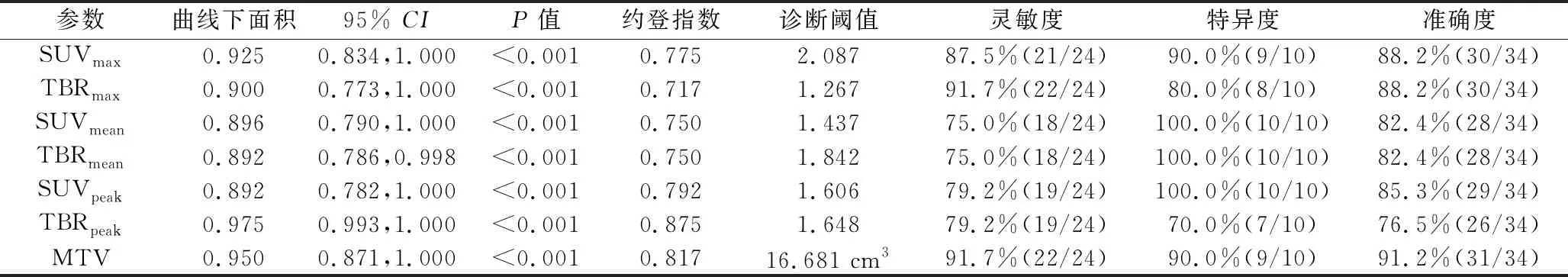
表2 各11C-MET PET/CT代谢参数诊断胶质瘤术后残留或复发的效能
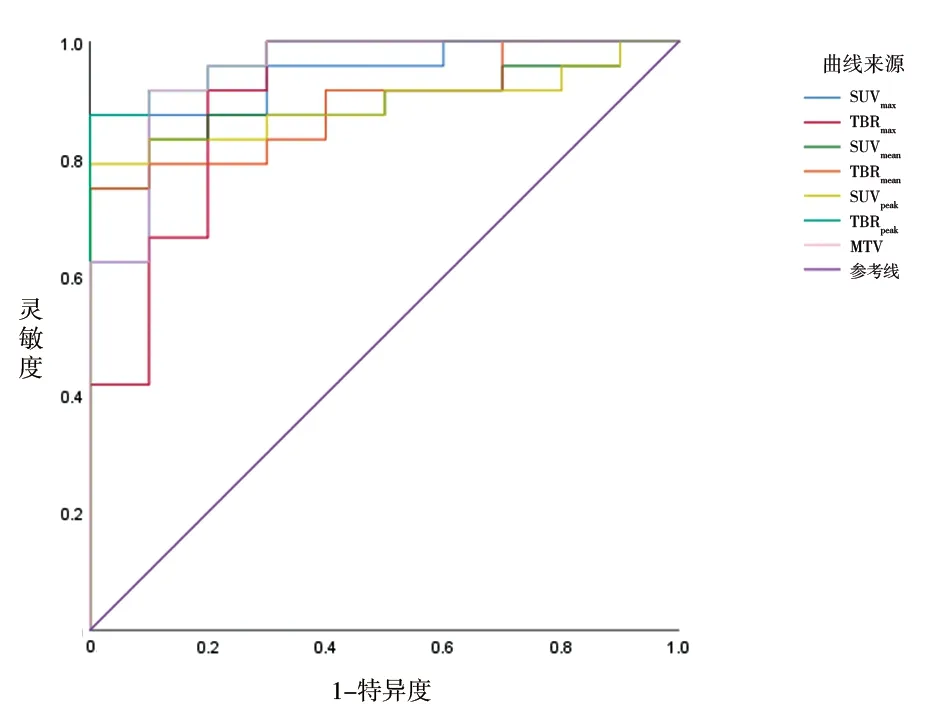
图3 各11C-MET PET/CT代谢参数诊断胶质瘤术后残留复发的ROC曲线
3 讨 论
胶质瘤术区可产生复杂的术后反应,MRI增强扫描可见胶质瘤术后脑组织反应区域有明显强化灶,这可能与手术所致血-脑屏障破坏、肉芽组织增生、血管调节功能紊乱引起异常灌注有关[5]。胶质瘤治疗方法除手术外还有放化疗等,常规影像学检查鉴别复发与治疗后假性进展、放射性坏死等的特异性较低[6]。磁共振波谱、弥散加权成像、灌注加权成像等功能成像技术,在鉴别胶质瘤术后残留/复发与良性改变方面较常规MRI更有优势[7-8],但有学者指出,这些手段尚不能明确区分两者,需采用PET/CT成像进行鉴别[9]。D′Souza等[10]报告,11C-MET PET/CT诊断胶质瘤术后残留或复发的敏感性、特异性、准确性分别为94.7%、80.0%、89.6%。还有研究显示,11C-MET PET/CT用于胶质瘤术后复发生物靶区放疗定位的准确度较MRI高,可明显改善患者的预后[11-12]。因此11C-MET PET/CT在诊断胶质瘤术后残留或复发及指导复发后再治疗方面具有一定的应用价值。
标准摄取值表示局部组织所摄取显像剂的放射性活度与全身平均注射活度的比值,反映代谢水平;病灶/本底比值指肿瘤病灶与本底正常脑组织标准摄取值的比值;MTV既能显示肿瘤体积,又可显示代谢活性。本研究结果显示,胶质瘤术后残留复发组的SUVmax、TBRmax、SUVmean、TBRmean、SUVpeak、TBRpeak、MTV高于非残留复发组(P<0.05),与乔真等[13]的研究结果相近,说明11C-MET PET/CT代谢参数在胶质瘤术后残留或复发的诊断中起到一定的作用。
Deuschl等[9]认为TBRmax>1.8时诊断胶质瘤复发的效能最高,Garcia等[14]认为TBRmax鉴别胶质瘤复发与放射性坏死的阈值为2.35。乔真等[13]报告,SUVmax、SUVmean、TBRmax、TBRmean诊断胶质瘤复发的阈值分别为3.05、1.65、1.96、1.79,但4者ROC曲线下面积差异无统计学意义。本研究中,SUVmax、SUVmean、TBRmax、TBRmean的诊断阈值分别为2.087、1.437、1.267、1.842,与上述研究存在一定差距,这可能与本研究样本量小且代谢参数的测量存在主观性等因素有关。此外,本研究7个11C-MET PET/CT参数诊断胶质瘤术后残留或复发的灵敏度为75.0%~91.7%,特异度为70.0%~100%,准确度为76.5%~91.2%,均在较高范围内,提示这些参数对胶质瘤术后残留或复发具有一定的诊断价值。
目前,胶质瘤术后11C-MET摄取增高的机制尚不明确,可能与治疗后胶质增生、血-脑屏障破坏、炎性细胞浸润有关,脑卒中、多发性硬化、脑脓肿有时也可见11C-MET摄取增高[13,15]。本研究有2例患者(少突胶质细胞瘤、胶质母细胞瘤各1例)颅内术区出现11C-MET摄取增高灶,但经病理活检最终诊断为放疗后坏死或炎症。这2例患者均为老年男性,除了存在放疗后坏死或炎症,经磁共振检查还发现有梗死灶伴边缘胶质增生,胶质增生、血-脑屏障破坏或炎性细胞浸润有可能是这2例患者11C-MET摄取增高的原因。还有2例弥漫性星形细胞瘤患者术后未见明显11C-MET摄取增高灶,但经临床随访后最终诊断为肿瘤残留复发,其机制尚不明确。
综上所述,11C-MET PET/CT代谢参数在胶质瘤术后残留或复发的诊断中具有重要的应用价值。但是本研究为回顾性临床研究,病例数较少,最终诊断结果多依靠临床随访,今后还需加大样本量、增加病理随访者进一步证实结论。

