α6/α3β4 烟碱型乙酰胆碱受体β4 亚基双点突变体的制备及其功能研究
李旭扬,陈舒苗,于津鹏,罗素兰,长孙东亭
(1.海南大学 热带生物资源教育部重点实验室/海口市海洋药物重点实验室/生命科学与药学院,海口 570228;2.广西大学 医学院,南宁 530004)
烟碱型乙酰胆碱受体(Nicotinic acetylcholine receptors,nAChRs)属于配体门控离子通道,由5 个独立的亚基组装而成。在哺乳动物中发现有16 种不同的亚基用于nAChRs 的构成,分别为α1—α7、α9、α10、β1—β4、δ、ε、γ;鸟类及家禽类动物还含有α8 亚基[1]。nAChRs 能够传递ACh 刺激产生的信号,由于分布广泛,它可介导脑部及其外周的多种生理作用[2-3],并且这些受体结构在许多物种中高度保守,可通过异源表达进行相关研究[4]。虽然nAChRs是研究前景很好的治疗靶点,但由于一些亚型表达困难,相应药物和基础科学的研究进展缓慢,尤其是含有α6 亚基的受体,它们在任何重组表达系统中都很难正常表达、形成功能通道[5-6]。这也间接导致α6β4* nAChRs(α6β4 或包含其他亚基形成的亚型)在分子水平上与配体相互作用的研究尚不多见。过去有学者认为含α6 亚基的nAChRs 主要存在于中枢神经系统的儿茶酚胺能神经元中,随着研究深入,研究者们发现α6β4* nAChRs 具有可调节人和猴肾上腺嗜铬细胞的胞吐[7-8]、控制小鼠海马去甲肾上腺素的释放等作用[9-10]。目前,α6β4* nAChR 被认为是一种治疗神经病理性疼痛的新靶点,且可用于抑制成瘾。已经确定α6β4*亚型的受体在大鼠、小鼠背根神经节(dorsal root ganglia,DRG)中有表达。WIESKOPF 等在小鼠上使用表达基因组学鉴定出机械性异常性疼痛与DRG中α6*受体的表达水平有关。通过基因编辑,构建α6*受体功能获得和缺失的突变体,发现基因敲除的小鼠机械性异常性疼痛水平增加,同时与神经性、炎性损伤相关的表现与野生型的受体完全不同,推测是由于在DRG 伤害感受器中α6* nAChRs与P2X2/3 受体的共表达产生相互作用,抑制疼痛信号的传导,发挥镇痛作用[11-14]。DONVITO 等[15]的研究证实,α6β4* nAChRs 具有调节THC(Δ9-tetrahydrocannabinol,Δ9-四氢大麻酚)成瘾后戒断的效果,可作为靶点用于THC 戒断药物的开发。以上研究结果为α6β4*nAChRs 的药理学研究提供了重要思路,且有助于研究神经病理性疼痛的发病机理。
β4 亚基在α6β4* nAChRs 的功能研究中显示出重要的作用,能够直接影响与配体药物、激动剂的结合活性。通过对比人类和大鼠β4 亚基胞外配体结合区序列差异,笔者恰好在形成配体结合口袋的Loop D(54-59)、Loop E(102-118)、Loop F(160-167)附近分别发现52-53,115-116,160-161 这3 个双差异位点(图1),对于活性影响有较大的可能[16-17],因此,利用PCR 介导的受体定点突变技术,实现一次性将相邻2 个位点同时突变,构建了3 种双点突变体。将野生型和突变型亚基的DNA 通过体外转录的方式得到cRNA,注射入非洲爪蟾卵母细胞内,诱导表达后用双电极电压钳系统检测野生型和突变型nAChRs 的表达情况。通过比较野生型和突变型受体对激动剂乙酰胆碱(acetylcholine,ACh)的反应电流值,发现α6/α3β4[S52N,I53V] nAChR 在相同浓度ACh 刺激下的电流值更大,受体通道的开放程度更高。本研究旨在通过受体结构与功能的研究,找到影响受体敏感度的氨基酸位点,并构建突变体模型,为后续配体与该受体相互作用分子机制的研究打下基础。
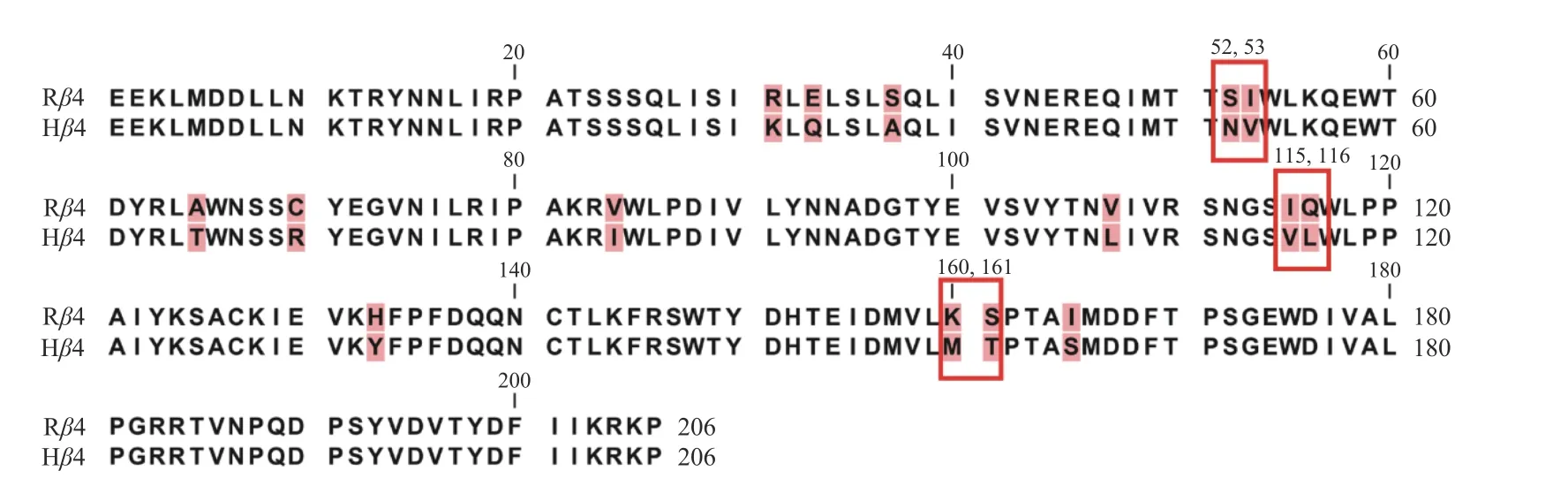
图1 大鼠、人类β4 亚基胞外配体结合域序列对比红色方框表示突变位点。Fig.1 Sequence comparison of ligand binding domain of rat and human β4 subunitsThe mutation sites are marked in red boxes.
1 材料与方法
1.1 材料与试剂雌性非洲爪蟾(Xenopus laevis)购自美国Nasco 公司,在实验室饲养1 个月以上。饲养用水经过滤、沉淀处理,饲养温度17 ℃。载有大鼠α6/α3、β4 nAChRs 亚基基因的质粒来自美国犹他大学。由于α6 亚基表达困难,故使用α6/α3 嵌合体亚基替代(α6 亚基的胞外配体结合域替换α3 亚基的对应区域产生的嵌合体,其胞外结合域的结构和功能与α6 亚基相同,且对配体的结合活性研究无影响)[18-19],利用该嵌合体构建的α6/α3β4 nAChR 能正常表达。
质粒提取试剂盒(FastPure Plasmid Mini Kit)购自南京诺唯赞生物科技有限公司;DNA 纯化试剂盒(MiniBEST DNA Fragment Purification Kit Ver.4.0)、DL 15000 Marker、限制性内切酶NheI、DpnI、Q5 超保真聚合酶均购自宝生物工程(大连)有限公司;DNA 体外转录试剂盒(mMESSAGE-mMACHINE®T7 Transcription Kit)、RNA 纯化试剂盒(MEGAclearTMTranscription Clean-Up Kit)购自美国Thermo Fisher Scientific 公司;DNA marker Ⅳ购自天根生化科技(北京)有限公司;HEPES 购自生工生物工程(上海)有限公司;乙酰胆碱(acetylcholine,ACh)、阿托品(Atropine)、胶原蛋白酶 (Collagenase) 均购自美国 Sigma-Aldrich 公司;其他生化试剂均为国产分析纯。OR2 溶液(NaCl、KCl、MgCl2和 HEPES 分别为82.5、2.0、l.0、5 mmol·L-1,pH7.5);ND-96 溶液(NaCl、KC1、MgCl2、CaCl2和 HEPES 分别为96、2.0、1.0、1.8、5 mmol·L-1,pH7.5)。引物的合成和基因序列的测定由生工生物工程(上海)有限公司完成。
1.2 仪器超微量分光光度计(Nanodrop 2000,美国Thermo Fisher Scientific 公司);PCR 仪(Mastercycler X50s,德国Eppendorf);小型水平电泳仪(美国 Bio-Rad);Alpha-2200 凝胶成像分析系统(美国 Protein-Simple);Drummond 微量注射器(Drummond Scientific,Broomall,PA);KCL-2000A 恒温恒湿培养箱(日本EYELA);双电极电压钳放大器AxoClamp 900A,数模转换器Axon Digidata1550B(美国 Molecular Devices)。
1.3 突变体引物设计对比大鼠与人类β4 亚基的胞外配体结合域序列,确定3 处双突变位点(图1 中红色方框圈出的位置)。利用PCR 介导的受体定点诱变方法,分别将这3 处位点的氨基酸编码序列由大鼠β4 亚基替换为人类β4 亚基。
使用Primer Premier 5.0 软件完成突变位点引物的设计,使正反向引物都携带有突变位点且位于中部,引物长度在25~45 bp 之间,保证GC 含量大于40%,Tm 值大于70 ℃(表1)。

表1 大鼠β4 亚基突变引物序列Tab.1 Primer sequence of β4 subunit mutation
1.4 PCR 介导的定点突变将载有大鼠β4 亚基DNA 序列的质粒作为模板,与诱导突变引物和Q5 超保真聚合酶体系按比例混合,采用PCR 方法进行定点诱变(图2)。PCR 条件如下:50 μL 体系,95 ℃预变性120 s;随后95 ℃变性20 s,60 ℃退火10 s,68 ℃延伸阶段3 min,共循环18 次;最后68 ℃延伸5 min。PCR 反应完成后,在水浴条件下,在PCR 产物中加入1 μLDpnI,37 ℃反应1 h,水解质粒模板。取少量PCR 扩增产物在1.0 %琼脂糖凝胶中90 V 电压下电泳20 min,观察电泳结果,验证PCR 反应成功。取PCR 产物3 μL 转化DH5α 大肠杆菌感受态细胞,将菌液涂布于含有氨苄青霉素的固体平板培养基上,37 ℃下培养14~18 h。每个平板分别挑取5 个菌落,转入含有氨苄青霉素的LB 液体培养基中,37 ℃、250 r·min-1培养12~14 h,提质粒后用Nanodrop 测定其浓度,并通过1%的琼脂糖凝胶电泳(条件同上)判断其纯度,测序验证插入序列突变情况。

图2 定点突变原理图Fig.2 Strategy for site-directed mutagenesis
1.5 突变体质粒酶切及回收选取测序正确的突变体质粒进行酶切线性化反应。200 μL 酶切反应体系如下:突变体质粒20 μg(40~60 μL),限制性内切酶NheⅠ 10 μL,10×M Buffer 20 μL,剩余体积用ddH2O补齐,37 ℃反应4 h。酶切后使用DNA 纯化试剂盒回收线性化产物。回收的线性质粒使用Nanodrop 测定其浓度,并通过1%的琼脂糖凝胶电泳判断其纯度。
1.6 突变体RNA 的制备将线性突变体质粒作为模版,使用试剂盒法进行体外转录。20 μL 反应体系如下:线性模版2 μg(5~6 μL);2×NTP/CAP 10 μL;10×Rxn Buffer 2 μL;Enzyme Mix 2 μL;剩余体积用无RNA 酶的ddH2O 补齐,37 ℃反应 4~6 h。随后在反应液中加入1 μL Dnase,反应30 min,酶解DNA 模版。使用RNA 纯化试剂盒回收cRNA 产物,Nanodrop 测定其浓度,并通过1%的琼脂糖凝胶电泳验证。
1.7 受体在非洲爪蟾卵母细胞上表达选取状态良好的成熟雌性非洲爪蟾,冰冻麻醉1 h,用手术刀在腹侧剖开小口,取出卵母细胞团块。剪碎团块,使用OR2 溶液清洗至澄清。将卵母细胞转移至含有0.5 g·L-1胶原蛋白酶的OR2 溶液中酶解,室温下反应40~50 min,使其完全分离成为互不粘连的单个细胞,再用OR2 溶液清洗至少10 次后,挑选形态正常饱满的卵母细胞转入含抗ND-96 溶液中,在17 ℃、湿度35%的条件下继续培养。
卵母细胞在获取24 h 后用于显微注射,实验方法参考熊洋等[20]对α6/α3β4 表达研究的优化结果,将野生型或突变型α6/α3 与β4 nAChRs 亚基的cRNA 以1∶1 的比例混合,每个亚基的终浓度≥500 ng·μL-1。将混合后的RNA 以每个59.8 nL 的体积显微注射入非洲爪蟾卵母细胞,在17 ℃、湿度35%条件下继续培养(图3)。

图3 雌性非洲爪蟾及其卵母细胞A:雌性非洲爪蟾;B:手术取出新鲜卵母细胞团块;C:酶解后的卵母细胞。Fig.3 Female Xenopus laevis and oocytesA:Female Xenopus laevis;B:Fresh oocyte masses;C:Oocytes after enzymolysis.
1.8 受体功能检测显微注射后2~5 d 使用双电极电压钳检测卵母细胞上受体的表达情况。设置钳制电压为-70 mV,灌流速度2~4 mL·min-1,记录ACh 刺激细胞产生内向电流的情况。详细过程如下:每个循环总时长60 s,首先给予2 s Ach 脉冲刺激,随后使用含有0.1 g·L-1BSA 的ND-96 缓冲液灌流冲洗,每个记录程序含3 次循环。数据记录软件为pClamp 11.0.3,采样模式为Episodic stimulation,采样频率为Slow 200 Hz。
1.9 数据统计分析使用不同浓度的ACh 作为激动剂(1、10、50、100、250、500 μmol·L-1和1 mmol·L-1)刺激受体通道开放,检测并记录产生的内向电流值。以1 mmol·L-1ACh 刺激产生的内向电流作为基准,计算其他浓度的ACh(1~500 μmol·L-1)刺激通道开放的反应率。每组实验数据至少在不同卵母细胞上重复3~6 次。所得数据导入GraphPad Prism 6.0 软件使用非线性拟合方程:Response%=100/{1+(EC50/[agonist])nH}。式中Response 代表反应率,agonist 代表激动剂的内向电流值,nH 代表Hill 系数,分析拟合并作图。
2 结果与分析
2.1 PCR 诱导的定点突变琼脂糖电泳结果琼脂糖凝胶电泳结果表明,经PCR 后,3 种突变体基因均有条带产生(图4-A 胶孔3、4、5),与线性质粒模板(图4-A 胶孔2)的位置一致,可以将PCR 产物用于转化实验。

图4 定点突变PCR 产物、突变体亚基质粒酶切及转录后cRNA 检测的琼脂糖电泳A.1:野生型rat β4 质粒;2:线性rat β4 质粒;3~5:突变体β4 [S52N,I53V]、β4 [I115V,Q116L]、β4 [K160M,S161T];B.1、3、5、7:突变体β4[S52N,I53V]、[I115V,Q116L]、[K160M,S161T]、野生型β4 亚基质粒;2、4、6:突变体β4 [S52N,I53V]、[I115V,Q116L]、[K160M,S161T]线性质粒;C:1~3:突变体β4 [S52N,I53V]、β4 [I115V,Q116L、β4 [K160M,S161T] cRNA;M1:DL15 000 DNA marker;M:DNA marker IV。Fig.4 Agarose electrophoresis of PCR site-directed mutation products,linear mutant plasmid after digestion and cRNAA.1:Wild-type rat β4 plasmid;2:Linear rat β4 plasmid;3-5:β4 subunit mutant after PCR site-directed mutation [S52N,I53V ],[I115V,Q116L],[K160M,S161T];B.1,3,5,7:Plasmids of β4 subunit mutants [S52N,I53V],[I115V,Q116L],[K160M,S161T] and wild-type subunit;2,4,6 :Linear plasmids of β4 subunit mutant [S52N,I53V],[I115V,Q116L],[K160M,S161T];C:1-3:cRNA of β4 subunit mutant [S52N,I53V],[I115V,Q116L],[K160M,S161T];M1:DL15 000 DNA marker;M:DNA marker IV.
2.2 质粒提取与酶切结果使用质粒提取试剂盒提取突变质粒,所得结果经超微量分光光度计测得浓度(表2)。琼脂糖凝胶电泳结果验证质粒纯度良好。插入基因测序结果使用NCBI 网站中的BLAST 在线序列比对验证,证实3 个突变体质粒均构建成功。将测序正确的β4 突变体质粒与本体质粒分别进行酶切反应,琼脂糖凝胶电泳验证。环状质粒(图4-B 胶孔1、3、5、7)因呈超螺旋结构,在琼脂糖凝胶中空间位阻小,所以移动更快。而线性化的质粒(图4-B 胶孔2、4、6)移动较慢。电泳结果中线性化质粒对应泳道在环状质粒对应位置已无条带,证明酶切完全。经超微量分光光度计测得浓度与A260/280值(表2),均在正常范围内,可进行后续实验。

表2 突变体质粒、线性质粒浓度与A260/280 值Tab.2 Mutant plasmid and linear plasmid concentration and A260/280
2.3 cRNA 的制备测定体外转录获得的cRNA 浓度(表3),均达到500 mg·μL-1。琼脂糖凝胶结果显示,图4-C 中胶孔1、2、3 相同高度均有对应的较为清晰明亮的条带,证明体外转录成功,可用于下一步卵母细胞显微注射。

表3 突变体cRNA 浓度与A260/280 值Tab.3 Mutant cRNA concentration and A260/280
2.4 野生型及突变型α6β4* nAChR 的功能检测使用双电极电压钳对野生型和3 种突变型受体的功能进行检测。α6/α3β4[S52N,I53V]突变型的受体与其他几种相比,表达时间略有提前,在注射后的第3 天即达到正常水平。另外2 种突变型与野生型的受体表达时间无明显的差异,均在第4 天达到正常水平。结果表明,ACh 浓度为1 μmol·L-1时均无电流产生,未达到产生内向电流的最小刺激强度。随着ACh 浓度的增大,受体接受ACh 刺激产生的电流值也随之增大,呈现出先快后慢的变化趋势。对比图5 中A、B、C、D 的电流轨迹图,突变受体与野生型对ACh 的敏感程度相当,可以初步判断,突变并未影响受体的基本结构及功能。当给予相同浓度ACh刺激时,突变型α6/α3β4[S52N,I53V] nAChR 相比于野生型和其他的突变型,电流值明显更大,推测是α6/α3β4[S52N,I53V] nAChR 离子通道的开放水平更高。

图5 野生型和突变型α6/α3β4 nAChR 对不同浓度ACh 的电流图Fig.5 Current traces of wild-type and mutant α6/α3β4 nAChR evoked by different concentrations of ACh
使用Graphpad Prism 6.0 软件对测定结果进行分析,绘制浓度-反应率曲线图,并计算受体对ACh 刺激的EC50。对比图6 中A、B、C 图中的曲线,结果表明,野生型与突变型受体的变化趋势相似。野生型α6/α3β4 nAChR 的EC50是突变型α6/α3β4[S52N,I53V] nAChR 的2 倍(表4),证明52、53 位双点突变,对ACh 的激动活性有一定的提升,使α6/α3β4 nAChR 与ACh 结合后离子通道的开放程度增加。

表4 野生型及突变型α6/α3β4 nAChRs 对ACh 门控的半数有效浓度Tab.4 Median effective concentration (EC50) of wild type and mutant α6/α3β4 nAChRs for ACh stimulation

图6 野生型及突变型α6/α3β4 nAChR 对激动剂ACh 的浓度-反应曲线Mean±SEM,n=3~6。Fig.6 Concentration response curve of wild-type and mutant α6/α3β4 nAChR to the agonist ACh Mean ± SEM,n=3~6.
3 讨论
α6β4*作为一类特殊的nAChRs 受到广泛关注,但含α6 亚基nAChRs 的异源表达却十分困难。烟碱型乙酰胆碱受体与配体结合的主要结构位于细胞膜外的N-端结合域,通过基因改造,构建α6/α3 的嵌合体可以辅助受体正常表达,不影响受体的功能活性。
本研究比较了人类和大鼠的α6 和β4 两种亚基的胞外N-端结合域的序列,发现人类和大鼠α6 亚基的同源性较高,而β4 亚基的种属差异性更大。芋螺毒素是一类作用于nAChRs 的小分子多肽,可以作为分子探针,研究配体与受体结合的关键位点。HONE 等进行了人类(Human)和大鼠(Rat)α6/α3 和β4 亚基的混合表达实验,构建了Hα6/α3Hβ4、Rα6/α3Rβ4、Hα6/α3Rβ4 和Rα6/α3Hβ4 这4 种受体,并选取3 种作用于α6/α3β4 nAChR 的芋螺毒素PeIA、PnIA 和TxIB 作为拮抗剂,分别比较配体对突变受体的阻断作用。结果显示,这3 种芋螺毒素对受体的阻断作用具有一致性,由强到弱依次为Hα6/α3Hβ4>Rα6/α3Hβ4>Hα6/α3Rβ4>Rα6/α3Rβ4。该实验从一定程度上说明β4 亚基对α6/α3β4 nAChR 的配体识别和选择具有重要作用[21]。
本实验利用受体定点突变技术对大鼠β4 亚基非保守残基进行受体突变,将其替换人类β4 亚基相同位置处的残基,对比序列发现有3 处位点均为相邻2 个残基的差异。将2 个差异位点均设计在突变引物内,经一次突变即得到具有相邻2 个残基差异的突变受体,大大缩短了突变体构建的时间,并且为后续大鼠和人类α6/α3β4 nAChR 对芋螺毒素活性差异关键位点的筛选,构建了3 个双点突变体模型。
在对突变体进行电生理活性检测中,电流值的大小和变化趋势与野生型受体均相似,表明受体基本的结构和功能保持不变。而观察ACh 浓度-反应率曲线图,其中1 种突变体α6/α3β4[S52N,I53V]相比于野生型,对ACh 敏感性更高,EC50值仅为本体的一半。并且在标准浓度(100 μmol·L-1)ACh 下,突变体α6/α3β4[S52N,I53V]产生的激发电流值更大。推测可能是由于52 位由丝氨酸变为天冬酰胺后更易形成氢键,而53 位由异亮氨酸到缬氨酸的改变,导致其空间位阻减小,使得在与ACh 结合时,通道的敏感性增加,且开放程度增大。由于在β4 亚基上人类和大鼠还存在其他差异位点,因此,α6/α3β4 nAChR对于激动剂ACh 和拮抗剂芋螺毒素活性的关键氨基酸位点还有待研究。

