利用在线数据库分析乳腺癌中程序性死亡蛋白-1相关信号通路基因的临床意义
陈 路,李习平,胡 爽,戴周彤,何晓宏,王志文*
(1.岳阳职业技术学院 慢性病重点实验室,中国湖南 岳阳 414000;2.湖南师范大学 附属岳阳医院/岳阳市二人民医院,中国湖南 岳阳 414000;3.武汉科技大学 生命科学与健康学院,中国湖北 武汉 430065)
乳腺癌属于全球健康问题,特别是对于女性而言[1~2]。全球癌症观察站指出,乳腺癌致死人数占2018年所有癌症死亡人数的6%,是女性癌症死亡的主要原因[2]。随着乳腺癌患者从阶段0和阶段Ⅰ (100%)、阶段Ⅱ和阶段Ⅲ (分别为93%和72%)到阶段Ⅳ(22%)的加重,其5年生存率大大降低[1~3]。目前,手术和化学疗法被常用于治疗乳腺癌[4~5]。但是,化学疗法的使用已显示出严重的不良情况,包括疼痛、恶心、神经认知功能障碍和心血管疾病等[6~7]。免疫治疗为治疗乳腺癌提供了一种新的方法。早在1983年就有研究发现,T细胞能特异性地识别抗原[8]。但是,1992年Harding等[9]的研究显示,T细胞的活化比以前想象的要复杂得多。例如:在增殖和功能分化的过程中,T细胞活化还刺激了一些抑制途径,这些途径可以减弱甚至消除T细胞应答[9]。现在,人们认识到肿瘤具有抑制抗肿瘤免疫应答的机制,包括细胞因子的产生、免疫抑制细胞的募集和共抑制受体的上调,这些机制被称为免疫检查点[10]。
针对免疫检查点的治疗主要包括两个途径。其一为细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4)和共刺激分子B7。它们的结合能够有效阻断T细胞与抗原呈递细胞(antigen-presenting cell,APC)的相互作用,下调T细胞活化能力,从而降低机体的抗肿瘤免疫力,使癌细胞免除被机体自身免疫系统杀死[11]。T细胞表面分子CD28也是免疫球蛋白相关受体家族的成员,负责T细胞免疫调节的各个方面[12~13]。但是,目前为止针对CD28的治疗还在起步阶段。而针对CTLA-4,在2011年,伊匹木单抗(ipilimumab)就被美国食品药品监督管理局(U.S.Food and Drug Administration,FDA)批准为首个在转移性黑色素瘤中显示总体生存获益的药物,其工作机制为靶向CTLA-4基因,阻断CTLA-4/B7的信号通路,从而使免疫系统识别并杀死癌细胞[14]。第二个主要途径为程序性死亡蛋白-1(programmed death-1,PD-1)。PD-1最早被发现于小鼠的T细胞,最初被认为主要起到活化T细胞等免疫细胞的作用[15~16]。其途径包括PD-1及其配体程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)和PD-L2。研究报道,PD-1不会直接诱导细胞死亡,但会降低细胞生长因子以及存活信号;PDL1/2激活PD-1会诱导T细胞活性下调、细胞因子生成减少、T细胞裂解以及抗原的耐受性增强[17~20]。体内研究表明,PD-L1可增加肿瘤的发生和侵袭性,并使肿瘤细胞对特定CD8+T细胞的敏感性降低[21];使用特异性抗体阻断PD-1/PD-L1途径可导致肿瘤消退[22]。肿瘤细胞通过PD-1的高表达逃脱T细胞的杀伤已成为免疫耐受的机制之一,肿瘤细胞可通过阻断效应子功能并降低T细胞杀伤能力来抑制抗肿瘤免疫反应[23]。在过去的几年中,PD-1和PD-L1的抑制剂,例如纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、阿特珠单抗(atezolizumab)、阿维单抗(avelumab)和德瓦鲁单抗(durvalumab),改变了癌症治疗的格局。这些药物因其在许多癌症治疗中的空前优势而获得FDA批准,包括黑色素瘤、肺癌、尿路上皮癌、肾细胞癌和头颈癌等[24~30]。考虑到乳腺癌在女性中的高发生率、高转移性以及PD-1/PD-L1阻断剂在其他癌症中的成功应用,在乳腺癌中使用其抑制剂似乎是一种合理的方法。
本研究旨在通过集成的大型数据库,系统地研究乳腺癌患者PD-1相关信号通路的关键因子的表征:从表达模式到预后价值以及潜在的临床病理学应用,以协助PD-1相关信号通路的药物在乳腺癌中的应用。
1 材料与方法
1.1 数据采集
所有病人的表达数据与临床数据都是通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库、GTEx(Genotype-Tissue Expression)数据库和Oncomine数据库获得。GTEx数据库是对健康人提供的组织进行RNA-seq测序的表达谱数据库(https://www.gtexportal.org/)。TCGA数据库包括33种癌症的基因表达谱数据以及对应的临床信息(https://portal.gdc.cancer.gov/)。Oncomine是在线癌症微阵列数据库,是可对全基因组表达进行分析的在线工具(https://www.oncomine.org/)[31]。
1.2 基因的表达分析
为了分析PD-1信号通路相关基因在33种肿瘤中的表达情况,我们访问了Oncomine在线数据库并可视化了基因表达。对于TCGA和GTEx数据库获取的数据,使用基因表达谱交互分析(Gene Expression Profiling Interactive Analysis,GEPIA)作为可视化工具(http://gepia.cancer-pku.cn/)[32],数据获取中以 PD-1、PD-L1、CTLA-4、B7 和CD28作为关键词,乳腺癌作为癌症类型。对于Oncomine数据库,以 PD-1、PD-L1、CTLA-4、B7 和 CD28 作为关键词,以差异倍数(fold change,FC)的绝对值和表达差异P<0.05作为筛选条件。
1.3 目标蛋白质的免疫组化图像分析
人类蛋白质图谱(The Human Protein Atlas,HPA)数据库整合了人类组织和癌症中蛋白质的免疫组织化学图像(http://www.proteinatlas.org/)[33]。文中以PD-1和B7为关键词,从HPA下载了乳腺癌和正常组织中目标蛋白质的免疫组织化学结果。
1.4 基因的临床表达特征分析
UALCAN(http://ualcan.path.uab.edu/)是用于深入分析TCGA数据的工具,用于验证目的基因表达水平的差异[34]。文中以 PD-1、PD-L1、CTLA-4、B7和CD28作为关键词,乳腺癌作为癌症类型,分析了PD-1信号通路相关基因表达水平与基于美国癌症联合委员会的乳腺癌分期及患者年龄的关系。
1.5 基因的预后价值分析
使用GEPIA数据库,按照目的基因表达的中位数将其分为高表达组与低表达组,绘制Kaplan-Meier生存曲线[32]。
1.6 蛋白质互作网络分析
STRING数据库(https://string-db.org/)常被用于预测和分类协调基因所编码蛋白质之间的相互作用[35]。设置STRING数据库中置信区间的标准为≥0.900,获取PD-1信号通路相关基因所编码蛋白质的相互作用关系网络。同时,使用GEPIA工具进一步分析PD-1信号通路相关基因与预测蛋白质之间的表达相关性。
1.7 数据分析
采用t检验评估PD-1信号通路相关基因在不同组中的表达差异。使用Spearman相关分析探讨PD-1信号通路相关基因表达与预测蛋白质之间的相关性。生存曲线是根据对数秩检验通过Kaplan-Meier方法生成的。P<0.05被认为具有统计学意义。
2 结果
2.1 PD-1信号通路相关基因在泛癌中的表达
为了分析PD-1信号通路相关基因在泛癌中的表达情况,使用Oncomine在线数据库分析了相关癌症和正常组织之间的mRNA差异,结果如图1所示。对于PD-1信号通路相关基因PD-1、PD-L1、B7、CTAL-4 和 CD28,Oncomine数据库分别包含 293、176、329、303和 329个独立研究。有趣的是,除了膀胱癌以外,上述5个基因在大多数癌症类型中表达上调。进一步的分析发现,在乳腺癌组织中,以上5个基因的表达显著增加,而且PD-1和B7表达升高的研究数量多于任何其他癌症类型。

图1 PD-1信号通路相关基因在Oncomine数据库中的表达情况红色代表与正常组织相比,在癌症中表达上升。蓝色代表与正常组织相比,在癌症中表达下降。数字代表具有统计学意义的数据集的数量。Fig.1 Expression of PD-1 related signal pathway genes based on Oncomine databaseRed represents increased expression in cancer compared with normal tissues.Blue represents decreased expression in cancer compared with normal tissues.The number represents the number of statistically significant data sets for the study.
2.2 PD-1信号通路相关基因在乳腺癌中的表达
使用UALCAN工具从TCGA数据库查询相关基因在乳腺癌中的表达水平。针对1 097个乳腺癌组织和114个正常乳腺组织的分析结果如图2所示,与正常乳腺组织相比,乳腺癌组织中PD-1、B7和CTLA-4的表达显著增加(P值分别为1.624×10-12、1.000×10-12和 5.350×10-8);令人惊奇的是,CD28的结果无统计学意义(P=0.881),而PD-L1的RNA-seq表达则下调(P=0.049)。结合Oncomine数据库中的mRNA数据结果,我们推测PD-1、B7和CTLA-4的表达可能对乳腺癌有重要影响。
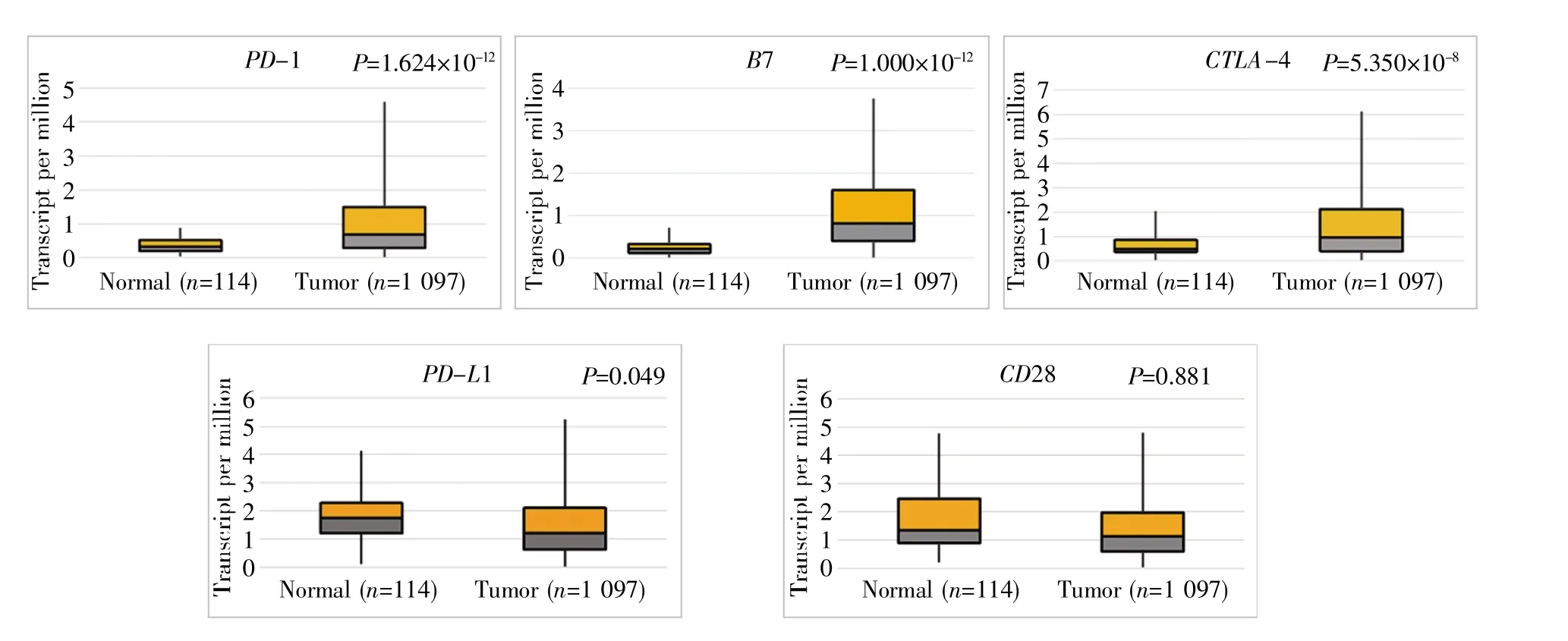
图2 PD-1信号通路相关基因在乳腺癌中的表达Fig.2 Expression of PD-1 signaling pathway-related genes in breast cancer
为了验证PD-1、B7和CTLA-4的表达在临床中的潜在应用,我们从人类蛋白质图谱中提取了特征化的免疫组织化学图像。令人遗憾是,数据中没有与CTLA-4相关的免疫组织化学图像。PD-1与B7的免疫组织化学图像如图3所示,在正常的乳腺组织中,细胞核呈现不均匀的阳性染色,且混合模式较弱,相对表达量较低;但是在乳腺癌组织中,PD-1的表达存在明显的区别,且相对表达量较高,而B7的表达无显著差异。
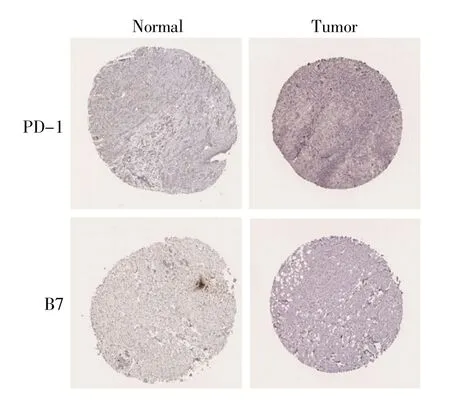
图3 PD-1和B7在乳腺癌中表达的典型免疫组化图像Fig.3 Typical immunochemistry images of PD-1 and B7 expression in breast cancer
2.3 PD-1信号通路相关基因在乳腺癌中的病理特征
为了进一步探讨PD-1信号通路相关基因PD-1、B7和CTLA-4在乳腺癌中的病理特征,使用UALCAN数据库分析了它们在乳腺癌中的表达与不同阶段、年龄及亚型的关系。从图4可知,PD-1、B7和CTLA-4的表达与患者乳腺癌所处阶段和年龄均无关(P≥0.05),说明PD-1、B7和CTLA-4在所有分期及年龄段的乳腺癌患者体内表达上升。从图5可知,与正常组织相比,PD-1、B7和CTLA-4在luminal A型乳腺癌、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)阳性乳腺癌和三阴性乳腺癌(triple negative breast cancer,TNBC)3种乳腺癌细胞亚型中的表达量都有显著变化;并且,B7和CTLA-4在TNBC亚型中显示出最高的表达,预示PD-1信号通路相关基因在TNBC的发生发展中扮演着重要的角色。
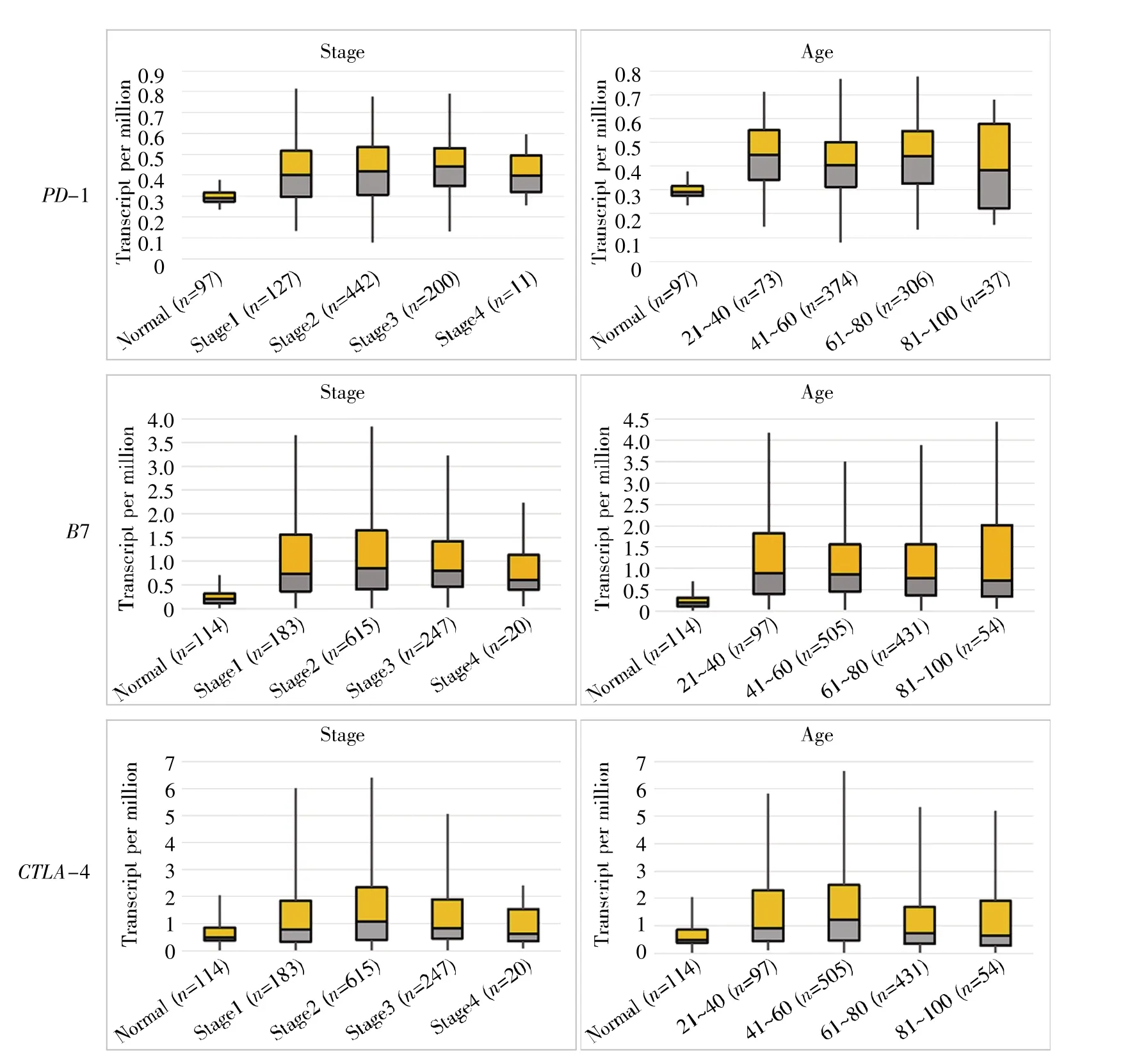
图4 PD-1信号通路相关基因的表达与乳腺癌分期和患者年龄的关系Fig.4 The relationship between the expression of PD-1 signaling pathway-related genes and breast cancer stage and patient age

图5 PD-1信号通路相关基因在乳腺癌亚型中的表达分析Fig.5 Expression of PD-1 signaling pathway related genes in breast cancer subtypes
2.4 PD-1信号通路相关基因在乳腺癌中的预后
迄今为止,除了PD-1外,人们对于乳腺癌中PD-1信号通路其他相关基因的表达水平或其可能的预后价值所知甚少。为了系统研究PD-1信号通路相关基因的表达与预后之间的关系,通过GEPIA工具根据其mRNA表达进行了Kaplan-Meier生存分析。结果如图6所示,CTLA-4、CD28、B7和PD-L1的结果不具有统计学意义,只有PD-1的结果具有显著性差异,其高表达组具有更好的总体生存率。
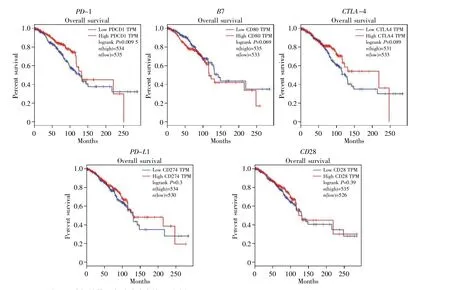
图6 PD-1信号通路相关基因在乳腺癌中的预后分析Fig.6 Analysis of correlation between PD-1 signaling pathway related genes and breast cancer prognosis
2.5 PD-1信号通路相关蛋白质的相互作用网络
为了更好地研究PD-1信号通路相关蛋白质的功能与其作用机制,使用STRING数据库预测与其相互作用的蛋白质网络。根据设定的预测结合阈值,结果如图7所示,预测到的互作蛋白质共有21个,其中多数蛋白质已有报道,例如CD4、CD3G及CD274。它们参与T细胞活化、淋巴细胞活化、白细胞迁移、T细胞凋亡、耐受诱导和细胞溶解等[15~16,36]。通过计算PD-1与其预测结合蛋白质的相关系数,我们发现正负相关系数最高的蛋白质为非受体型蛋白质酪氨酸磷酸酶6(protein tyrosine phosphatase non-receptor type 6,PTPN6)。但是,PTPN6与PD-1信号通路相关蛋白质之间相互作用的具体方式尚没有阐明。基于此,我们通过GEPIA数据库分析了PD-1与PTPN6的相关性。图8的分析结果显示,PD-1的表达与PTPN6呈正相关,与PTPN11呈负相关,而PTPN家族主要在各种受体和细胞质蛋白质酪氨酸激酶的下游起作用,参与从细胞表面到细胞核的信号转导,因此推测PD-1可能还通过PTPN家族影响细胞的其他功能。

图7 PD-1信号通路相关蛋白质与其预测结合蛋白质间的相互作用网络Fig.7 The interaction network between PD-1 signaling pathway related proteins and their predicted binding proteins
3 讨论
众所周知,肿瘤及其微环境可以影响癌细胞的侵袭、增殖和转移功能[37~39]。尽管临床已经将许多化学疗法及外科手术应用于癌症的治疗,但是人们仍然认为人类的免疫系统是抵抗癌症最基本的、有效的武器[40]。通过抑制免疫检查点PD-1和PD-L1来治疗癌症是细胞毒性免疫反应最关键的生物学手段之一,其抗体已获得FDA前所未有的快速授权[41~42]。然而,PD-1/PD-L1的抑制剂并不是对每个个体都有效,这就需要对PD-1及其信号通路相关基因调控的特定机制有全面的了解[43]。
在先前的研究中,研究基因的表达往往需要大量的基础实验,存在时间周期较长和样品数量过少的缺点。生物信息学的出现为我们研究基因的表达提供了新的工具。大量研究显示,生物信息已经被广泛地应用于基因在正常组织与癌症组织中的表达分析,以及基因表达与患者生存的研究。Ge等[44]通过荟萃分析TCGA的数据发现,雌激素受体α和β在胃癌中异常表达,并且,雌激素受体β的高表达与淋巴结转移呈负相关,雌激素受体α的表达可能与胃癌患者的预后不良有关。Qin等[45]通过TCGA数据库分析发现,USP37(ubiquitin-specific peptidase 37)在乳腺癌组织中的表达升高,其过表达与死亡率增加密切相关;进一步的GSEA分析显示,在TCGA乳腺癌样品中,USP37的表达与细胞生长和转移呈正相关,而与细胞凋亡呈负相关。需要指出的是,以上生物信息学分析均得到了该研究团队的实验验证。基于生物信息学分析的高效性、可靠性,为了探讨PD-1信号通路相关基因在癌症中的意义,本研究使用Oncomine数据库,首先揭示了包括乳腺癌等在内的不同癌症中PD-1信号通路相关基因在mRNA水平上的表达,发现 PD-1、PD-L1、B7、CTLA-4和CD28在多数癌症中表达上调(图1)。为了验证结果的准确性,使用TCGA数据库从mRNA水平对上述5个基因在乳腺癌中的表达进行了分析,发现除了PD-L1与CD28,其他基因的表达趋势与Oncomine结果一致(图2)。然而,TCGA数据库是通过提取肿瘤组织的全部RNA进行芯片测序的结果。因此,基于我们的发现,进一步从HPA数据库中提取了相关蛋白质的免疫组织化学图像(图3),以验证TCGA数据库的分析结果。基因的临床表达特征分析显示,PD-1通路相关基因的表达与乳腺癌不同临床阶段和年龄均无关(图4),说明PD-1通路相关基因具有作为潜在标记物来治疗乳腺癌的可行性。但是,这部分结论还需要通过收集大量的数据进行验证。此外,蛋白质-蛋白质互作网络分析显示,PD-1通路相关基因可以通过多种途径参与T细胞活化的生物学过程、淋巴细胞活化的调节、T细胞活化的调节和白细胞迁移(图7),其中有的途径已经被验证,有的尚待发现。
在免疫治疗中,PD-1/PD-L1作为免疫检查点通常被上调,以创建免疫抑制性肿瘤微环境,并帮助癌细胞逃避免疫介导的破坏[46]。先前的研究表明,PD-1通路相关基因与预后之间的相关性在不同类型的肿瘤之间是不同的[47~50]。值得注意的是,在弥漫性大B细胞淋巴瘤中,低PD-1+的病人预后更差[51],而在肝内胆管癌患者中,PD-1的表达会对患者的生存产生负面影响[52]。在本研究中,通过使用TCGA数据库中乳腺癌的生存数据,我们发现在PD-1信号通路相关基因中PD-1的表达与乳腺癌患者的生存情况呈正相关性(图6)。研究显示,在127例原发性乳腺癌中,PD-L1的高表达与良好临床预后相关[53]。另一项针对乳腺癌患者的研究表明,PD-L1的表达与CD8+T细胞呈正相关,并具有良好的临床效果[54]。但是,也有报道指出,PD-L1的高表达与三阴性乳腺癌患者的预后较差有关,这抵消了肿瘤浸润淋巴细胞的作用[55]。与上述报道不同,本研究尚未发现PDL1的表达与乳腺癌患者生存的关系(图6)。迄今为止,PD-1是否可预测乳腺癌患者的预后仍在争论中。我们的研究为以后开展基于PD-1信号通路相关的基因治疗提供了新的理论支持。但是,由于TCGA与Oncomine中主要的患者为美国生活的白种高加索人,黄色人种与黑色人种的数据量较少。因此,往后还需大量收集不同肤色、人种乳腺癌患者的预后和PD-1信号通路相关基因的表达数据,进一步确认PD-1信号通路相关基因的表达与乳腺癌患者预后的关系。
4 结论
在本研究中,我们探讨了PD-1信号通路相关基因在泛癌中的表达,发现PD-1、PD-L1、B7、CTLA-4和CD28在包括乳腺癌在内的大多数癌症中表达上升;并通过对TCGA数据库的临床信息与表达信息的挖掘,证实上述5个基因在乳腺癌中表达异常,其中PD-1的表达结果通过HPA数据库中的免疫组化图像得到了验证。同时,数据分析发现,B7和CTLA-4在TNBC乳腺癌亚型中表达最高;蛋白质互作网络分析显示,PD-1/PD-L1信号通路与多种蛋白质存在结合的可能性;相关性分析发现,PD-1表达与PTPN家族多个靶点蛋白质的表达有关。此外,基于乳腺癌患者临床生存数据的Kaplan-Meier生存曲线显示,PD-1高表达的乳腺癌患者的预后更好。