IGF-1预处理对大鼠心肺复苏术后脑水肿及炎症反应的影响*
陆辉志,李 伟,董 辉,曹 松,杨璐瑜,廖友霞,付守芝
(武汉大学附属同仁医院/武汉市第三医院急诊与重症医学科,湖北 武汉 430060)
在全球范围内,心脏停搏(cardiac arrest,CA)仍是导致死亡的主要原因[1]。近年来,随着心肺复苏技术(cardiopulmonary-cerebral resuscitation,CPR)的进步,CA患者恢复自主循环的比率有所提升,但幸存者通常发生严重的神经功能障碍[2-3]。复苏后患者出现神经功能障碍的病理生理机制极其复杂,其中,心搏停止后脑缺氧导致的水肿及炎症反应具有重要的致病作用。
胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)是一个多效能激素,具有神经营养因子的作用,在神经细胞的生长、增殖、迁移及神经发生中发挥重要作用[4]。本研究将探讨IGF-1对心肺复苏大鼠脑水肿及炎症反应的影响。
1 材料与方法
1.1 主要试剂与仪器
IGF-1:上海肯强贸易有限公司;TNF-α、IL-1β、IL-6及IL-10 ELISA检测试剂盒:武汉博士德生物技术有限公司;MPO检测试剂盒:武汉博士德生物技术有限公司;p-p65抗体及GAPDH抗体购自美国CST公司;多功能自动酶标仪购自美国MolecularDevices公司;高速台式离心机购自美国Beckman公司;Westernblot仪器购自美国Bio-Rad公司;水浴恒温摇床(SHY-2,江苏),紫外分光光度计(CE 2041,英国),呼吸机(HX-200)及BL-420E+生物机能试验系统(泰蒙公司,成都)。
1.2 实验动物及分组
36只清洁级雄性成年SD大鼠,体重250~300g,购自上海斯莱克实验动物中心[许可证号:SCXK(沪)2017-0005],随机分为3组:假手术组(Sham组)、心脏停搏/心肺复苏组(CA/CPR组)和IGF-1处理组(IGF-1组),每组各12只。相关动物实验内容已通过武汉市三医院动物实验伦理委员会审查。动物饲养在温度、湿度相对恒定的SPF级动物房内[温度(24±2)℃、湿度(55±5)%],12h昼夜交替,自由进食水,术前禁食水8h。
1.3 模型制备及实验干预
2%戊巴比妥钠50mg/kg腹腔注射麻醉大鼠,仰卧位固定,标准肢体导联监测心电图。气管切开插管;分离右颈动脉,接多导心电监护仪监测平均动脉压(mean arterial pressure,MAP);分离右侧股静脉,24号留置针穿刺置管,肝素封管备用,稳定10min后开始试验。IGF-1组经股静脉置管给予IGF-1,以40ng/g的剂量给药[5],Sham组及CA组给予等同剂量的生理盐水。给药30min后于呼气末夹闭气管导管,通过窒息诱导心脏骤停。心脏骤停标准为:心电图示心电静止、室颤、心电机械分离;心尖区心脏搏动消失或MAP低于20mmHg[6]。心搏停止6min后开始心肺复苏,以食指按压胸部,200次/min;同时恢复机械通气,呼吸频率为50次/min,潮气量6mL/kg,吸氧浓度100%;经股静脉注射肾上腺素(0.01mg/kg);如有必要,给予电除颤(5J)。如第一次除颤后不能恢复自主心跳,则在30s后重复一次。CPR成功标准:心电图出现正常的QRS波群,可触及到明显的心脏搏动或MAP升至60mmHg以上。如心肺复苏5min未成功,则停止复苏,宣告死亡。复苏成功后继续给予生命支持治疗。24h后取脑组织,-80℃冰箱保存。
1.4 检测指标
1.4.1 湿-干重比值法测定脑组织含水量
取适量脑组织,吸水纸吸干多余的水分,称重,记为湿重;将脑组织放在100℃的烤箱中48h,烤至恒重,再次称重,记为干重。脑含水量计算方法为:(湿重-干重)/湿重×100%。
1.4.2 MPO活性检测
取适量脑组织,加入50mmol含0.5%十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,HETAB)的PBS溶液(pH6.0),超声波裂解匀浆,41 000g离心10min。取上清0.3 mL,加入2.3mL反应混合物,反应混合物含50mmol PBS、联甲氧基苯胺和20mmol H2O2溶液。在460nm处测量吸光度值,MPO活性以U/g蛋白表达[7]。
1.4.3 ELISA检测脑组织中炎症因子含量
严格按照试剂盒说明书,采用ELISA试剂盒检测脑组织中炎症因子TNF-α、IL-1β、IL-6及IL-10(武汉博士德生物技术有限公司,武汉,中国)水平。取适量脑组织,加入RIPA裂解液及蛋白酶抑制剂,超声波破碎仪匀浆,4℃ 12 000g离心10min,取上清。测定OD值,根据标准曲线将OD值转换为浓度值。
1.4.4 Western blot分析
取脑组织100mg,使用蛋白提取试剂盒提取蛋白,BCA法测蛋白浓度,以30μg蛋白上样量计算上样体积。加上样缓冲液,十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,转移蛋白至PVDF膜,5%脱脂奶粉封闭2h,加入p-p65及GAPDH一抗(均为兔抗,1∶1 000,CST公司),4℃孵育过夜。TBST洗膜后加入对应的二抗,室温孵育1h,ECL试剂发光显色,拍照,ImageJ软件分析测定条带灰度值。以目的蛋白条带灰度值与GAPDH条带灰度值的比值反映目的蛋白表达水平。
1.5 统计学方法
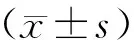
2 结 果
2.1 各组大鼠脑组织含水量的比较
与Sham组相比,CA/CPR组及IGF-1组脑组织含水量显著升高(P<0.05);与CA组相比,IGF-1组脑组织含水量显著降低(P<0.05)。见图1。
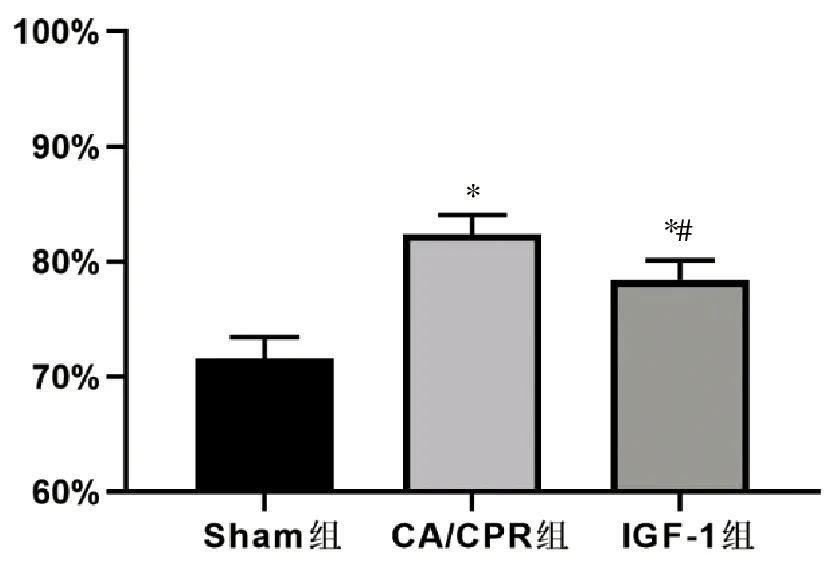
与Sham组相比,*P<0.05;与CA/CPR组相比,#P<0.05,(n=12)
2.2 各组大鼠脑组织MPO活性的比较
CA/CPR组及IGF-1组MPO活性显著高于Sham组(P<0.05),与CA/CPR组相比,IGF-1组MPO的活性显著降低(P<0.05)。见图2。
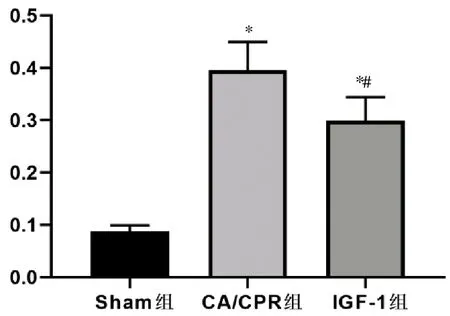
与Sham组相比,*P<0.05;与CA/CPR组相比,#P<0.05,(n=12)
2.3 各组大鼠脑组织炎症因子含量的比较
与Sham组相比,CA/CPR组及IGF-1组中炎症因子TNF-α、IL-1β及IL-6的含量均显著升高;而与CA/CPR组相比,IGF-1组中3种炎症因子含量降低,差异有统计学意义(P<0.05)。而脑组织中IL-10的表达量与此相反,Sham组大鼠脑组织中IL-10的含量相对较高,与Sham组相比,CA/CPR组及IGF-1组IL-10的含量均显著降低(P<0.05),但与CA/CPR组相比,IGF-1组中IL-10含量显著升高(P<0.05)。见表1。

表1 各组大鼠脑组织炎症因子比较
2.4 各组大鼠脑组织p-p65表达量的比较
与Sham组相比,CA/CPR组及IGF-1组p-p65的表达量增加(P<0.01),而IGF-1组的表达水平较CA/CPR组显著降低(P<0.05)。见图3。
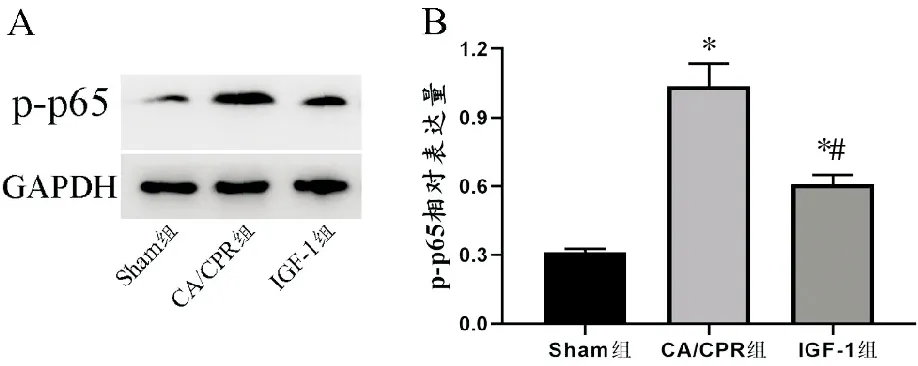
A.Westernblot典型条带图;B.p-p65相对表达量(与Sham组相比,*P<0.05;与CA/CPR组相比,#P<0.05)
3 讨 论
CA/CPR术后脑保护一直是世界性难题,也是研究的重点和难点,减轻CPR术后脑水肿及炎症反应对于改善幸存者预后具有重要意义。IGF-1是一种多效能激素,具有重要的生理学功能。近年来发现,IGF-1具有神经保护及神经修复作用[8];Yang等[9]的研究表明,缺血性卒中可导致血循环中IGF-1含量减少,而经静脉给予IGF-1后,缺血脑组织及海马、大脑皮质中IGF-1水平明显升高,同时观察到大鼠的神经功能、认知功能及脑水肿得到明显改善。本研究采用CA/CPR模型,通过测定湿/干比并进行ELISA、Western blot等相关检测,验证了IGF-1能减轻大鼠CPR后脑水肿及炎症反应。
脑损伤是CA和心肺复苏CPR幸存者致病致死的重要原因,而CA/CPR术后脑水肿是幸存者脑损伤的重要表现,CA/CPR术后脑水肿通常提示预后不良。脑水肿可分为细胞毒性脑水肿和血管源性脑水肿,脑缺血主要导致细胞毒性脑水肿,而血管源性脑水肿通常出现在再灌注恢复以后[10]。CA/CPR引起全身组织器官缺血再灌注损伤,也称心脏停搏后综合征,既可导致细胞毒性脑水肿,又可引起血管源性脑水肿。弥漫性脑水肿可加重CA/CPR患者的脑损伤,且通常提示预后不良。本研究结果显示,CA/CPR后大鼠脑组织含水量显著增加;而IGF-1预处理则显著降低了大鼠脑组织含水量,从而验证IGF-1能改善CA/CPR后脑水肿,发挥脑保护作用。
MPO是中性粒细胞分泌的活性酶,它是中性粒细胞浸润及活化的重要标志。心脏停搏后血液循环中断,全身组织器官灌注不足,组织缺血必将导致氧化应激损伤进而产生大量炎症介质。复苏成功后,随着血供恢复,缺血期产生的炎症介质由损伤部位释放入血循环,损伤血管内皮细胞,致使血管通透性增加,中性粒细胞浸润。研究表明[11-12],脑缺血将激活中性粒细胞,导致MPO活性升高,本研究结果与此一致,CA/CPR组大鼠脑组织MPO活性较Sham组显著增加,而IGF-1干预则显著降低了MPO的活性。
缺血再灌注损伤是CA/CPR的重要机制之一,脑供血中断导致脑组织氧供及能量供应不足,激活炎症通路,导致炎症介质的产生和释放,炎症反应进一步加剧CA/CPR后脑损伤。在CA及自主循环恢复(return of spontaneous circulation,ROSC)以后,白细胞、内皮细胞和组织细胞通过一系列信号转导通路感知损伤,释放大量细胞因子,进一步放大局部和全身反应[13]。本研究也证实,CPR组出现强烈的炎症反应,表现为ROSC后脑组织中促炎细胞因子TNF-α、IL-1β及IL-6表达显著升高,而抗炎细胞因子IL-10则明显下降,IGF-1干预则在一定程度上逆转了这一结局。由此表明,IGF-1预处理能抑制CPR后脑组织炎症反应。
NF-κB是重要的炎症信号通路,在生理情况下处于非活化状态,一经活化可调控多种炎症因子的表达。心脏停搏后,全身组织器官灌注减少,引起组织缺氧,进而激活NF-κB并使其转移到细胞核,促进炎性细胞因子的转录和翻译。先前研究表明[12-13],CA/CPR后NF-κB通路激活。本研究结果与此一致,CPR后脑组织中p-p65表达量增多,而IGF-1预处理则明显抑制了NF-κB通路的激活。
综上所述,本研究结果表明,IGF-1预处理能减轻CA/CPR后脑水肿及脑炎症反应,发挥脑保护作用,其机制可能与抑制NF-κB通路有关。

