小黄鱼figlα 基因的克隆及其在性腺中的表达分析
李冰冰,谢庆平,楼 宝,魏福亮,蔚 敏,詹 炜,刘 峰
(1.浙江海洋大学水产学院,浙江舟山 316022;2.浙江省农业科学院水生生物研究所,浙江杭州 310021)
figlα(figlalpha)基因是卵母细胞特异性基因,它是碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)家族中的一员,最初是通过参与编码糖蛋白(Zp1,Zp2 和Zp3)基因的协调表达而被发现的,其对动物的生殖发育调控起着重要的作用[1]。bHLH 结构域是一种特殊的DNA 结构蛋白,通常以二聚体的形式与DNA 上E-box 序列结合,进而参与发挥其转录功能[2]。bHLH 家族成员可调控许多发育和代谢过程,包括性别决定、细胞分化等[3-4]。目前,figlα 基因已在许多动物中得到研究,如智人Homo sapiens、小鼠、牛、鱼、中华鳖Trionyx sinensis 等[5-10]。figlα 基因是第一个被发现能够影响原始生殖细胞卵泡形成的转录因子之一,其在大多数脊椎动物的卵泡形成及卵巢的发育和分化中起着重要作用[5-6,11]。卵巢组织最基本的组成单位是原始卵泡,原始卵泡的正常发育将直接影响卵巢的繁育功能,figlα 基因的缺失会导致原始卵泡的残缺和卵母细胞的大量损失[6]。在小鼠中,figlα 基因突变破坏了雌性小鼠的卵泡发育,并导致不育[6,11],figlα 基因的敲除使其不能形成原始卵泡,且出生后卵母细胞迅速消失,但雄性性腺则不受影响[6]。在人类中,figlα 基因突变导致卵巢早衰(premature ovarian failure,POF)[12-13]、不孕等[2,14]。因此,figlα 基因在动物的卵巢发育及卵子发生过程及性别分化中起着重要的调控作用。
在硬骨鱼类中,figlα 基因对卵巢/卵母细胞的分化也起到至关重要的作用,如黑鲷Acanthopagrus schlegeli、斑马鱼Danio rerio、青鳉Oryzias latipes、尼罗罗非鱼Oreochromis niloticus 等[9,15-17]。其中,斑马鱼时空表达结果显示,在10~20 dph(days post-hatching,dph)时,figlα 在卵巢和精巢中均无表达,但在成年斑马鱼中,figlα 在卵巢和精巢中特异性表达,而在其他组织中不表达。同时,原位杂交结果显示,figlα 在斑马鱼26、60 和110 dph 时均检测到信号,26 dph 时figlα 集中表达于分离良好的PN 卵母细胞的胞浆中,在60和110 dph 时,figlα 在初级生长期和卵黄发生前期的PN 卵母细胞表达量最多,尤其是在PG 期,但使用正义探针的对照组未观察到任何信号[15]。然而,在罗非鱼中,Real-time PCR 技术结果显示,figlα 在罗非鱼30 dph 时开始表达[17]。同时,与黑鲷和青鳉研究结果一致[9,16],figlα 主要在罗非鱼成鱼的卵巢中表达,而在其他组织中几乎不表达,免疫组化结果也与此一致,figlα 在90 和150 dph 罗非鱼的卵巢早期初级卵母细胞中特异表达。此外,在尼罗罗非鱼中,figlα 基因的过度表达导致精子发生受阻,进而促进卵巢发育[17]。因此,figlα 可能在卵巢发育中发挥重要作用。
小黄鱼Larimichthys polyactis,又名小鲜、黄花鱼等。属硬骨鱼纲Osteichthyes、鲈形目Perciformes、石首鱼科Sciaenidae、黄鱼属Larimichthys[18]。它不仅是我国重要的海产经济鱼类,而且肉质细嫩鲜美,营养价值很高,深受消费者喜爱,具有广泛的养殖前景和市场开发潜力[19-20]。因此,国内外学者对其开展了许多研究,研究领域主要涉及小黄鱼种群划分、生长繁殖、摄食习性等诸多方面[21-24],但有关生殖发育的研究甚少。小黄鱼已于2016 年成功实现了全人工繁育养殖[25-26],最近的研究表明,小黄鱼精巢在性别分化过程中经历了一个特殊的阶段,即精巢在性腺发育早期(43~80 dph)出现了一个短暂的雌雄同体阶段,出现卵母细胞,随即便完全凋亡退化,而卵巢发育较为连续[27]。但卵母细胞在精巢中产生与凋亡的分子机制还不清楚,推测该阶段的产生与卵母细胞分化因子figlα 有关。因此,本研究对小黄鱼figlα 基因CDS 区进行克隆和序列分析,通过RT-PCR 方法检测figlα 基因在小黄鱼不同组织中的分布,并利用原位杂交探明小黄鱼figlα在小黄鱼卵巢、精巢及雌雄同体阶段中的细胞定位。本研究既为figlα 基因在小黄鱼卵巢卵母细胞发育和分化的调控机制及精巢特殊的雌雄同体阶段产生的分子机制提供实验数据,也丰富了硬骨鱼类雌雄同体和雌雄异体进化方向及性别分化的理论。
1 材料与方法
1.1 实验材料
本研究实验用小黄鱼于2020 年6 月至2020 年9 月取自浙江省宁波市象山港湾水产苗种有限公司的养殖车间,随机将约300 尾30 dph(平均体质量0.17 g、体长2.01 cm)的小黄鱼鱼苗,饲养于容积为1 t 的深蓝色、桶壁光滑的水桶中,每日2 次,定时、饱食。本实验的水温使用自然水温,水温的范围为20.2~28.5 ℃,盐度为22.4~25.2,供氧充足。为保持水桶的水质,实验中每天更换2 次60%~70%的水量,并每日观察鱼的状况。分别对60 dph(平均体质量3.08 g、体长5.5 cm)、90 dph(平均体质量10.56 g、体长8.81 cm)和150 dph(平均体质量15.15 g、体长10.35 cm)体质良好的小黄鱼随机取样,其中实验用雌鱼和雄鱼分别为15 尾。
对随机采集的小黄鱼活体进行形态学指标的测量,随后立即解剖,取出性腺,鉴定其性别,将同一尾鱼的两叶性腺分开保存,其中一叶性腺迅速放至液氮保存备用,另外一叶性腺放入4%多聚甲醛(PFA)中固定过夜后,转入焦碳酸二乙酯(DEPC)配制的70%乙醇中,用于石蜡切片原位杂交的实验。此外,选取240 dph的小黄鱼雌雄各6 尾分别进行卵巢、精巢、心脏、肝脏、肌肉、肾、皮肤、脑、眼、肠、鳃和脾组织的取样,并迅速放至液氮用于总RNA 提取。随机选取其中雌雄各1 尾进行组织分布检验,剩余样品进行验证。
1.2 总RNA 的提取及第一链cDNA 的合成
使用RNAiso Plus(TaKaRa,日本)试剂,按照说明书提取小黄鱼卵巢、精巢、心脏、肝脏、肌肉、肾、皮肤、脑、眼、肠、鳃和脾组织的总RNA。并用超微量紫外可见分光光度计(NanoDrop2000,Thermo)检测RNA 的浓度和质量,使用浓度为2%的琼脂糖凝胶电泳,检测样品总RNA 的纯度及完整性,电泳条件为180V,15 min。按照反转录试剂盒(TaKaRa,日本)说明书合成相应的第一链cDNA,并保存于-20 ℃备用。
1.3 小黄鱼figlα CDS 扩增及克隆
小黄鱼全基因组序列由北京诺禾致源科技股份有限公司测序获得,根据小黄鱼全基因组序列使用Snap Gene v4.1.9 软件设计扩增引物Figlα-F 及Figlα-R(表1)。以反转录得到的小黄鱼卵巢cDNA 样本为模板,采用RT-PCR 方法扩增小黄鱼figlα 基因全长CDS 区。PCR 扩增反应体系(20 μL)为:ddH2O 8 μL,2×Taq PCR Master Mix 10 μL,上、下游引物各0.5 μL,cDNA 模板1 μL。PCR 反应条件为:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,32 个循环,72 ℃延伸8 min,4 ℃保存。用2%的琼脂糖凝胶电泳检测PCR 产物,电泳条件为120 V,30 min。出现单一且明亮条带,确定产物后,在切胶仪的紫外灯下切割目的产物,之后用SanPrep 柱式DNA 胶回收试剂盒(擎科,杭州)回收目的产物,并克隆至pMD19-T载体,由杭州擎科生物技术有限公司测序。
1.4 序列分析
根据克隆测序所得到的小黄鱼figlα 基因CDS 序列,使用软件Snap Gene v4.1.9 进行拼接和对比,得到小黄鱼figlα 基因完整的CDS 序列。通过NCBI 数据库中的BLAST 工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi),在不同物种间进行同源性检测。用Expasy 在线软件对小黄鱼figlα 基因编码的蛋白特性进行分析(https://web.expasy.org/protparam/),用Net NGlyc 1.0 在线预测小黄鱼figlα 潜在的糖基化位点(http://www.cbs.dtu.dk/services/NetNGlyc/),用在线软件预测小黄鱼figlα 基因跨膜区(http://www.cbs.dtu.dk/services/TMHMM/)和信号肽(http://www.cbs.dtu.dk/services/SignalP-4.1/),用Motif Scan 在线预测figlα 基因特征序列(https://myhits.sib.swiss/cgi-bin/motif_scan/),用Clustalw 在线进行小黄鱼与其他物种氨基酸多序列比对(https://www.genome.jp/tools-bin/clustalw)。Max(Mycassociated factor X,max)基因同样属于bHLH 家族中一员,它是figlα 的旁系同源基因[17,28],为从进化树上更清楚的看到figlα 类群演化的先后顺序,选择小黄鱼max 基因为进化树外类群,利用MEGA 7.0 软件采用邻近法(Neighbor-Joining),对不同物种figlα 氨基酸序列进行系统进化树构建及分析,针对进化树各分支结点均进行1 000 次重复计算检验。不同物种figlα 建树所用的基因序列号为:大黄鱼Larimichthys crocea(XP_019121559.1)、斑马鱼(NP_944601.2)、尼罗罗非鱼(NP_001298259.1)、青鳉(XP_011477803.1)、红鳍东方鲀Takifugurubripes(NP_001177290.1)、条纹鲈Moronesaxatilis(XP_035514638.1)、金头鲷Sparus aurata(XP_030271533.1)、点带石斑鱼Epinephelus coioides(AKC92803.1)、智人(NP_001004311.2)、家鼠Mus musculus(NP_036143.1)、家燕Hirundo rustica(XP_039943835.1)、热带爪蟾Xenopus tropicalis(NP_001016342.1)、安乐蜥Anolis carolinensis(XP_008120436.1)。
1.5 RT-PCR
为检测figlα 基因在240 dph 的小黄鱼不同组织中的分布,根据小黄鱼figlα 基因CDS 序列设计特异性引物(表1),进行RT-PCR 扩增,以βactin 基因作为对照(表1)。PCR 扩增反应体系同上,PCR 反应条件除βactin 基因退火温度为59 ℃外,其他条件同上。

表1 引物序列Tab.1 Primers list
1.6 石蜡切片制备及原位杂交
分别取60、90 和150 dph 的小黄鱼卵巢和精巢组织,立即放入4%多聚甲醛(PFA)中4 ℃过夜固定,固定完成后转入75%甲醇中,经梯度酒精脱水后浸蜡、包埋、切片;切片经脱蜡、风干、消化及蛋白酶K 处理;滴预杂交液,37 ℃孵育1 h;倾去预杂交液,滴加浓度1 μmol·L-1含探针FIGLα probe 杂交液,恒温箱42 ℃杂交过夜;洗去杂交液,滴加正常兔血清封闭液,室温30 min;倾去封闭液,滴加鼠抗地高辛标记碱性磷酸酶(anti-DIG-AP),37 ℃孵育40 min;后TBS 洗4 次,各5 min;滴加BCIP/NBT 显色液,显微镜观察阳性,后纯水冲洗;滴加核固红染液,染核至合适程度后纯水冲洗;自然风干后,中性树胶封片;显微镜拍照分析。
2 结果
2.1 figlα 基因CDS 序列和结构分析
将小黄鱼figlα 基因的CDS 区按表1 中所列的引物扩增,用2%琼脂糖凝胶电泳检测,出现单一且明亮的条带,电泳片段大小与预期估计的片段大小相符。将扩增产物测序拼接后得出,小黄鱼figlα 基因的CDS 序列长度为594 bp,编码197 个氨基酸(图1),包含一个高度保守的bHLH 结构域。其蛋白的理论分子量(MW)为22.6 kD,理论等电点为5.03,带有负电荷的氨基酸残基(Asp+Glu)33 个,带有正电荷的氨基酸残基(Arg+Lys)27 个,没有跨膜结构,未检测到明显的信号肽。Net NGlyc 1.0 Server 预测到有2 个N 连接的糖基化位点。小黄鱼与其它物种的figlα 蛋白同源性分析发现,小黄鱼的figlα 氨基酸序列与大黄鱼的同源性高达99.5%,与尼罗罗非鱼、青鳉、红鳍东方鲀、斑马鱼、热带爪蟾、家燕、安乐蜥、智人、家鼠的同源性分别为85.3%、79.1%、76.5%、41.1%、30.5%、28.9%、27.4%、24.4%、24.2%(图2)。采用NJ 法构建氨基酸系统发育树显示,小黄鱼figlα 与大黄鱼的亲缘关系最近,与大黄鱼共同构成了一个分支(图3)。

图1 小黄鱼figlα 基因的CDS 序列及其预测的氨基酸序列Fig.1 The CDS sequence and predicted amino acid sequence of the L.polyactis figlα gene

图2 小黄鱼figlα 基因与其他物种的氨基酸序列比对Fig.2 Amino acid sequence alignment of figlα gene among L.polyactis and other species
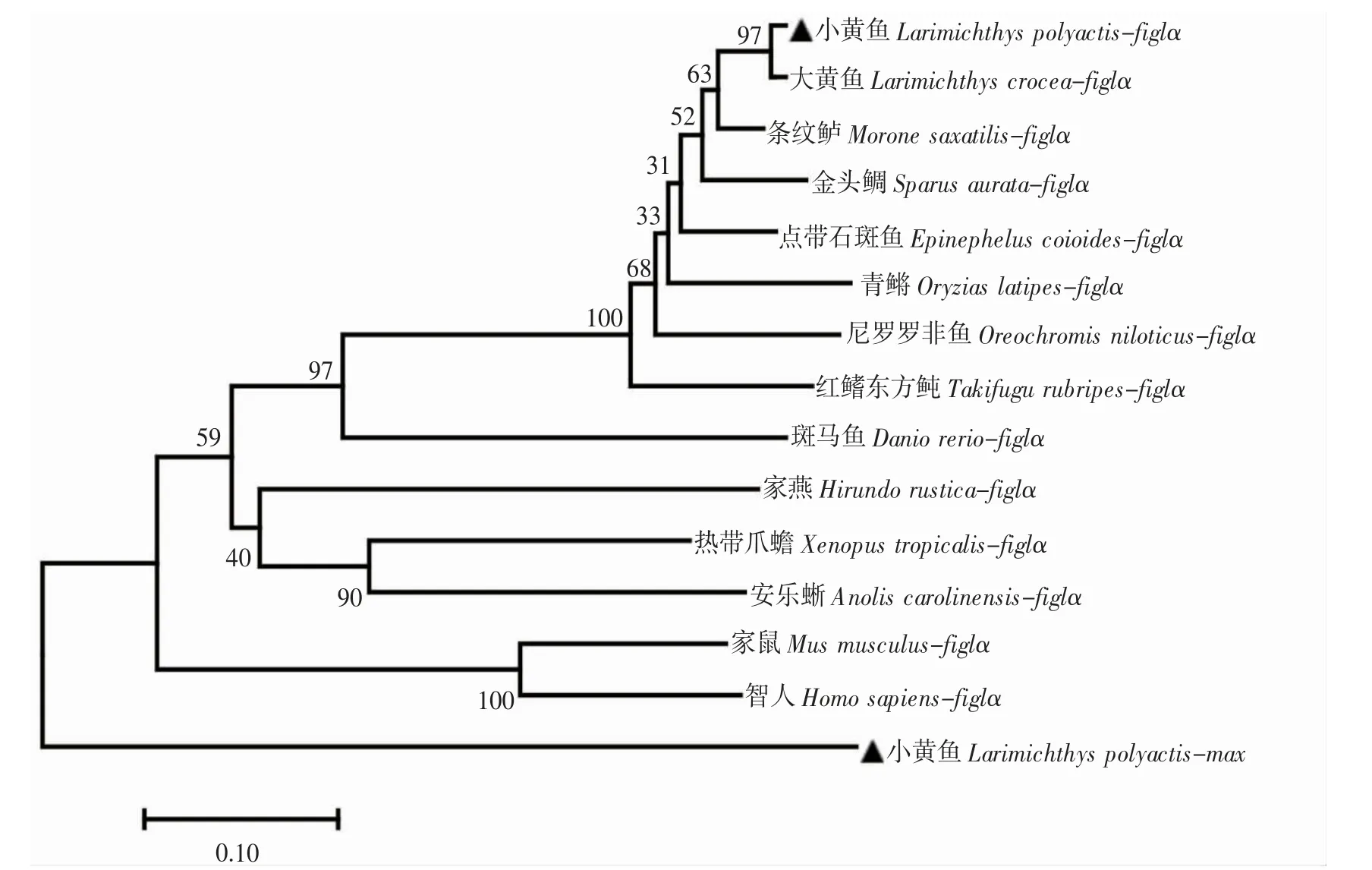
图3 NJ 法构建系统进化树采用(bootstraps=1 000 次)Fig.3 Phylogenetic tree established by 1 000 times N-J Bootstraps
2.2 figlα 基因组织表达
本研究以小黄鱼figlα 基因特异性引物作为扩增引物,以βactin 基因作为对照,利用RT-PCR 技术对figlα 基因在小黄鱼中的组织分布表达进行检测。结果表明,figlα 在小黄鱼卵巢组织中特异性表达,但在精巢、心脏、肝脏、肌肉、肾、皮肤、脑、眼、肠、鳃和脾组织中却不表达(图4)。由此可得,figlα 是小黄鱼卵巢特异基因,参与小黄鱼卵巢的发育。
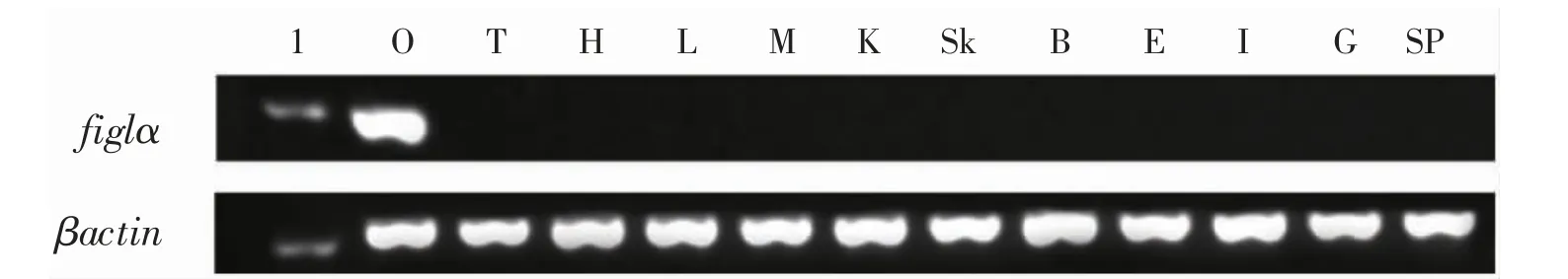
图4 figlα 基因在小黄鱼不同组织中的表达Fig.4 The expression of figlα mRNA in various tissues of L.polyactis
2.3 figlα 在性腺组织中的细胞定位
为了定位figlα 在卵巢中的表达,通过对小黄鱼不同发育时期60、90 及150 dph 性腺组织的石蜡切片进行原位杂交细胞定位,结果表明,figlα 在小黄鱼60、90 和150 dph 的卵巢初级卵母细胞及60 dph 精巢雌雄同体兼性阶段的初级卵母细胞中均有表达(图5,a、a’、c、c’、e、e’、i、i’),然而,在其他时期的精巢中均未检测到信号(图5,f、f’、j、j’)。同时,在使用正义探针的阴性对照组中也均未检测到任何信号(图5,b、b’、d、d’、g、g’、h、h’、k、k’、l、l’)。
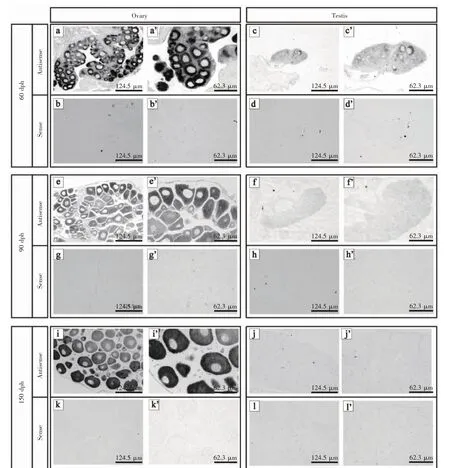
图5 小黄鱼性腺中figlα 的细胞定位Fig.5 figlα cell localization in gonads of L.polyactis
3 讨论
3.1 figlα 基因在脊椎动物中高度保守
figlα 是第一个被鉴定为生殖细胞特异性的基本螺旋-环-螺旋转录因子,在绝大多数物种的性腺组织中表达。本实验克隆了小黄鱼figla 基因CDS 全长序列,并对序列进行了生物信息学分析,结果发现小黄鱼figlα 基因的CDS 序列全长为594 bp,可编码197 个氨基酸,同时包含一个物种间高度保守的bHLH 结构域。高度保守的bHLH 区域被认为是figlα 与靶蛋白E-box 基序结合所必需的[1,6],小黄鱼的figlα 序列与其他脊椎动物具有高度同源性,同样包含一个物种间高度保守的bHLH 结构域,即特殊的螺旋-环-螺旋模体(HLHM)及其碱性氨基酸区域(Basic region)[10]。此外,通过对小黄鱼figlα 基因核苷酸序列和蛋白序列与其他物种相关序列进行同源性比对发现,figlα 基因与大黄鱼同源性最高,系统进化树结果显示,小黄鱼与其他鱼类聚为一大支,鸟类与爬行类聚为一大支,其中与大黄鱼亲缘关系最近,符合进化规律。
3.2 figlα 基因的表达与小黄鱼精巢雌雄同体阶段的产生高度相关
最近的研究表明,小黄鱼卵巢发育较为连续,但精巢在43~80 dph 期间出现一个37 d 的短暂的雌雄同体兼性阶段,其特征是精巢出现初级卵母细胞,并随后凋亡退化。这种模式在任何其他鱼类,包括近缘物种大黄鱼中都从未报道[27]。小黄鱼的figlα 基因具有特异性,它只在小黄鱼卵巢的初级卵母细胞与雌雄同体兼性阶段的精巢初级卵母细胞中表达。与此相似,罗非鱼、黑鲷和青鳉的figlα 同样也具有卵巢特异性,它们也只在卵巢的早期初级卵母细胞中表达,然而在精巢中不表达[9,16-17]。说明小黄鱼精巢雌雄同体阶段是特殊的,figlα 基因的表达与小黄鱼精巢雌雄同体阶段的产生高度相关。此外,在哺乳动物中,figlα 在精巢中的表达较弱,而在卵巢中表达较强[28-29]。这些结果进一步表明,figlα 是一种功能保守的卵母细胞特异性转录因子,它可能在从鱼类到哺乳动物的脊椎动物的早期卵泡发生中发挥基础性作用。
3.3 figlα 基因在小黄鱼中展现出性别二态性
本研究利用RT-PCR 及原位杂交技术研究了卵母细胞特异性转录因子figlα 在小黄鱼性腺发育中的作用。RT-PCR 结果表明,figlα 基因只在卵巢组织中高表达,但在精巢及其他组织中不表达;原位杂交结果显示,figlα 表达于60、90 和150 dph 卵巢的初级卵母细胞和60 dph 雌雄同体兼性阶段的精巢初级卵母细胞中,但在90 和150 dph 的精巢中均未检测到信号。与本研究结果一致的是,在罗非鱼中,figlα 主要在90和150 dph 卵巢的早期初级卵母细胞中表达[17],在青鳉中,figlα 早在1 dph 的卵巢中特异性表达,且在5 dph 卵巢相对较大的卵母细胞中表达[16]。然而,小黄鱼figlα 基因的表达模式与哺乳动物和爬行动物存在明显差异,如在小鼠、牛和中华鳖中,figlα 在他们的卵巢及精巢中均表达[1,7,10]。特殊的是,在一些鱼类中,figlα不但在他们的卵巢中表达,也在精巢中表达,如大西洋鲑Salmo salar[30]和斑马鱼[15],说明figlα 在生殖细胞发育中起到重要作用。此外,在半滑舌鳎Cynoglossus semilaevis 中发现了figlα 的2 种转录形式,其中figlα_tv1 首先在120 dph 卵巢中检测到,在孵化1 年后表达水平达到最大值,在孵化2 年后表达水平急剧下降,而figlα_tv2 只在假雄性睾丸中表达[31]。因此,figlα 在小黄鱼中展现出的性别二态性强烈的表明,figlα可能在促进小黄鱼的卵巢发育和分化中起重要作用,但figlα 基因的分子调控机制还需进一步研究。
4 结论
综上所述,figlα 基因在小黄鱼中展现出性别二态性,其在小黄鱼卵巢的初级卵母细胞与雌雄同体兼性阶段的精巢初级卵母细胞中表达,而在其他组织中不表达,说明figlα 基因的表达与小黄鱼精巢雌雄同体阶段的产生高度相关,可能在促进小黄鱼的卵巢发育和分化中起重要作用,但figlα 基因的分子调控机制还需进一步研究。

