牡蛎低聚肽的结构表征及体外抗氧化作用
刘文颖,冯晓文,李国明,张江涛,张新雪,谷瑞增
(1 中国农业大学工学院 北京 100083 2 中国食品发酵工业研究院有限公司 北京市蛋白功能肽工程技术研究中心 北京 100015)
牡蛎(Ostrea)又名生蚝,是世界上第一大养殖贝类,也是我国重要的养殖贝类。牡蛎肉中含有丰富的蛋白质、氨基酸,营养价值高,有“海洋牛奶”之称。通过蛋白提纯、生物酶解、分离纯化、喷雾干燥等步骤加工制得牡蛎低聚肽,是牡蛎高值化利用的有效途径[1-2]。牡蛎低聚肽主要成分为短肽,具有相对分子质量小,适热能力强,乳化效果好,易被机体吸收和具有新的生物活性等优点[3-4]。
抗氧化活性肽是生物活性肽的一种,能够清除自由基,抑制或消除氧化反应,降低氧化速率和过氧化物含量,保护细胞抵御氧化应激损伤,从而达到抗衰老的功能[5]。与化学抗氧化剂相比,动、植物来源的抗氧化活性肽安全性高,无毒副作用,作为天然抗氧化剂在食品和医药行业中具有较大的竞争力,是研究人员探索最多的一种生物活性肽。目前文献报道了乌鸡、鸡蛋、牛奶、大豆等多种蛋白来源活性肽的抗氧化作用,有研究表明抗氧化肽的活性与其结构有关[5-7]。目前,关于牡蛎低聚肽结构和抗氧化作用的系统研究鲜见报道。
本研究以去壳牡蛎肉为原料,经生物酶解、分离纯化等步骤制得牡蛎低聚肽,在对其基础理化成分、氨基酸组成、相对分子质量分布分析的基础上,用扫描电镜、紫外全波长扫描和圆二色光谱对其结构进行表征,通过DPPH 自由基清除能力、ABTS 自由基清除能力、氧自由基吸收能力(ORAC)和还原能力4 种体外化学评价体系探讨其抗氧化能力,为牡蛎低聚肽在抗氧化功能性食品的开发方面提供理论基础。
1 材料与方法
1.1 材料与仪器
冷冻去壳牡蛎肉,北京中食海氏生物技术有限公司提供;碱性蛋白酶(≥400 000 DU/g)、中性蛋白酶(≥1 600 AU/g),杜邦丹尼斯克公司;分子质量标准品、1,1-二苯基-2-三硝基苯肼(DPPH)、偶氮二异丁脒盐酸盐(AAPH)、Fluorescein(荧光指示剂)、Trolox(水溶性维生素E),美国Sigma 公司;乙腈(色谱纯),美国Fisher 公司;ABTS 自由基清除能力测定试剂盒,碧云天生物技术研究所;其它分析纯试剂,北京化工厂。
UV-1780 紫外可见分光光度计,日本SHIMADZU 公司;Spectra MR 多功能酶标仪,美国dynex 公司;LC-20A 高效液相色谱仪,日本SHIMADZU 公司;SpectraMax i3x 多功能酶标仪,美国MD 公司;A300 全自动氨基酸分析仪,德国曼默博尔公司;QSY-Ⅱ型凯式定氮仪,北京强盛分析仪器制造中心;HH-501 型超级恒温水浴锅,常州国宇仪器制造有限公司;DHG-9075A 电热恒温鼓风干燥箱,北京陆希科技有限公司;LG10-2.4A 型高速离心机,北京医用离心机厂。
1.2 试验方法
1.2.1 牡蛎低聚肽的制备 将冷冻去壳牡蛎肉先用蒸馏水洗净,然后称取600 g,绞碎,加入蒸馏水搅拌成匀浆。控温(50±2)℃,调节pH 值至8.5,加入质量分数0.5%的碱性蛋白酶,酶解2 h,再用0.1 mol/L HCl 调节水解液pH 值为6.5,加入质量分数0.6%的木瓜蛋白酶,酶解2 h。酶解过程中用0.1 mol/L HCl 或NaOH 调节水解液pH 值,使其保持不变。酶解结束后,于100 ℃沸水浴灭酶,10 000×g 离心20 min,取上清液,用截留分子质量为2×106u 的陶瓷膜过滤,取中间清液,用截留分子质量为1 000 u 的超滤膜超滤,得到分子质量小于1 000 u 的滤过液,然后喷雾干燥,得到牡蛎低聚肽干粉[8]。
1.2.2 基础理化成分测定 参照国家标准测定牡蛎低聚肽的基础理化成分。参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》 方法测定蛋白质含量;参照GB/T 22729-2008《海洋鱼低聚肽粉》 方法测定酸溶蛋白含量;参照GB 5009.3-2016 《食品安全国家标准 食品中水分的测定》方法测定水分含量;参照GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》 方法测定灰分含量[9-12]。
1.2.3 氨基酸组成测定 按照GB 5009.124-2016 《食品安全国家标准 食品中氨基酸的测定》方法,采用全自动氨基酸分析仪对牡蛎低聚肽的水解氨基酸和游离氨基酸组成进行分析[13]。
1.2.4 相对分子质量分布测定 利用流动相配制样品溶液的质量浓度为1 mg/mL,经孔径0.2 μm聚四氟乙烯膜过滤后,使用高效液相色谱仪进行凝胶过滤,紫外检测器检测。同时配制0.1%肽标准品溶液,过膜后进样,制作相对分子质量校正曲线。4 种肽标准品为:乙氨酸-乙氨酸-乙氨酸(分子质量189 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子质量451 u)、杆菌酶(分子质量1 450 u)、细胞色素C(分子质量12 500 u)。色谱条件:色谱柱:TSKgel G2000 SWXL 300 mm×7.8 mm;流动相:V乙腈∶V水∶V三氟乙酸=45∶55∶0.1;流速:0.5 mL/min;检测波长:220 nm;柱温:30 ℃[14]。
1.2.5 牡蛎低聚肽的结构表征
1.2.5.1 扫描电镜 将牡蛎低聚肽干粉样品涂抹在样盘双面胶上,然后,进行氮吹处理。将处理好的样品放入扫描电镜,抽真空,施加一定的电压,调整束斑尺寸,待聚焦清晰后分别在500 倍和1 000 倍下获取图像,观察区别[15]。
1.2.5.2 紫外全波长扫描 称取牡蛎低聚肽于超纯水中,配制成2.0 mg/mL 的溶液,用紫外-可见分光光度计进行紫外全波长扫描,扫描波长245~325 nm[14]。
1.2.5.3 圆二色光谱扫描 将牡蛎低聚肽配制成1.0 mg/mL 的溶液,用圆二色光谱仪测量样品的圆二色光谱。以0.2 nm 的步长和2.0 nm 的带宽扫描样品。光谱范围190~250 nm,扫描速度200 nm/min。从每个光谱中减去缓冲液的基线光谱,使用Jasco 软件内置的分析函数将得到的数值转换为摩尔椭圆率(θ)[15]。
1.2.6 牡蛎低聚肽的体外抗氧化活性测定
1.2.6.1 DPPH 自由基清除能力测定 依次加入100 μL 0.1 mmol/L DPPH-无水乙醇溶液和100 μL 不同质量浓度的样品溶液于96 孔板中,混匀,室温避光反应30 min,然后在波长517 nm 处测定吸光值Ax;将100 μL 不同浓度的样品溶液与100 μL 无水乙醇混合,测得吸光值A0;以蒸馏水代替样品作为空白对照,与100 μL 0.1 mmol/L DPPH-无水乙醇溶液混合,测得吸光值A1[16]。
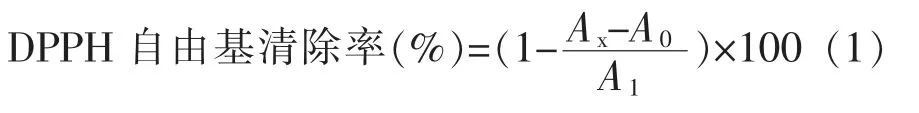
1.2.6.2 ABTS 自由基清除能力测定 将100 μL ABTS 溶液和100 μL 氧化剂溶液混匀,配成ABTS工作母液,避光静置过夜,形成ABTS 自由基储备液。使用前用0.1 mol/L 磷酸盐缓冲液(pH 7.4)稀释35 倍成为ABTS 工作液。每个孔中加入200 μL ABTS 工作液。向标准曲线检测孔中加入10 μL 不同质量浓度的Trolox(水溶性维生素E)标准溶液,向样品检测孔中加入样品10 μL,轻轻混匀后室温孵育6 min,于波长734 nm 处测定吸光值。最终样品的抗氧化能力以mmol Trolox/L 表示[17]。
1.2.6.3 ORAC 值的测定 将25 μL 样品溶液和100 μL Fluorescein (荧光指示剂,0.8 μmol/L)于96 孔板中混合,然后加入75 μL 150 mmol/L 偶氮类化合物AAPH 启动反应,此为试验组。分别用25 μL Trolox 标准品(6.25,12.5,25,50,100,250,500 μmol/L)代替样品作为阳性对照(制作标准曲线)、25 μL 磷酸缓冲液(pH=7.4,75 mmol/L)代替样品为空白对照,37 ℃保温20 min,荧光酶标仪激发波长485 nm,发射波长530 nm,每隔5 min 测定1 次,测定总长时间为120 min。另外,做不加AAPH 的对照。测样品的ORAC 值表示为μmol Trolox/g[18]。
1.2.6.4 还原能力的测定 分别加入100 μL 样品溶液,100 μL 0.2 mol/L 磷酸盐缓冲溶液(pH 6.6)和100 μL 质量分数1%铁氰化钾,50 ℃保温20 min,然后加入100 μL 质量分数10%三氯乙酸。取100 μL 反应液,加入100 μL 蒸馏水和20 μL 质量分数0.1% FeCl3溶液,反应10 min 后,于700 nm 下测定吸光值[19]。
1.2.7 数据处理 每组数据平行测定3 次,试验结果用平均值±标准偏差表示,使用Origin 8.5 软件作图。
2 结果与分析
2.1 牡蛎低聚肽的基础理化成分
结果显示,牡蛎低聚肽中蛋白质含量为(67.57±0.53)%,酸溶蛋白质含量为(63.22%±0.56)%,占总蛋白质93.56%,表明牡蛎低聚肽中小分子蛋白质含量较高。游离氨基酸含量为(7.88±0.23)%,经计算,肽含量为(55.34±0.45)%。水分和灰分含量很低,分别为(4.36±0.39)%和(5.78±0.32)%。由此可见,牡蛎肉蛋白质含量较高,是制备低聚肽的优良蛋白质来源。酶解过程中蛋白质的溶解、不溶性非蛋白质物质的去除以及水解后油脂等物质的去除,使得制备的牡蛎低聚肽中蛋白质和肽含量较高。
2.2 牡蛎低聚肽的氨基酸组成
由表1可知,牡蛎低聚肽中谷氨酸、甘氨酸、丙氨酸和天冬氨酸含量较高,总含量为38.47%,而色氨酸和半胱氨酸含量很低,仅为1.10%。牡蛎低聚肽中含有丰富的必需氨基酸,含量为22.11%,占氨基酸总和的27.40%,组成合理,具有较高的营养价值。这与Dong 等[8]研究的牡蛎肽氨基酸组成相似。牡蛎低聚肽中高含量的谷氨酸、天冬氨酸等风味氨基酸对其风味起到一定的作用。有文献报道,许多氨基酸具有抗氧化能力,能够较好地清除自由基,如甘氨酸、丙氨酸、精氨酸、赖氨酸、组氨酸、蛋氨酸、亮氨酸、酪氨酸、缬氨酸、半胱氨酸、脯氨酸等[20-21]。牡蛎低聚肽富含抗氧化性氨基酸,其中甘氨酸、丙氨酸、精氨酸、赖氨酸含量较高。此外,牡蛎低聚肽中疏水性氨基酸含量为21.43%,占氨基酸总和的26.56%。低聚肽中高含量的疏水性氨基酸能够增加脂溶性,从而有助于清除脂质自由基,发挥重要的抗氧化作用[22]。
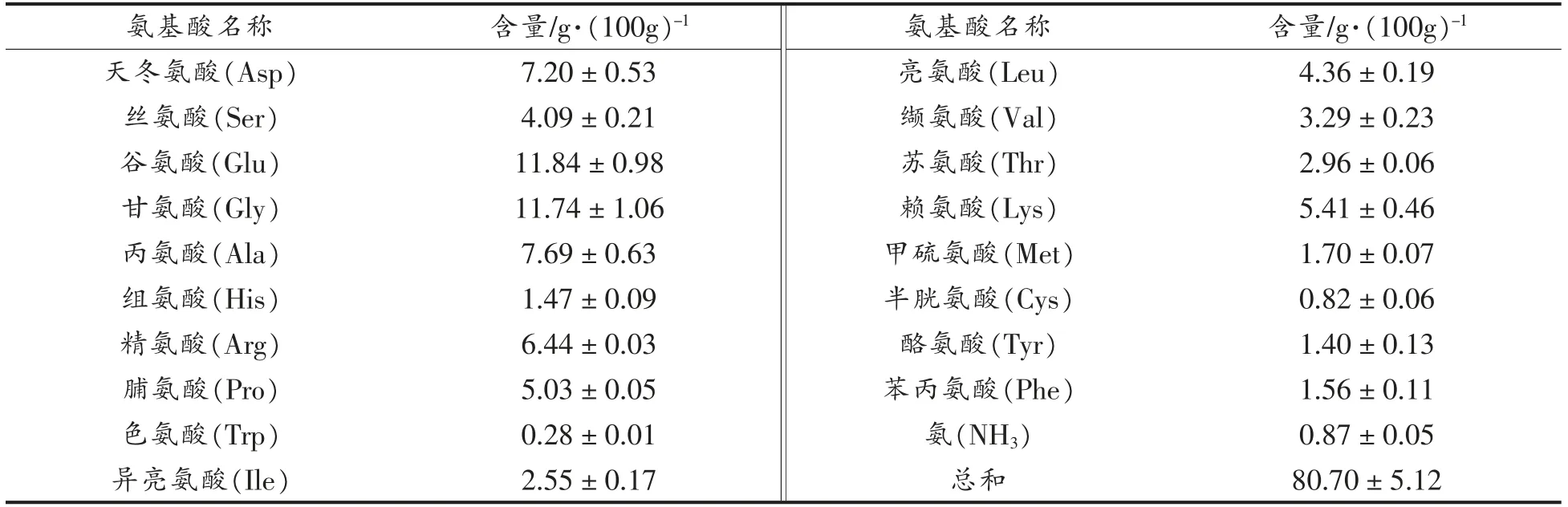
表1 牡蛎低聚肽的氨基酸组成Table 1 Amino acid composition of oyster oligopeptides
2.3 牡蛎低聚肽的相对分子质量分布
分子质量标准曲线见图1,方程为:lg MW=-0.2123489t+ 6.877187(R2=0.9961867)。牡蛎低聚肽洗脱图谱见图2。使用GPC 软件处理色谱数据,如表2所示,牡蛎低聚肽中大分子蛋白较少,主要为小分子肽混合物,且主要分布在1 000 u的小肽占77.71%,而1 000~2 000 u,2 000~3 000 u,3 000~5 000 u,>5 000 u 的多肽分别为7.35%,1.07%,0.33%,0.09%,说明牡蛎低聚肽的主要成分为1 000 u 以下的小肽。研究表明,肽的抗氧化活性与分子质量大小有关,活性较强的抗氧化肽分子质量均较小,氨基酸残基的数目一般在20 个以内[23]。牡蛎低聚肽是一种具有潜力的抗氧化性物质。

表2 牡蛎低聚肽的分子质量分布Table 2 Molecular weight distribution of oyster oligopeptides
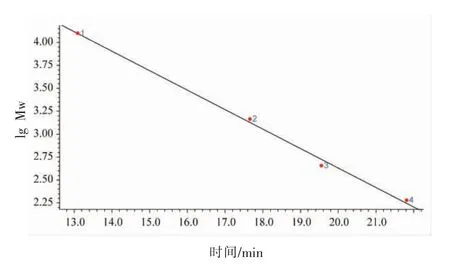
图1 分子质量标准曲线Fig.1 The standard curve of molecular weight
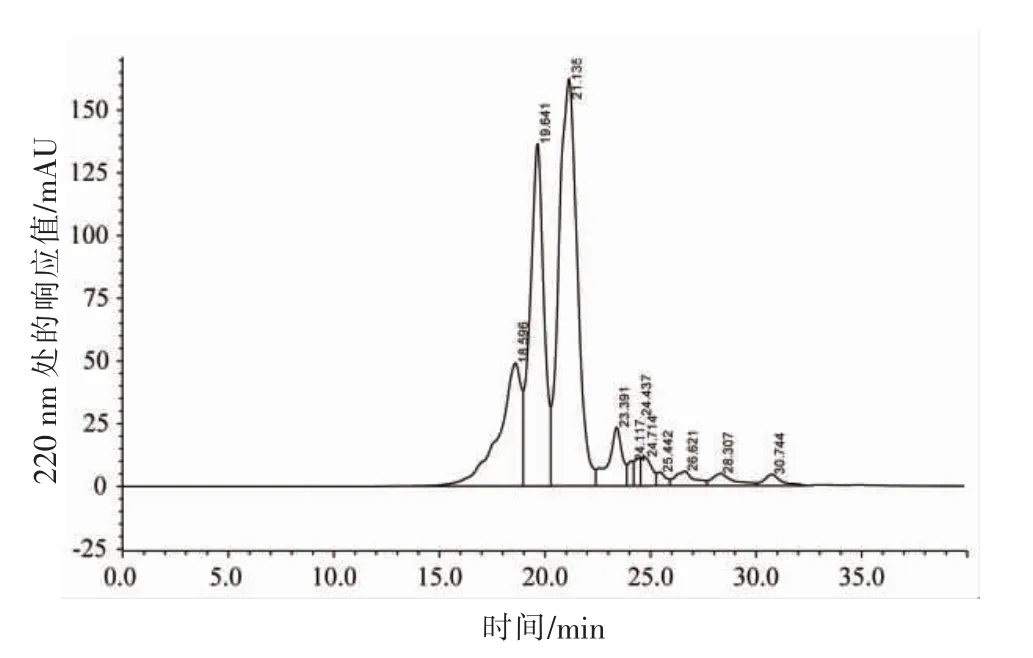
图2 牡蛎低聚肽的分子质量分布凝胶色谱图Fig.2 Gel filter chromatogram of molecular weight distribution of oyster oligopeptides
2.4 牡蛎低聚肽的结构表征
2.4.1 扫描电镜 由图3可看出,牡蛎低聚肽具有明显的球体颗粒状,在500 倍和1 000 倍放大倍数下牡蛎低聚肽表面有不规则褶皱和气孔。这可能是因为酶解破坏了蛋白质结构,使粒径减小,表面暴露出更多的疏水性基团,进而提高酶解产物的抗氧化能力[24]。

图3 牡蛎低聚肽的扫描电镜Fig.3 Scanning electron microscope of oyster oligopeptides
2.4.2 紫外全波长扫描 将质量浓度2.0 mg/mL的牡蛎低聚肽进行紫外全波长扫描,扫描波长245~325 nm,结果见图4。牡蛎低聚肽在波长267 nm 处的近紫外区有最大吸收峰,吸光度为1.55,表明该波长范围产生价电子跃迁。这是因牡蛎低聚肽中的生色团和助色团,如C=O、COOH、NH2的偏光性而形成的。

图4 牡蛎低聚肽的紫外全波长扫描Fig.4 UV scanning analysis of oyster oligopeptides
2.4.3 圆二色光谱扫描 圆二色光谱图(图5)的峰位和峰形显示,牡蛎低聚肽的二级结构以多种构象并存,牡蛎低聚肽在198 nm 处的远紫外区有负吸收,二级结构主要为β-折叠。利用CDNN 软件分析得到肽段各二级结构的含量,如表3所示。牡蛎低聚肽的α-螺旋为(5.5±0.2)%,平行式β-折叠为(3.1±0.3)%,反平行式β-折叠为(35.7±2.8)%,β-转角为(19.9±1.1)%,无规卷曲为(34.7±1.9)%。与蛋白质相比,肽的结构较为简单,主要具有肽链一级结构及二级结构[25]。牡蛎低聚肽中紧密且没有空腔的稳定结构即α-螺旋结构含量较少,β-折叠及无规卷曲含量较多,导致蛋白质分子表面疏水性变大[26]。这可能是由于酶解使蛋白质结构发生改变,蛋白质的空间结构展开,蛋白质分子内无序结构含量相对较高,β-折叠和无规卷曲增加,使得隐藏在内部的疏水性位点更多地显露出来,从而发挥特定的功能作用[27],这也是牡蛎低聚肽表现出一定抗氧化能力的原因之一。

图5 牡蛎低聚肽的圆二色光谱扫描Fig.5 Circular dichroism spectrum of oyster oligopeptides

表3 牡蛎低聚肽的二级结构Table 3 Secondary structure of oyster oligopeptides
2.5 牡蛎低聚肽的体外抗氧化作用
2.5.1 牡蛎低聚肽的DPPH 自由基清除能力 由图6可知,在质量浓度0~25 mg/mL 范围,牡蛎低聚肽对DPPH 自由基清除率与质量浓度呈明显的剂量关系,在质量浓度为25 mg/mL 时,对DPPH自由基清除率为(76.25±2.53)%,半抑制浓度(IC50值)约为9.7 mg/mL。这表明牡蛎低聚肽具有降低DPPH 自由基浓度,阻断脂质过氧化链式反应的能力。阳性对照VC 对DPPH 自由基的清除先迅速增加,达到最大值,然后趋于平缓,IC50值约为3.9 μg/mL。牡蛎低聚肽的DPPH 自由基清除能力可能是因牡蛎肉酶解过程中释放出可作为质子供体的物质,与DPPH 自由基反应使其转变成稳定的反磁性分子,从而呈现出较强的抗氧化能力[28]。Dong等[8]考察了牡蛎肽的抗氧化能力,结果表明,牡蛎肽的DPPH 自由基清除能力随着质量浓度的增加而增强,IC50值约为11.5 mg/mL,比本研究中牡蛎低聚肽对DPPH 自由基的清除活性低。叶昱辉[3]测定了牡蛎多肽的DPPH 自由基清除活性,IC50值为4.48 mg/mL,稍强于牡蛎低聚肽对DPPH 自由基的清除能力。
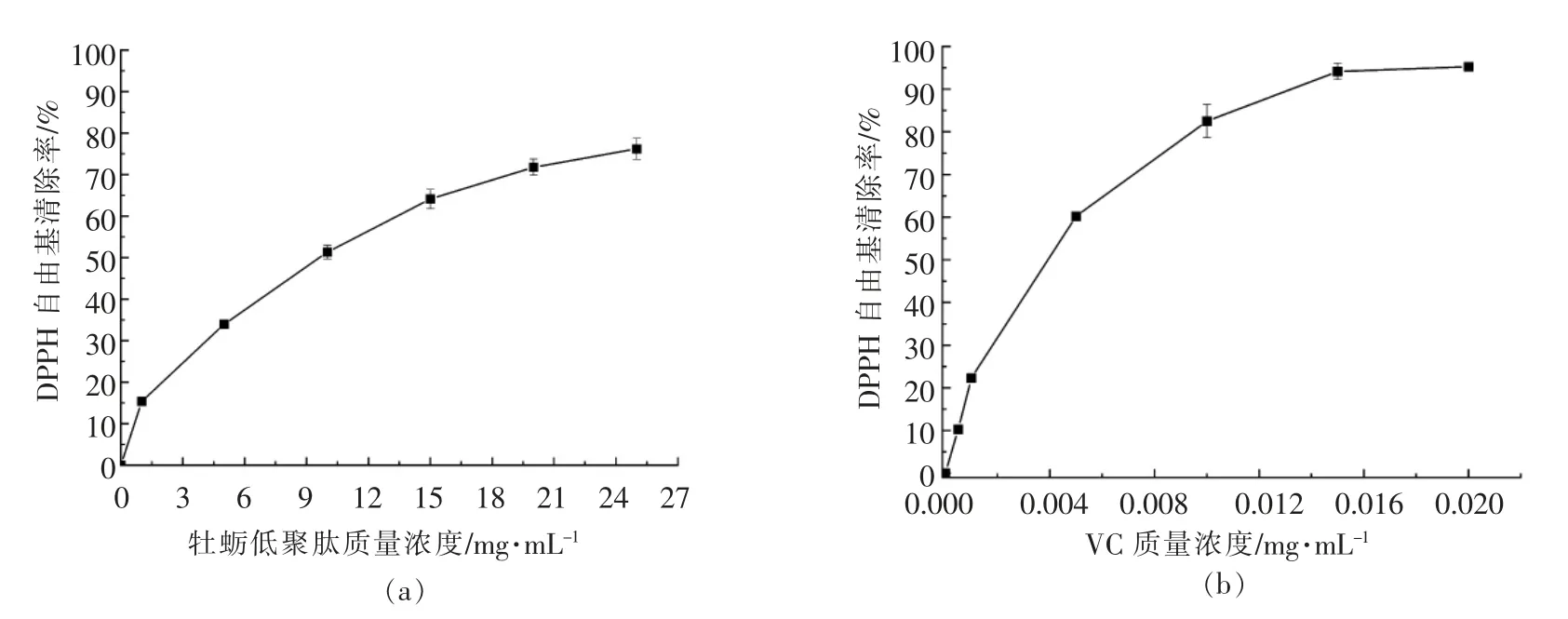
图6 牡蛎低聚肽(a)和VC(b)对DPPH 自由基清除率Fig.6 DPPH free radical scavenging effects of oyster oligopeptides (a) and VC (b)
2.5.2 牡蛎低聚肽的ABTS 自由基清除能力 以Trolox 标准溶液绘制的ABTS 标准曲线如图7所示。牡蛎低聚肽和VC 的ABTS 自由基清除能力如图8所示。在质量浓度为1~20 mg/mL 范围,牡蛎低聚肽对ABTS 自由基清除能力随质量浓度的增加而增强,在质量浓度为5.0 mg/mL 时的ABTS 自由基清除能力与0.06 mg/mL 的VC 相当。推测可能由于牡蛎酶解后,空间构型、氨基酸组成和分子空间排列等发生变化,产生离子化的氨基或羧基等供氢体,此外,某些氨基酸如酪氨酸(Tyr)含有酚羟基,能提供质子,还原具有氧化性的自由基,从而终止自由基连锁反应,达到清除或抑制自由基的目的[24]。VC 在较低的质量浓度 (0.01~0.10 mg/mL) 下就能展示较强的ABTS 自由基清除能力。与单一成分的VC 相比,牡蛎低聚肽的ABTS自由基清除能力要弱很多,然而作为一种天然的功能活性物质,安全性高,长期食用无毒副作用。

图7 Trolox 标准曲线Fig.7 Trolox standard curve
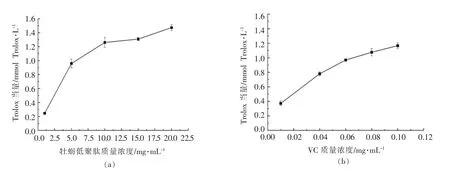
图8 牡蛎低聚肽(a)和VC(b)对ABTS 自由基清除率Fig.8 ABTS free radical scavenging effects of oyster oligopeptides (a) and VC (b)
2.5.3 牡蛎低聚肽的ORAC 值 不同质量浓度Trolox 的动态荧光衰减曲线见图9,由此绘制标准曲线见图10,y=0.0845x-0.0029,R2=0.9990。根据标准曲线,计算牡蛎低聚肽和VC 的ORAC 值,分 别 为 (181.75±7.26),(976.42±33.42)μmol Trolox/g。VC 的ORAC 值约为牡蛎低聚肽的5 倍。虽然牡蛎低聚肽的ORAC 值明显低于各质量浓度VC 的ORAC 值(P<0.05),但是与其它抗氧化肽的ORAC 值相近[29]。这表明牡蛎低聚肽通过氢转移阻断自由基链式反应过程实现抗氧化作用[30]。有研究表明,高活性的抗氧化肽通常都在一定的分子质量范围内,分子质量小的肽一般具有较强的抗氧化活性[7,31]。吴明泽等[32]通过超滤将中华圆田螺肉酶解产物分离纯化为分子质量<1 ku,1~3 ku,>3 ku 的3 个组分。分子质量<1 ku 组分的ORAC 值均显著高于另外两个组分(P<0.05),具有良好的氧自由基吸收能力。本研究中牡蛎低聚肽的主要成分为分子质量<1 ku 的小肽,这可能与其具有较高的ORAC 值有关。

图9 不同质量浓度Trolox 的动态荧光衰减曲线Fig.9 Dynamic fluorescence attenuation curve of Trolox at different concentrations

图10 Trolox 标准曲线Fig.10 Trolox standard curve
2.5.4 牡蛎低聚肽的还原能力 样品的还原能力与其抗氧化活性呈正相关,吸光值越大,还原能力越强,抗氧化活性越强[7]。由图11可见,牡蛎低聚肽和VC 的吸光值均随质量浓度的增加而增大。通过计算可知,牡蛎低聚肽在质量浓度为3.0 mg/mL 时的还原能力与0.01 mg/mL 的VC 相当。这表明牡蛎低聚肽是良好的电子供体,具有一定的抗氧化能力。有报道[3]对牡蛎多肽的还原能力进行了研究,其还原能力与其质量浓度呈正比,在质量浓度5.0 mg/mL 时,吸光值约为0.3,与本研究中的牡蛎低聚肽还原能力接近。Dong 等[8]研究了牡蛎肽的还原能力,在其质量浓度15.0 mg/mL 时,吸光值约为0.8,稍强于本研究中牡蛎低聚肽的还原能力。
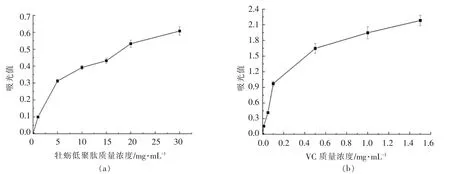
图11 牡蛎低聚肽(a)和VC(b)的还原能力Fig.11 Reducing power of oyster oligopeptides (a) and VC (b)
3 结论
牡蛎低聚肽具有较高的蛋白质和肽含量,分别为(67.57±0.53)%,(55.34±0.45)%,必需氨基酸和疏水性氨基酸含量丰富,分别为22.11%,21.43%,主要成分为分子质量小于1 000 u 的小肽 (占91.16%)。牡蛎低聚肽具有明显的球体颗粒状,表面有不规则褶皱和气孔,在267 nm 波长处有最大吸收峰。牡蛎低聚肽的二级结构以多种构象并存,主要为β-折叠(含量为38.8%)。牡蛎低聚肽具有良好的DPPH 自由基和ABTS 自由基清除能力,以及氧自由基吸收能力和还原能力。牡蛎低聚肽对DPPH 自由基的IC50值约为9.7 mg/mL,ORAC值为(181.75±7.26)μmol Trolox/g,5.0 mg/mL 时的ABTS 自由基清除能力与0.06 mg/mL 的VC 相当,3.0 mg/mL 时的还原能力与0.01 mg/mL 的VC 相当。上述结果表明牡蛎低聚肽是一种有效的抗氧化活性肽,后续将通过离子色谱、反相高效液相色谱等方法对其进行分离纯化,筛选高活性的抗氧化肽段,进一步明确牡蛎低聚肽的抗氧化功能构效关系。

