肉桂-山苍子复合植物精油对发霉花生黑曲霉BQM菌的抑菌效果
吕好新,赵玲丽,霍珊珊,王若兰
(河南工业大学粮油食品学院 郑州 450001)
花生 (Arachis hypogaea Linn.) 属于豆科植物,原名落花生,是我国重要的经济和油料作物。我国是世界上最大的花生生产国,2018年花生的种植面积在我国油料作物中居第2 位,为462 万hm,总产量达1 733.2 万t[1]。花生的营养价值很高,富含脂肪和蛋白质,且花生中的不饱和脂肪酸易被人体吸收,是我国重要的食用植物油和植物蛋白资源[2-3]。然而,花生在种植、收获、运输及贮藏过程中极易受到霉菌的污染[4],尤其是在收获后储存不当,霉菌的繁殖会对花生品质产生不利的影响,主要表现为蛋白质和脂肪含量下降,游离脂肪酸含量增加以及发芽率降低等[5]。此外,霉变的花生所含的真菌毒素会对人类健康产生极大的威胁[6]。在贮藏期间,寻找安全有效的方法抑制花生上的优势霉菌繁殖,对于保持花生的品质极其重要。目前,生产上多采用化学试剂熏蒸法对花生进行防霉处理[7],然而,由于化学药剂对人类健康和环境的危害较大,因此寻找绿色安全的防霉剂显得尤为迫切。
植物精油(essential oils,EOs)是一类从植物中提取的次生代谢物质,因具有抑菌、杀虫、抗氧化活性高,且易于生物降解等特点,近些年来在食品防腐保鲜、饲料添加剂、医药等方面有着广泛应用[8-10]。大量研究表明,植物精油对于水果、粮食收获后携带的腐败霉菌有较强的抑制作用,是一种非常有潜力的防霉剂[4,11-13]。然而,不同精油的抑菌成分不同,对各类霉菌的抑制作用也有所差别[11]。将不同精油按照一定的比例混合配制,研究复合精油的防霉效果具有重要意义。
本试验从发霉花生上分离出优势霉菌,通过形态学特征,并且结合18S rRNA 基因序列分析,对优势霉菌进行鉴定。利用抑菌圈试验研究肉桂、山苍子、丁香、香茅及百里香等5 种植物精油对优势霉菌的单一及复合抑菌效果。通过扫描电镜观察精油对霉菌BQM 菌丝结构的影响,预测复合植物精油的防霉机理。本文旨在研究植物精油对花生贮藏期间优势霉菌的抑制作用,为花生贮藏过程中优势霉菌的绿色防治提供理论依据,为花生复合精油防霉剂的开发提供参考。
1 材料与方法
1.1 试验材料与试剂
花生样品,由河南正阳农户提供的2019年新收获的花生,初始水分为5%。
肉桂、山苍子、丁香、香茅和百里香等5 种植物精油,吉安市中香植物有限公司,保存在4 ℃冰箱中,备用。马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA),北京奥博星生物技术有限责任公司;马铃薯葡萄糖培养基(Potato Dextrose Broth,PDB),青岛海博公司;Tween-20,北京索莱宝科技有限公司,常温下备用。所用试剂均为分析纯级。
1.2 试验仪器与设备
UB203i 正置生物显微镜,重庆澳浦光电技术有限公司;Quanta 250 FEG 扫描电子显微镜,美国FEI 公司;HWS 恒温恒湿箱,宁波东南仪器有限公司;SW-CJ-2D 型双人单面净化工作台,苏州净化设备有限公司;MVS-1 旋涡混合器,北京金北德工贸有限公司;LDZX-50KBS 立式压力蒸汽灭菌器,上海申安医疗器械厂;TGL-18MS 台式高速冷冻离心机,上海卢湘仪离心仪器有限公司;TOPT-10D 真空冷冻干燥机,西安特普讯仪器设备有限公司。
1.3 试验方法
1.3.1 优势霉菌的分离纯化 利用调水公式[14]将花生仁水分含量调至9.7%,然后将500 g 花生仁装入密封袋中,室温下过夜放置,平衡水分。接着将花生仁密封袋放入30 ℃恒温培养箱中贮藏至花生仁发生霉变。待花生仁霉变后,称取25 g 霉变花生于225 g 无菌水中,充分混匀后形成菌悬液,将菌悬液依次稀释为10-1,10-2,10-3,10-4,10-5等浓度梯度,用移液枪吸取100 μL 10-1,10-3和10-5菌悬液稀释液,并分别将其均匀涂布在PDA培养基上,28 ℃下培养3 d,从PDA 培养基上挑取单菌落接种于新鲜的PDA 培养基上,反复培养数代至平板内霉菌菌落形态一致,视为纯培养霉菌。本试验选取分离自霉变花生的优势霉菌菌株作为研究对象,将其命名为BQM。将纯化后的菌株BQM 接种在新鲜的PDA 培养基上,28 ℃下培养5 d,用无菌水冲洗霉菌BQM,在涡旋仪上充分混匀后,采用血球计数板在显微镜下计数,将BQM 的孢子液浓度调为5×105~6×105CFU/mL 备用。
1.3.2 菌株BQM 形态鉴定 按GB/T 4789.16-2016 方法进行操作[15],将菌株BQM 点种在PDA培养基上,28 ℃条件下培养,观察记录菌落的形态、颜色。
1.3.3 菌株BQM 的18S rRNA 基因序列鉴定及系统发育分析 提取菌株BQM 的总DNA,用真菌通用引物ITS1(TCCGTAGGTGAACCTGCGG)和ITS4 (TCCTCCGCTTATTGATATGC) 进行18S rRNA 基因片段扩增。PCR 产物经琼脂糖凝胶电泳检测后,由北京六合华大基因科技有限公司进行测序。18S rRNA 基因序列通过NCBI-BLAST 网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对分析,搜索同源性较高的已知序列,用MEGA X软件构建系统发育树[16]。将泡盛曲霉(Aspergillus awamori)CBS112.52 作为外围菌株。菌株BQM 的18S rRNA 基因序列已经提交至NCBI 网站(https://www.ncbi.nlm.nih.gov/),登录番号为MT903388。
1.3.4 植物精油对霉菌BQM 的抑菌活性测定植物精油对霉菌的抑菌活性通过抑菌圈试验来评价,使用打孔法测定抑菌圈直径。将植物精油溶于1%的Tween-20 溶液得到试验所需体积浓度的精油溶液。在无菌操作台内,吸取100 μL 孢子液至充分冷却凝固的PDA 培养基上,用三角玻璃涂布棒均匀涂布。用打孔器在含菌平板中央打取直径为7 mm 的圆孔,加入一定浓度的精油溶液100 μL。所有平板在室温下静置1 h,放入28 ℃恒温培养箱培养3 d,采用十字交叉法测量抑菌圈直径并进行拍照。对照组(0 μL/mL) 加入等量的1%的Tween-20 溶液。每个试验重复3 次。
抑菌圈试验判定标准[17]:抑菌圈直径>20 mm为高度敏感;抑菌圈直径在10~20 mm 为中度敏感;抑菌圈直径在7~10 mm 为低度敏感。
1.3.5 最小抑菌浓度 (Minimum Inhibitory Concentration,MIC)测定 复合精油对霉菌MIC 的测定通过琼脂稀释法来确定,方法略有修改[18-19]。在大约60 ℃的PDA 培养基中迅速加入一定体积的植物精油(用1%的Tween-20 稀释)后立即混匀,使得培养基内精油的终浓度为0.0325~4 μL/mL。随后将20 mL 含有精油的培养基倒入培养皿内,待培养基充分冷却凝固后,吸取100 μL 孢子液至固体培养基上,使用涂布棒均匀涂布。将所用平板放入28 ℃恒温培养箱培养4 d,观察菌落的生长情况,以无肉眼可见菌落生长的精油浓度为该精油对霉菌的MIC 值。
以分级抑菌浓度指数 (Fractional Inhibitory Concentration,FIC)作为联合抗菌试验效果的判定依据[20-21]:

FIC 指数判定标准为:FIC≤0.5 时,表明两种精油的抑菌效果具有协同作用;0.5<FIC≤1 时,表明两种精油的抑菌效果具有相加作用;1<FIC≤2时,表明两种精油的抑菌效果无关;FIC 指数>2时,表明两种精油的抑菌效果具有拮抗作用。
1.3.6 复合精油对霉菌BQM 菌丝结构的影响根据袁康等[22]和张忠等[23]的方法,并在此基础上进行修改。将霉菌孢子液倒入PDB 培养液中,置于28 ℃,150 r/min 摇床内培养2 d,分别加入0,0.125,0.25 μL/mL 的复合精油继续培养1 d 后,在4 000 r/min,4 ℃条件下离心10 min 收集菌丝体。用无菌PBS 缓冲液反复冲洗菌丝体3 次,用2.5%的戊二醛固定过夜,离心去上清后,用无菌PBS 缓冲液反复漂洗3 次,每次10 min,再用无菌纯水清洗2 次。依次用30%,50%,70%,90%乙醇脱水10 min,用100%乙醇脱水15 min;用叔丁醇∶乙醇=1∶1,2∶1 脱水10 min,用100%叔丁醇置换两次,最后得到叔丁醇菌液。-80 ℃预冻2 h,进行冷冻干燥。干燥后的样品喷金处理,在扫描电镜下观察样品并拍照。
1.4 数据分析
本试验数据分析采用SPSS 20.0 软件处理,用Duncan's 法进行多重显著性分析和标准偏差计算,采用Origin 2018 软件作图。
2 结果与分析
2.1 花生中优势霉菌菌株BQM 鉴定
2.1.1 形态学特征 由图1a 和1b 可知,霉菌菌株BQM 的菌落在PDA 固体培养基上呈圆形,边缘规则。菌落初期为白色,有浅黄色区域,厚绒状;成熟后为黑色,菌落边缘规则,且有白色绒毛,其背面中央部位略带黄褐色。这些形态特征与蔡静平[24]在《粮油食品微生物学》中对黑曲霉的描述一致,因此初步判定霉菌菌株BQM 为黑曲霉。

图1 菌株形态特征(PDA 培养基)Fig.1 Morphological characteristics of the strain(in PDA medium)
2.1.2 基于18S rRNA 基因序列的系统进化关系分析 将霉菌BQM 的18S rRNA 基因序列提交至NCBI 数据库,通过BLAST 比对,寻找与BQM具有最大相似度的序列,根据neighbour-joining法构建系统进化树,如图2所示,霉菌BQM 被鉴定为黑曲霉(Aspergillus niger)。
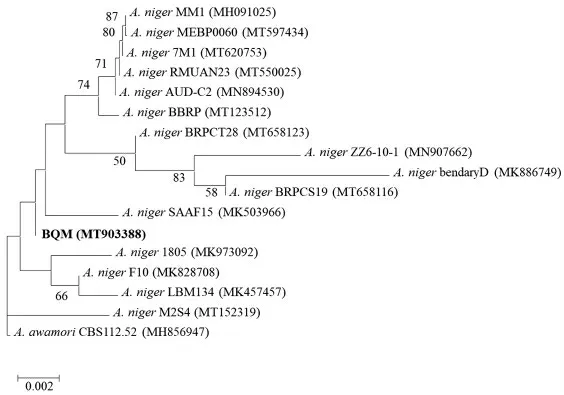
图2 霉菌BQM 基于18S rRNA 基因的系统进化树Fig.2 Phylogenetic tree of BQM based on 18S rRNA gene
2.2 5 种植物精油对霉菌BQM 的抑菌效果分析
2.2.1 单一植物精油对霉菌BQM 的抑菌效果 5种精油单独作用于霉菌BQM 的抑制效果如图3a和3b 所示。试验结果表明,5 种植物精油均能单独抑制BQM 生长,且随着浓度的增加,抑菌圈直径呈现增大趋势。当精油浓度为60 μL/mL 时,肉桂、山苍子、丁香精油对BQM 的抑菌圈直径均大于20 mm,说明此时BQM 对肉桂、山苍子、丁香精油高度敏感;而百里香精油和香茅精油对BQM 的的抑菌圈直径在10~20 mm 之间,说明此时BQM对这两种精油均表现为中度敏感。
由图3a 和3b 可知,肉桂精油在浓度10~60 μL/mL 时,抑菌圈直径都大于20 mm,这是因为肉桂精油的主要抑菌成分肉桂醛有强烈的抗真菌活性,且挥发性较低,显示出稳定持久的抑菌特点;山苍子精油对BQM 具有很强的抑制效果,这是因为山苍子精油的主要抑菌成分柠檬醛具有很强且广泛的抗真菌作用,有研究证明柠檬醛通过影响线粒体功能来抑制微生物生长[25];丁香精油对BQM 也有明显的抑制效果,Jahani 等[26]的试验也证明了丁香精油对黑曲霉具有强烈的抑制效果,并发现丁香精油通过影响细胞能量代谢来影响真菌的生理活性。

图3 5 种植物精油对霉菌BQM 的抑菌效果Fig.3 The antifungal activity of five essential oils against BQM
2.2.2 不同复合精油对霉菌BQM 的抑菌效果根据图3可知,肉桂、山苍子和丁香精油对BQM的抑菌效果较好,将这3 种精油以不同的混合方式(两两混合或全部混合)进行等体积混合,使复合精油的浓度为60 μL/mL,通过抑菌圈试验来测定不同组合的复合精油对BQM 的抑菌效果。试验结果如图4所示,在所有复合精油中,肉桂-山苍子复合精油对BQM 的抑菌效果最佳,其抑菌圈直径为39.8 mm,显著高于其它复合精油的抑菌圈直径(P<0.05);山苍子-丁香复合精油在所有复合精油中抑菌圈直径最小,为22.3 mm,比丁香精油单独使用时略大,但两者之间差异不显著。唐雅珂[27]的研究也证明,肉桂和山苍子精油(不稀释)等体积复合使用后,对大米中的黑曲霉显示出很强的抑制效果。

图4 不同复合精油对霉菌BQM 的抑制效果Fig.4 The antifungal activity of various mixed essential oils against BQM
2.2.3 肉桂-山苍子复合精油对霉菌BQM 的MIC值的测定 根据图4可知,肉桂-山苍子复合精油对BQM 的抑菌效果最好,因此,本试验采用琼脂稀释法测定肉桂-山苍子复合精油对BQM 的MIC值。从表1可以得知,肉桂-山苍子复合精油对BQM 的MIC 值为0.125 μL/mL,说明肉桂-山苍子复合精油对BQM 有很好的抑制效果;肉桂-山苍子复合精油对BQM 的FIC 值为0.75,介于0.5~1之间,说明肉桂精油和山苍子精油的抑菌效果有复合相加作用[28],表明肉桂与山苍子精油等比例复配使用对BQM 的抑菌效果比二者单独使用的效果好。

表1 不同含量的肉桂-山苍子复合植物精油对霉菌BQM 的生长抑制情况Table 1 The inhibitory effects of various cinnamon-litsea cubeba mixed oils on the growth of BQM
2.2.4 肉桂-山苍子复合植物精油最佳配比的确定 根据图4以及联合抗菌试验结果可知,肉桂精油和山苍子精油在等体积混合后对BQM 有很好的抑菌效果,为进一步探索复合精油中两种精油的最佳比例,以肉桂精油和山苍子精油为原料,按照不同比例混合进行抑菌圈试验。结果如图5所示,V肉桂精油∶V山苍子精油=3∶5 时,抑菌圈直径最大,为45.3 mm,显著高于其它配比的复合精油的抑菌圈直径(P<0.05),说明此配比的复合精油对BQM 具有最佳抑制效果。抑菌圈直径达到最大值后,随着山苍子精油占比的减小,抑菌圈直径也在不断减小,最后趋于稳定,故推测两种精油在协同抑菌时以山苍子精油的作用为主导[17]。

图5 不同体积比的肉桂精油和山苍子精油配制成的肉桂-山苍子复合精油对BQM 的抑制效果Fig.5 The antifungal effect of various mixed essential oils composed of cinnamon oil and litsea cubeba oil on BQM
2.3 肉桂-山苍子复合精油对霉菌BQM 菌丝结构的影响
如图6所示,图6a、6b 和6c 分别是扫描电镜下观察到的经过0,0.125 和0.25 μL/mL 肉桂-山苍子复合植物精油(V肉桂精油∶V山苍子精油=3∶5)处理的霉菌BQM 菌丝结构。由图6a 可知,未经肉桂-山苍子复合精油处理的菌丝体能够正常生长,菌丝结构完整饱满,粗细均匀;由图6b 所示,经0.125 μL/mL 肉桂-山苍子复合精油处理的菌丝体发生变形,菌丝表面出现明显的干瘪与皱缩;图6c显示,经0.25 μL/mL 肉桂-山苍子复合精油处理后,菌丝体除了出现严重的变形外,还受到严重的损伤,菌丝体表面出现大量的孔洞。这可能是因为植物精油通过靶向作用于细胞膜上关键成分,破坏了霉菌的细胞膜结构,提高膜渗透性,导致细胞内容物和重要离子流失,从而达到抑菌效果[29-30]。

图6 扫描电镜下经不同浓度的肉桂-山苍子复合植物精油处理的BQM 菌丝形态结构Fig.6 Scanning electron micrographs of BQM mycelia treated with different concentration of cinnamon-litsea cubeba mixed oils
3 结论
本研究所选的5 种植物精油对霉变花生优势霉菌BQM 单独作用时,肉桂和山苍子精油对黑曲霉BQM 的抑制效果最好,丁香精油次之;在等体积配比的精油组合中,肉桂-山苍子复合精油的抑菌效果最佳,且FIC 值为0.75,即两者复合后对黑曲霉BQM 的抑制有相加作用;当V肉桂精油∶V山苍子精油=3∶5 时,肉桂-山苍子复合精油的抑菌效果最佳,抑菌圈直径达到45.3 mm。扫描电镜结果显示经过肉桂-山苍子复合精油处理后的黑曲霉BQM 菌丝体发生严重的变形及损伤。据此推测,肉桂-山苍子复合精油对黑曲霉菌BQM 的作用主要是通过破坏其菌丝体结构而达到抑菌效果的。因此,肉桂-山苍子复合精油有望成为花生霉变的抑制剂,应用于花生的贮藏中。

