紫云英苷对急性力竭运动小鼠肝脏组织中miR-155表达的影响
祝锴烨 吴秋雪 罗海静 张伟伟,2* 邵淑丽,2
(1.齐齐哈尔大学生命科学与农林学院,齐齐哈尔 161006;2.抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,齐齐哈尔 161006)
紫云英苷(AG)又名紫云英甙、山柰酚-3-葡萄糖苷、百蕊草素Ⅱ、黄芪苷,分子式为C21H20O11,是一种天然的黄酮类化合物,是多种植物如黄芪、百蕊草、荷叶、杜仲、报春花、桑树叶、荨麻等的生物活性成分之一[1]。陈金川[2]研究发现,紫云英苷作为生物体中的抗氧化剂,能够有效清除氧自由基。Qu等[3]研究发现,紫云英苷提高了雄性Sprague-Dawley大鼠血清中超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)的活性并降低了血清中丙二醛(MDA)的含量。但紫云英苷对过量运动造成的氧化损伤是否有修复作用尚未见报道。
谷丙转氨酶(ALT)又名谷氨酸转氨酶,它能催化L-丙氨酸中的氨基酸转化为α-酮戊二酸,主要存在于肝脏和肾脏中,可参与细胞氮代谢和肝糖异生,ALT是肝脏中最活跃的转氨酶之一,目前常作为肝脏损伤的标志物[4]。超氧阴离子是生物体内氧代谢首先形成的自由基,当自由基相对过剩,会攻击生物大分子如蛋白质、核酸、脂质等,进而破坏细胞的结构和功能。大量研究已经证实,生物体内本身就具有内源性自由基清除系统,具有清除多余自由基的能力,其中包括抗超氧阴离子自由基(ASAFR)[5]。
miRNAs为长度18~25个核苷酸的非编码RNA,在基因表达调控中发挥重要作用。越来越多的研究表明miRNAs参与了体内的氧化还原过程,在氧化应激的过程发挥重要作用,一些miRNAs可以通过诱导自由基生成或抑制抗氧化过程来诱导氧化损伤[6],其中的miR-155和环氧化酶(Cox)表达呈正相关,其过表达生成的自由基是哮喘患者氧化应激的主要来源[7];miR-155还可以靶向叉头框蛋白O1(FOXO1),抑制线粒体自噬,促进MPC5细胞氧化应激损伤[8];此外,miR-155表达增加大鼠原代心肌细胞活力,抑制H9C2细胞凋亡,促进H9C2细胞的氧化应激[9]。在发生肝脏疾病时,miR-155在肝细胞、内皮细胞和炎症细胞中表达上调[10]。此外,miR-155表达升高与急性乙肝患者血清ALT、谷草转氨酶(AST)活性与乙肝e抗原(HBeAg)水平呈正相关[11]。但紫云英苷能否缓解急性力竭运动所导致的肝脏组织氧化损伤,其抗氧化作用是否与miR-155相关的研究尚未见报道。因此,本试验以C57BL/6J雄性小鼠为研究对象,采用急性力竭运动方法制备小鼠肝脏组织氧化应激模型,研究紫云英苷对力竭运动后小鼠血清中谷丙转氨酶(ALT)活性、肝脏组织中抗超氧阴离子自由基(ASAFR)活力和miR-155表达的变化,初步探索紫云英苷抗氧化作用的分子机制。
1 材料与方法
1.1 试验材料
试验动物及饲粮:48只8周龄无特定病原体(SPF)级C57BL/6J雄性小鼠及基础饲粮购自长春亿斯实验动物技术有限责任公司,将6只小鼠放在1个笼子(27 cm×17 cm×13 cm)中。试验开始前动物适应环境1周。
主要试剂:纯度为98%的紫云英苷购自上海源叶生物科技有限公司;ALT和ASAFR检测试剂盒购自南京建成生物工程研究所;蛋白质含量测定试剂盒和Trizol试剂购自美国赛默飞世尔科技有限公司;反转录试剂盒购自上海东洋纺生物科技有限公司,荧光定量PCR试剂盒购自大连宝生物。
仪器设备:Spark10M多功能酶标仪(Tecan,瑞士)、Z32HK高速台式冷冻离心机(Hermle,德国)、TH-86-340-LA(-80 ℃)超低温冰箱(北京天地精仪科技有限公司)、Mastercycler Realplex 4荧光定量PCR仪(Eppendorf,德国)、NanoDropND-2000C微量紫外分光光度计(Thermo,美国)、电子分析天平(北京赛多利斯仪器系统有限公司)。
1.2 试验方法
将48只8周龄C57BL/6J雄性小鼠在实验室饲养1周,基础饲粮喂养,正常饮水,室温环境生存且均做了游泳测试。一次性力竭运动时将小鼠按体质量随机分为4组,二甲基亚砜(DMSO)组、力竭运动组、50 mg/kg紫云英苷组、100 mg/kg紫云英苷组,每组3个重复,每个重复4只。除DMSO组外,其余3组小鼠进行一次性力竭运动4 h;紫云英苷组在力竭运动后分别灌胃50和100 mg/kg的紫云英苷,力竭运动组在力竭运动后灌胃等量生理盐水,DMSO组灌胃等体积生理盐水配制的0.1%DMSO。各组小鼠灌注1 h后断颈处死,取血液,离心制备血清,于冰块上迅速解剖取肝脏,用预冷生理盐水洗去肝脏血渍,滤纸吸干,置于-80 ℃冰箱中保存备用。
1.3 检测指标
1.3.1 抗氧化应激指标测定
按照试剂盒说明对血清和肝脏组织样品进行处理,并测定血清中ALT活性和肝脏组织中ASAFR活力。
1.3.2 氧化相关miRNAs表达测定
从-80 ℃冰箱中取出4组小鼠的肝脏组织样品,各组剪取等量组织,于液氮冷冻研磨后加入Trizol试剂提取总RNA,在NanoDropND-2000C中进行RNA定性和定量分析。各组样品中各取1 μg总RNA,按照ReverTra Ace qPCR RT Master Mix with gDNA Remover说明,使用合成的特异性反转录引物将RNA反转录为cDNA,并以各组反转录合成的cDNA为模板,选取U6基因作为内参,在Eppendorf Mastercycler Realplex 4 PCR仪中进行实时荧光定量PCR(qRT-PCR)。反应体系为10 μL:TB Green Premix Ex TaqⅡ 5 μL,cDNA样品2 μL,上、下游引物各0.5 μL,DEPC-treated H2O 2 μL。反应条件如下:95 ℃预变性30 s,95 ℃ 5 min,60 ℃ 30 s,40个循环,得到miR-378a、miR-15b、miR-1906、miR-155、miR-18a、miR-99a、miR-137、miR-181a、miR-27a的Ct值,用2-△△Ct法计算各miRNAs的相对表达量。所用引物均由上海生物工程有限公司合成,引物信息见表1。

表1 引物信息Table 1 Primer information
1.4 数据统计处理
数据通过GraphPad Prism 5.0软件进行处理分析并作图,以平均值±标准差表示,P<0.05表示差异显著。
2 结果与分析
2.1 急性力竭运动对小鼠血清中ALT活性和肝脏组织中ASAFR活力的影响
由表2可知,与DMSO组相比,急性力竭运动4 h后,小鼠血清中ALT活性提高16.03倍(P<0.05),肝脏组织中ASAFR活力降低43%(P<0.05)。

表2 急性力竭运动对小鼠血清中ALT活性和肝脏组织中ASAFR活力的影响Table 2 Effects of acute exhaustive exercise on ALT activity in serum and ASAFR activity in liver tissue of mouse
2.2 急性力竭运动对小鼠肝脏组织中miRNAs表达的影响
由图1可知,与DMSO组相比,急性力竭运动4 h后,小鼠肝脏组织中miR-378a的相对表达量升高4.33倍(P<0.01),miR-15b的相对表达量升高3.28倍(P<0.01),miR-1906的相对表达量升高6.48倍(P<0.01),miR-155的相对表达量升高6.29倍(P<0.01),miR-18a的相对表达量升高3.80倍(P<0.01),miR-99a的相对表达量升高4.97倍(P<0.01),miR-137的相对表达量升高7.05倍(P<0.01),miR-181a的相对表达量升高3.52倍(P<0.05),miR-27a的相对表达量降低80%(P>0.05)。

“*”表示与二甲基亚砜组相比差异显著(P<0.05),“*”表示与二甲基亚砜组相比差异极显著(P<0.01),“ns”表示与二甲基亚砜组相比差异不显著(P>0.05)。“*” mean significant difference compared DMSO group (P<0.05), “*” mean extremely significant difference compared DMSO group (P<0.01), and “ns” mean no significant difference compared DMSO group (P>0.05).图1 急性力竭运动对小鼠肝脏组织中miRNAs表达的影响Fig.1 Effects of acute exhaustive exercise on miRNAs expression in liver tissue of mouse
2.3 紫云英苷对急性力竭运动后小鼠血清中ALT活性和肝脏组织ASAFR活力的影响
由表3可知,与力竭运动组相比,急性力竭运动后灌胃50 mg/kg紫云英苷使小鼠血清中ALT活性降低77%(P<0.05),肝脏组织中ASAFR活力升高1.77倍(P<0.05);急性力竭运动后灌胃100 mg/kg紫云英苷使小鼠血清中ALT活性降低91%(P<0.05),肝脏组织中ASAFR活力升高1.95倍(P<0.05)。上述结果表明,紫云英苷可显著改善由急性力竭运动造成的小鼠血清中ALT活性提高和肝脏组织ASAFR活力的降低。

表3 紫云英苷对急性力竭运动后小鼠血清中ALT活性和肝脏组织中ASAFR活力的影响Table 3 Effects of astragalin on ALT activity in serum and ASAFR activity in liver tissue of mouse after acute exhaustive exercise
2.4 紫云英苷对急性力竭运动后小鼠肝脏组织中miR-155表达的影响
由图2可知,与力竭运动组相比,急性力竭运动后灌胃50 mg/kg紫云英苷使小鼠肝脏组织中miR-155相对表达量降低66%(P<0.01);急性力竭运动后灌胃100 mg/kg紫云英苷使小鼠肝脏组织中miR-155相对表达量降低60%(P<0.01)。
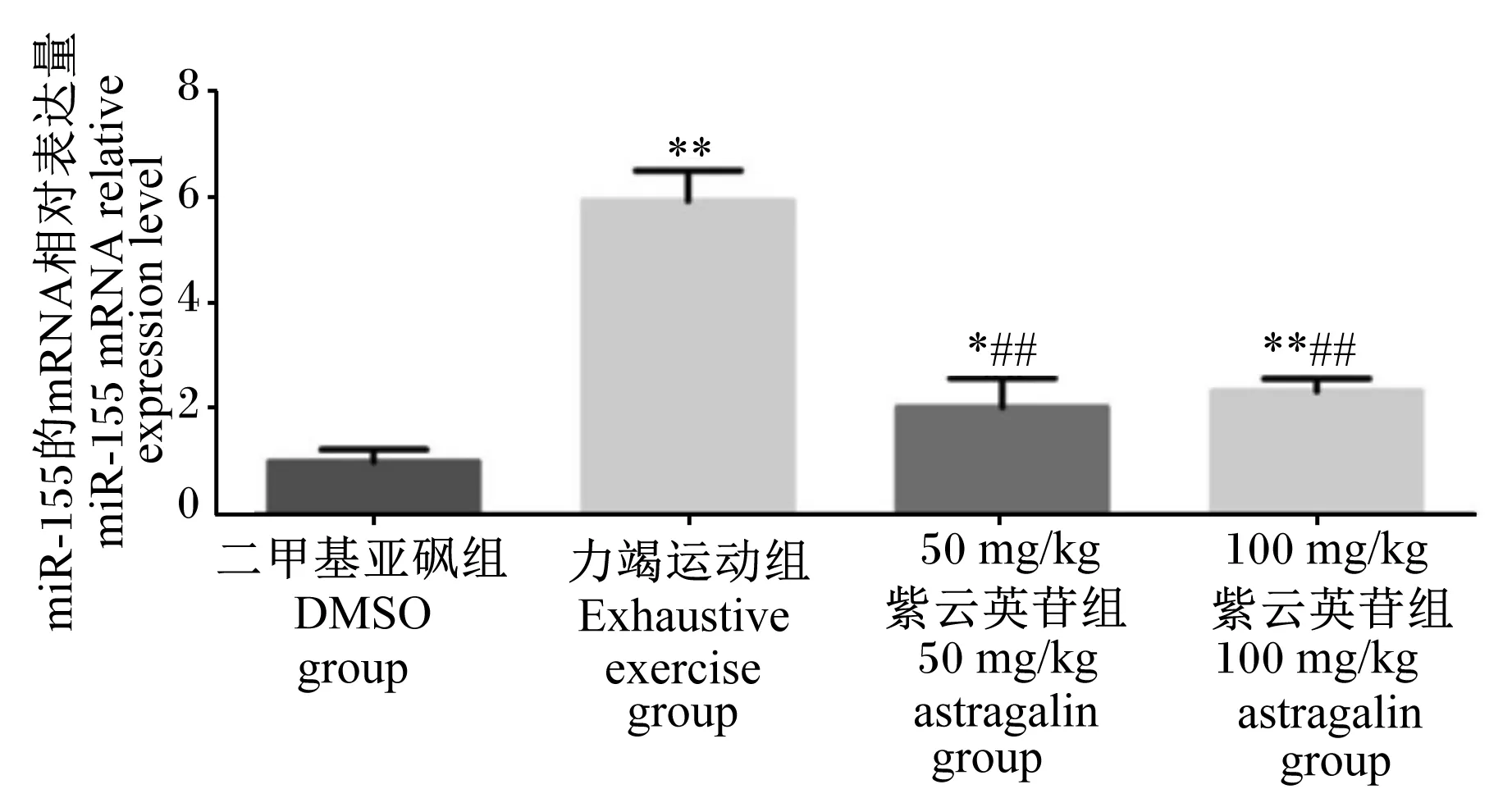
“*”表示与二甲基亚砜组相比差异显著(P<0.05),“*”表示与二甲基亚砜组相比差异极显著(P<0.01)。“##”表示与力竭运动组相比差异极显著(P<0.01)。“*” mean significant difference compared with DMSO group (P<0.05), and “*” mean extremely significant difference compared with DMSO group (P<0.01). “##” mean extremely significant difference compared with exhaustive exercise group (P<0.01).图2 紫云英苷对急性力竭运动后小鼠肝脏组织中miR-155表达的影响Fig.2 Effects of astragalin on miR-155 expression in liver tissue of mouse after acute exhaustive exercise
3 讨 论
不同强度的有氧运动对机体影响并不相同,中低强度的有氧运动对健康有益,而当长时间高强度的有氧运动使机体进入力竭状态时,产生大量的活性氧(ROS),会引起严重的炎症,造成氧化应激以及器官损害。肝脏是代谢内源性和外源性化合物并负责解毒的主要器官,可通过多种途径维持正常的体内平衡。由于在急性力竭运动中作为能量来源的是肝糖原,所以肝脏也是力竭运动后ROS产生的主要来源,当肝脏组织中增加生成2~3倍或更多的ROS,超过正常的生理适应范围时,则导致ROS的积累和抗氧化剂状态的降低,从而增加氧化应激,导致免疫系统功能下降和氧化损伤增加,诱导肝细胞凋亡,使肝脏组织出现纤维化,中心静脉充血,产生炎性浸润和局灶性坏死。造成肝脏组织损伤[12-14]。Lim等[15]研究发现,在高强度运动中,肠上皮的通透性增加,脂多糖(LPS)很容易泄漏到门脉循环中,然后被进一步运输到肝脏。Ruhee等[16]研究发现,急性力竭运动会导致雄性C57BL/6J小鼠的肝脏组织损伤和肝细胞死亡,肝脏组织中促炎细胞因子白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)的mRNA相对表达量显著增加。通常ALT被作为肝组织的病理损伤标志物,血液中ALT活性提高代表肝细胞的膜功能完整性丧失,急性力竭运动会严重损害肝脏,增加血液中ALT活性[17]。氧自由基具有强氧化性,可引起脂质过氧化反应产生脂质过氧化物如MDA等,严重损害机体的组织和细胞,进而引起慢性疾病及衰老效应,同时在生物体内本身就具有清除多余氧自由基的能力,抗氧化物质主要包括SOD、CAT等[5]。研究表明,ASAFR活力作为抗氧化能力的标志物之一,反映了组织清除超氧阴离子自由基的总能力,ASAFR活力下降代表组织内抗氧化能力的下降[18]。本试验中C57BL/6J雄性小鼠一次性游泳4 h后,与DMSO组相比,肝脏组织中ASAFR活力下降、血清中ALT活性升高,该结果与上述研究结果一致,说明4 h游泳运动造成了小鼠肝脏组织抗氧化能力下降和氧化损伤。
肝脏是人类等哺乳动物的主要代谢器官,它充当糖原、脂蛋白、维生素、铁和血液的储存器官。已有研究表明肝细胞和肝脏组织中共有277个miRNAs表达,这些miRNAs参与调节多种代谢途径,因此miRNAs表达的变化可能反映了肝脏组织潜在的损伤[19]。miRNA-155被认为是炎症的重要调节剂,Klieser等[19]研究发现,miR-155的过表达通过抑制过氧化物酶体增殖物激活受体α(PPARα)导致脂肪酸结合蛋白4(FABP4)、乙酰辅酶A羧化酶1(ACC1)和低密度脂蛋白受体(LDLR)表达上调,在肝巨噬细胞和肝星状细胞中释放TNF-α,ROS导致炎症和氧化应激发生。Bala等[20]研究发现,miR-155表达水平的提高促进C57BL/6J小鼠的肝纤维化和酒精引起的脂肪性肝炎。Zhang等[21]研究发现,miR-378a的相对表达量在高血脂症的小鼠肝脏组织中显著提升。Zhang等[22]研究发现,miR-15b在非酒精性脂肪肝疾病(NAFLD)SD大鼠模型和棕榈酸酯诱导的NAFLD LO2细胞模型中高表达。Lu等[23]研究发现,miR-18a在肝硬化和肝癌患者的血清中的相对表达量显著提升。本试验中,C57BL/6J小鼠4 h游泳运动后,与DMSO组相比,miR-155、miR-378a、miR-15b、miR-18a的mRNA相对表达量显著提升,与上述研究结果一致。
在我们前期的研究中,检测了不同浓度紫云英苷灌胃后C57BL/6J雄性小鼠血清中ALT活性的变化,结果表明灌胃50或100 mg/kg紫云英苷均不会对小鼠肝脏组织造成损伤。紫云英苷作为一种黄酮类化合物,具有抗炎、抗氧化的作用。Soromou等[24]研究发现,紫云英苷通过核因子-κB(NF-κB)途径发挥抗炎作用,抑制白细胞介素-1(IL-1)、IL-6和TNF-α等炎症因子的产生。Park等[25]研究发现,紫云英苷可以作为暴露于太阳辐射的皮肤的抗氧化剂并保护可以保护细胞膜免受ROS的损伤。Cho等[26]研究发现,紫云英苷可抑制LPS引起的上皮细胞凋亡和嗜酸性粒细胞增多,并作为LPS诱导的LPS-Toll样受体(TLR)信号网络的拮抗剂。Li等[27]研究发现,紫云英苷对脂多糖(LPS)诱导的小鼠乳腺上皮细胞炎症反应也有抑制作用。Vongsak等[28]研究发现,紫云英苷对过氧化氢(H2O2)诱导的ROS产生抑制作用,并显著降低了H2O2诱导的HEK-293细胞中的ROS产生。在本试验中,与急性力竭运动组相比,小鼠力竭游泳运动4 h后,灌胃50或100 mg/kg紫云英苷均可以显著改善急性力竭运动造成的血清中ALT活性提高和肝脏组织中ASAFR活力的降低,其中ASAFR活力与DMSO组无显著差异,说明50和100 mg/kg的紫云英苷可以作为急性力竭运动造成的小鼠肝脏氧化损伤的抗氧化剂,这一结果与上述研究结果相符,但并未呈现显著的剂量相关性。
研究表明miR-155与肝脏炎症和氧化损伤相关性较高,并且紫云英苷对急性力竭运动后小鼠肝脏组织中miR-155表达的影响较为显著,因此我们检测了急性运动后灌胃紫云英苷对miR-155表达的影响。结果表明,与急性力竭运动组相比,急性力竭运动后灌胃50或100 mg/kg的紫云英苷均可以显著改善急性力竭运动造成的肝脏组织中miR-155相对表达量的提高,与上一结果相同,但miR-155相对表达量的改变并没有呈现对紫云英苷的剂量相关性。
综上所述,我们推测紫云英苷的抗氧化作用与miR-155相关,但紫云英苷抗氧化作用的具体分子机制仍待进一步研究。
4 结 论
紫云英苷可以作为急性力竭运动引起的小鼠肝脏氧化损伤的抗氧化剂,灌胃50和100 mg/kg的紫云英苷均能改善急性力竭运动造成的小鼠血清中ALT活性的提高和肝脏组织中ASAFR活力的降低,并改善急性力竭运动造成的小鼠肝脏组织中miR-155相对表达量的提高。

