饲料中添加甘露寡糖对珍珠龙胆石斑鱼生长性能、血清免疫指标、转录组及肠道菌群的影响
王红明 丁雪婧 陈 俭 宋守钢 谭北平,2 章 双,2*
(1.广东海洋大学水产动物营养与饲料实验室,湛江 524088;2.农业部华南水产与畜禽饲料重点实验室,湛江 524088)

寡糖,又称低聚糖,是一种具有2~20个糖单位的碳水化合物,糖单位间通过糖苷键连接而成。孙青云等[5]研究表明,寡糖能降低动物肠道pH、促进矿物质吸收、促进动物肠道内健康微生物菌群形成和提高动物机体免疫力。而甘露寡糖(mannan-oligosaccharides,MOS)作为一类从酵母细胞壁提取出来的葡萄糖-甘露寡糖蛋白复合物,能参与多种生物功能和多种生理过程,具有吸附病原菌的功能[6]。在家禽[7]和仔猪[8]等动物中已发现,甘露寡糖可通过提高机体肠道的微生态状况,减少胃肠道疾病,从而提高动物免疫功能。甘露寡糖作为绿色添加剂在水产动物研究较为广泛,可以提高水产动物生长性能,优化肠道菌群,促进肠道发育,提高水产动物免疫功能,在半滑舌鳎(Cynoglossussemilaevis)[9]、大黄鱼(Larimichthyscrocea)[10]、奥尼罗非鱼(Oreochromisniloticus×Oreochromisaureus)[11]、泥鳅(Misgurnusanguillicaudatus)[12]、黄颡鱼(Pelteobagrusfulvidraco)[13]、欧洲鳗鲡(Anguillaanguilla)[14]等物种的养殖中均有应用。甘露寡糖在水产动物健康养殖中的积极作用已被广泛证实,但是大多从动物生长性能、生理生化和组织形态改变等宏观层面进行考察,利用高通量测序技术从转录组和肠道菌群方面对甘露寡糖功能进行的研究还不多见。
高通量测序已经成为一种常规的试验技术用于生命科学领域,包括转录水平和肠道菌群分析等。转录组测序(RNA-seq)利用高通量测序来全面快速地获得特定细胞或组织在某一状态下几乎所有转录本的序列信息和表达信息,准确地分析基因表达差异、结构变异和分子标记等生命科学的重要问题[15]。基于16S rRNA基因高通量测序已成为动物肠道菌群结构的形成及多样性分析的常用技术[16]。在水产动物中,高通量测序也已经被广泛应用于转录组和肠道菌群分析,用以研究生长、发育、免疫等相关生命活动的作用机制[17-18]。目前,转录组测序和肠道菌群分析已被用于石斑鱼生长调控、免疫调节等相关的作用机制研究。王登东等[19]和张海艳等[20]采用转录组测序分别分析了云龙石斑鱼杂交生长优势形成的机制和β-葡聚糖调节鱼类免疫系统的作用机制。Ye等[21-22]采用16S rRNA高通量测序发现了花生粕和脱酚棉籽蛋白对珍珠龙胆石斑鱼生长和肠道健康的影响作用。
甘露寡糖已被用于石斑鱼养殖中。Ren等[23]从免疫相关酶活性、免疫相关基因表达、肠道切片以及生长性能等方面研究珍珠龙胆石斑鱼幼鱼,结果表明饲料中添加甘露寡糖料不能改善珍珠龙胆石斑鱼幼鱼的生长性能和饲料利用率,但可以通过改善肠道形态完整性、增强抗氧化能力和非特异性免疫、增加免疫相关基因表达、降低肠道和肝脏中凋亡相关基因的表达来促进肠道健康和维持免疫状态。研究发现,多种鱼类消化道内某些细菌能产生淀粉酶、蛋白质水解酶、脂肪分解酶等胞外酶,用以促进鱼类消化脂肪、蛋白质、淀粉等营养物质的能力,进而提高营养物质的利用率[18]。目前为止,利用高通量测序分析甘露寡糖对石斑鱼影响的研究暂未有报道。基于此,本研究选取珍珠龙胆石斑鱼为研究对象,研究饲料中添加甘露寡糖对珍珠龙胆石斑鱼生长性能、血清免疫指标、转录组及肠道菌群的影响,以探究甘露寡糖调控珍珠龙胆石斑鱼免疫的作用机理,为水产饲料行业寻求替代抗生素的物质提供理论依据。
1 材料与方法
1.1 试验设计与饲料
以鱼粉、豆粕、玉米蛋白粉为主要蛋白质源,以鱼油、玉米油为主要脂肪源,配制基础饲料,基础饲料组成及营养水平见表1。对照组饲喂基础饲料,甘露寡糖组在基础饲料中添加100 mg/kg甘露寡糖。甘露寡糖购自青岛某生物技术有限公司,甘露寡糖添加量参照于朝磊等[9]、Ren等[23]、徐磊等[24]的研究。试验饲料具体制作及营养成分分析方法参照本实验室Ye等[22]、Liu等[25]的研究。

表1 基础饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet (DM basis) %
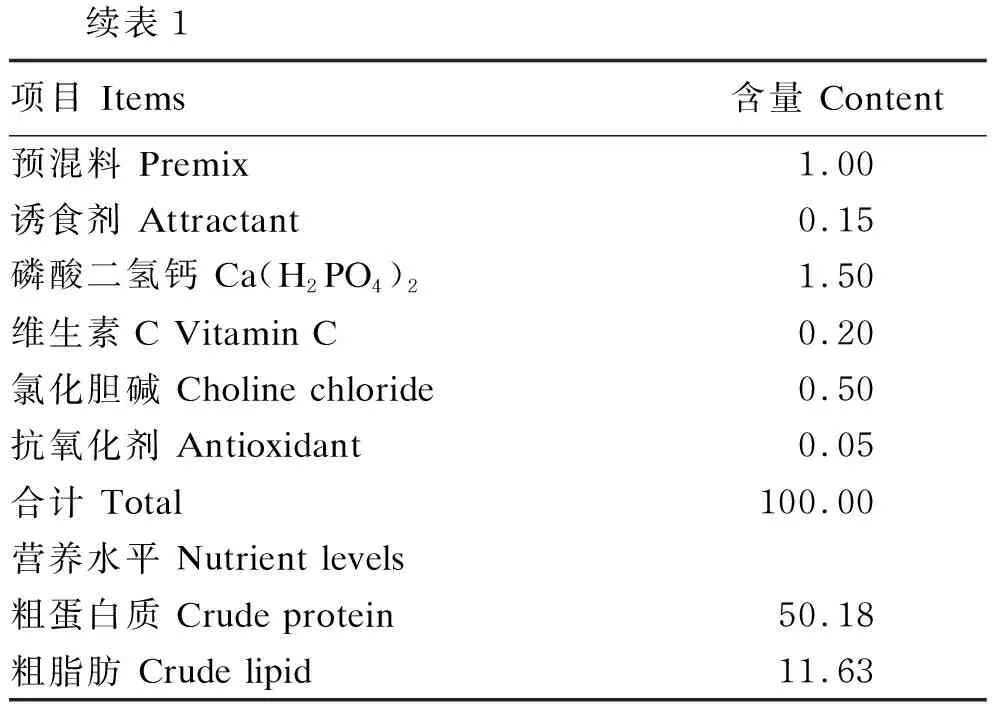
续表1项目 Items含量 Content预混料 Premix1.00诱食剂 Attractant0.15磷酸二氢钙 Ca(H2PO4)21.50维生素C Vitamin C0.20氯化胆碱 Choline chloride0.50抗氧化剂 Antioxidant0.05合计 Total100.00营养水平 Nutrient levels粗蛋白质 Crude protein50.18粗脂肪 Crude lipid 11.63
每千克预混料含 One kg premix contained the following: VA 675 000 IU,VD3180 000 IU,VE 6 000 mg,VK31 200 mg,VB1900 mg,VB21 350 mg,VB61 050 mg,VB127.5 mg,泛酸钙 calcium pantothenate 4 500 mg,烟酸 nicotinic acid 6 750 mg,叶酸 folic acid 375 mg,生物素 biotin 15 mg,维生素C磷酸酯 vitamin C phosphate 42 860 mg,肌醇 inositol 10 000 mg,FeSO4·H2O 64 286 mg,ZnSO4·H2O 26 283 mg,MnSO4·H2O 19 688 mg,Ca(IO3)2·H2O 128.6 mg,CoCl2·6H2O 323 mg,CuSO4·5H2O 2,357 mg,Na2SeO387.6 mg。
1.2 试验用鱼与饲养管理
试验用鱼来源于湛江市南三岛商业养殖基地,购回后于4.5 m×4.9 m×1.8 m的室外水泥池暂养2周,以适应试验条件。试验在玻璃钢桶(0.5 m3)中进行,挑选240尾初始平均体重为(6.00±0.32) g的体质健壮无病的幼鱼,随机分为2组,每组3个重复,每个重复40尾鱼,养殖8周。养殖过程中,每天分别于08:00和17:00按照鱼体重的3%~5%进行饱食投喂2次(第1颗饲料沉入桶底未被摄食视为饱食),投喂量依据摄食情况和天气变化调整。具体养殖条件为:水体温度28~30 ℃,盐度21%~24%,溶氧量≥6.8 mg/L。每天按照换养殖水体1/3的水量换水1次。
1.3 样品采集
试验用鱼在养殖期结束后禁食24 h。记录存活尾数、体重和体长,以进行生长性能分析。从每个重复中随机取8尾鱼,丁香酚麻醉后采用尾静脉取血法抽取全血,每尾鱼抽取1 mL后混合。按照海水鱼淋巴细胞分离液试剂盒(产品编号:P9980,北京索莱宝科技有限公司始)说明书进行操作,得到血细胞和血清样品,于-80 ℃保存待测。其中,对照组和甘露寡糖组中3个重复的血细胞样品分别混合后用于转录组测序,每组中每个重复的血清样品分别用于免疫指标测定。另外,每个重复随机取4尾鱼,取剥离肠道外脂肪组织的后肠混合成为1个样品,置于液氮后于-80 ℃保存待测,用于肠道菌群测定。
1.4 生长性能分析
选用存活率(survival rate,SR)、增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)、肥满度(condition factor,CF)、饲料系数(feed coefficient rate,FCR)作为生长性能指标,参照Ye等[22]和Liu等[25]的研究,分别按以下公式计算:
SR(%)=100×终末尾数/初始尾数;
WGR(%)=100×(终末总重-
初始总重)/初始总重;
SGR(%/d)=100×(ln终末总重-
ln初始总重)/饲喂天数;
CF(g/cm3)=100×鱼体重/鱼体长度3;
FCR=摄入饲料干重/(终末总重+
死亡个体总重-初始总重)。
1.5 血清免疫指标分析
选用超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、酸性磷酸酶(acid phosphatase,ACP)、碱性磷酸酶(alkaline phosphatase,AKP)、溶菌酶(lysozyme,LZM)、丙二醛(malondialdehyde,MDA)作为血清免疫指标进行检测。血清SOD、CAT、ACP、AKP、LZM活性和MDA含量分别采用南京建成生物工程研究所生产的SOD(产品编号:A001-3-2)、CAT(产品编号:A007-1-1)、ACP(产品编号:A060-2-1)、AKP(产品编号:A059-2-2)、LZM(产品编号:A050-1-1)、MDA(产品编号:A003-1-2)试剂盒进行测定。
1.6 血细胞转录组分析
采用TRIzol试剂盒(Invitrogen公司,美国)提取样品总RNA后,委托广州基迪奥生物科技有限公司完成文库的构建和测序工作,建好的测序文库用Illumina HiSeqTM进行测序。去除测序接头和低质量的序列数据过滤原始数据后,采用Trinity Assembly Software软件进行转录本拼接并聚类,取最长转录本为非重复序列基因(Unigene)进行质量评估和统计。所有Unigene分别在6个数据库中进行比对,其中包括Nr、KEGG、Swissprot和KOG数据库。利用错误发现率(false discovery rate,FDR)和log2差异倍数(fold change,FC)来进行筛选,筛选条件为FDR<0.05且|log2FC|>1。对基因进行定量和差异分析,取差异显著的基因用于KEGG和GO富集分析。
1.7 肠道菌群分析

1.8 统计分析
采用SPSS 20.0统计软件对数据进行非配对样本t检验分析,试验数据以平均值±标准误(mean±SE)表示,P<0.05表示差异显著。
2 结 果
2.1 饲料中添加甘露寡糖对珍珠龙胆石斑鱼生长性能的影响
如表2所示,甘露寡糖组珍珠龙胆石斑鱼的终末体重、WGR、SGR和CF均显著高于对照组(P<0.05)。甘露寡糖组和对照组之间珍珠龙胆石斑鱼的FCR和SR无显著差异(P>0.05)。

表2 饲料中添加甘露寡糖对珍珠龙胆石斑鱼生长性能的影响Table 2 Effects of dietary MOS on growth performance of Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus (n=3)
2.2 饲料中添加甘露寡糖对珍珠龙胆石斑鱼血清免疫指标的影响
如表3所示,与对照组相比,甘露寡糖组珍珠龙胆石斑鱼的血清SOD、CAT、LZM和AKP活性均显著升高(P<0.05),血清MDA含量显著降低(P<0.05)。甘露寡糖组和对照组之间珍珠龙胆石斑鱼的血清ACP活性无显著差异(P>0.05)。

表3 饲料中添加甘露寡糖对珍珠龙胆石斑鱼血清免疫指标的影响Table 3 Effects of dietary MOS on serum immune indices of Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus (n=3)
2.3 饲料中添加甘露寡糖对珍珠龙胆石斑鱼血细胞转录组的影响
2.3.1 血细胞转录组测序和序列组装
利用Illumina平台进行测序,如表4所示,除去衔接子并过滤了低质量序列后留下了高质量碱基(clean bases)合计为14 462 786 068 nt。从原始读长(raw reads)滤过后得到97 715 428个高质量读长(clean reads)。其中,对照组从47 953 578个原始读长中产生了46 493 708个高质量读长,甘露寡糖组从52 713 580个原始读长中产生了51 221 720个高质量读长。

表4 转录组测序数据统计Table 4 Transcriptome sequencing data statistics
如表5所示,通过Trinity软件组装获得总长度为74 614 602 nt,Unigene总数为79 291个,Unigene平均长度为941 bp,N50长度为2 141 bp,N90长度为318 bp。

表5 转录组组装数据统计Table 5 Statistics of transcriptome assembly data
进一步对Unigene做质量评估,作长度分布统计图,如图1所示,长度小于1 000 bp的Unigene较集中分布在2 700~2 999 nt区间;长度大于1 000 bp的Unigene有63 455个,占总数80.03%。组装结果表明测序质量良好。

图1 Unigene序列长度统计Fig.1 Unigene sequence length statistics
2.3.2 Unigene功能注释
如图2所示,通过对组装的测序结果分析,一共注释到28 811个Unigene,占比36.34%。其中,在Nr、KEGG、Swissprot和KOG数据库中分别注释到28 664、14 866、19 668和16 506个Unigene。将组装获得的Unigene在Nr数据库中进行比对分析,结果显示注释最多的5个物种分别为大黄鱼(Larimichthyscrocea)(6 381个,22.26%)、盲曹鱼(Latescalcarifer)(6 335个,22.10%)、斑马鱼(Stegastespartitus)(2 493个,8.70%)、革首南极鱼(Nototheniacoriiceps)(1 578个,5.51%)和尼罗罗非鱼(Oreochromisniloticus)(1 128个,3.94%)。

图2 转录组中Unigene的注释 Fig.2 Annotation of Unigene from transcriptome
如图3所示,KOG注释结果显示,32 518个Unigene聚类被分为25个功能类别。Unigene在一般功能预测(general function prediction only)、信号转导(singnal transduction)和翻译后药物、蛋白质转换、伴侣(posttranslational medication, protein turnover, chaperones)3个功能类别中富集最多,含有Unigene数目分别为6 347、6 108和3 129个,分别占比19.52%、18.78%和9.62%。其中,富集于细胞运动(cell motility)功能上的Unigene最少,只有88个。

图3 KOG聚类分析图Fig.3 KOG cluster analysis diagram
如图4所示,通过Blast2GO软件得到Unigene的GO注释信息,分别有17 795、7 625和9 745个Unigene注释到参与到生物过程(biological process)、分子功能(molecular function)和细胞组成(cell component)中。在生物过程一类中,Unigene主要注释到细胞过程(cell process)和新陈代谢过程(metabolic process),分别有4 026和3 557个Unigene。在分子功能一类中,Unigene主要注释到催化活性(catalytic activity)(2 988个Unigene)和结合(binding),分别有2988和3 499个Unigene。在细胞组成一类中,Unigene主要注释到细胞(cell)和细胞部分(cell part),均有2 130个Unigene。

图4 Unigene的GO分类Fig.4 GO classification of Unigene
根据KEGG注释信息可知,总共6 912个Unigene注释到5个特定的通路中,包括生物系统(organism system)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、代谢(mentabolism)和细胞过程。
2.3.3 差异表达基因(differentially expressed gene,DEG)分析
以FDR<0.05且|log2FC|>1为条件筛选甘露寡糖组和对照组之间DEG,结果如图5所示,一共鉴定出9 964个DEG,包含3 801个上调表达基因和6 163个下调表达基因。

横坐标表示差异倍数对数值,纵坐标表示FDR的负Log10值。The abscissa represented the logarithm value of difference multiple, and the ordinate represented the negative log10 value of FDR.图5 差异表达基因的火山图Fig.5 Volcano map of DEG
DEG的GO功能富集分析结果如图6所示,分别有5 592、3 131和5 274个Unigene注释到参与的生物过程、细胞组成和分子功能中。在生物过程一类中,富集到细胞过程的DEG数目最多(72.59%显著下调),其次为新陈代谢过程、单一生物代谢过程。在细胞组成一类中,富集到膜和膜部分中的DEG数目最多,其中膜有53.85%显著下调,膜部分有47.34%显著下调。在分子功能一类中,富集到结合中的DEG数目最多,有66.98%显著下调。

图6 差异表达基因的GO功能富集分析Fig.6 GO functional enrichment analysis of DEG
DEG的KEEG富集分析如图7所示,共有741个DEG被注释到171个通路中,甘露寡糖和对照组之间差异最大的20条KEGG富集通路中,与新陈代谢有关且差异显著的信号通路有11个,分别为烟酸与烟酰胺代谢(nicotinate and nicotinamide metabolism)、精氨酸生物合成(arginine biosynthesis)、微生物在不同环境中的代谢(microbial metabolism in diverse environments)、泛酸与CoA生物合成(pantothenate and CoA biosynthesis)、初级胆汁酸生物合成(primary bile acid biosynthesis)、酪氨酸代谢(tyrosine metabolism)、芳香族化合物的降解(degradation of aromatic compounds)、D-谷氨酰胺与D-谷氨酸代谢(D-glutamine andD-glutamate metabolism)、亚油酸代谢(linoleic acid metabolism)、碳代谢(carbon metabolism)、初级胆汁酸生物合成(primary bile acid biosynthesis)。与免疫有关且差异显著的信号通路有4个,分别为吞噬体(phagosome)、细胞黏附分子(cell adhesion molecules)、细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction)、免疫球蛋白A产生的肠道免疫网络(intestinal immune network for IgA production)。其中,吞噬体和细胞黏附分子信号通路为显著富集DEG数目最多的2条信号通路,含有DEG数目分别为52和46个。此外,细胞因子-细胞因子受体相互作用信号通路中显著富集的DEG数目有34个,免疫球蛋白A产生的肠道免疫网络信号通路中显著富集的DEG数目有13个。

图7 差异表达基因KEGG富集分析Fig.7 KEGG enrichment analysis of DEG
2.4 饲料中添加甘露寡糖对珍珠龙胆石斑鱼肠道菌群的影响
2.4.1 珍珠龙胆石斑鱼肠道菌群多样性分析
珍珠龙胆石斑鱼肠道菌群α多样性分析如表6所示,甘露寡糖组珍珠龙胆石斑鱼肠道菌群的OTU数量、Ace指数、Chao1指数和Shannon指数均显著高于对照组(P<0.05),甘露寡糖组和对照组之间Simpson指数无显著差异(P>0.05)。
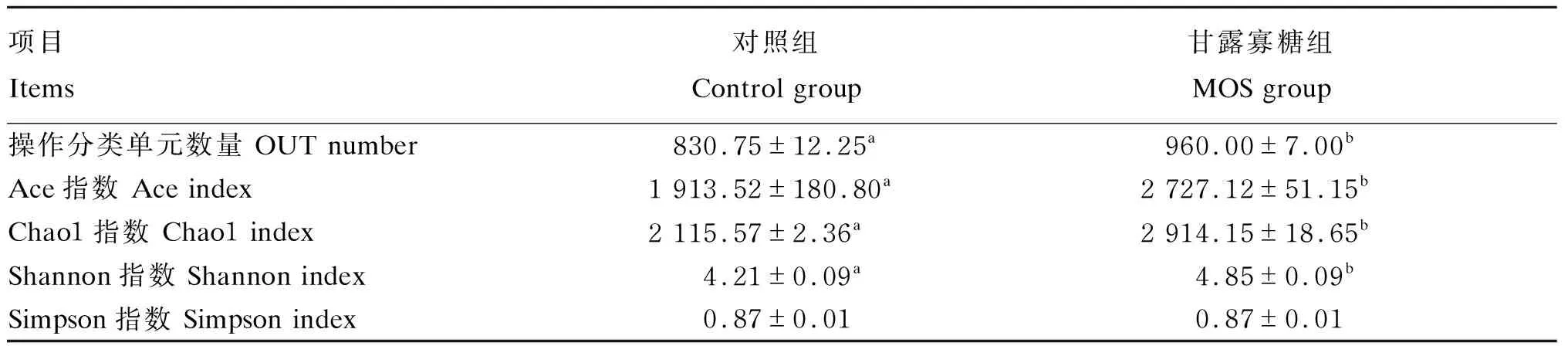
表6 珍珠龙胆石斑鱼肠道菌群α多样性分析Table 6 Alpha diversity analysis of intestinal microflora of Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus (n=3)
基于加权Bray-Curtis距离进行的PCoA如图8所示,2个PCoA轴占2组之间变异的80.09%。甘露寡糖组在图的下方,靠近主坐标(PCo1),占总变化的71.52%。β多样性分析结果表明不同处理可显著影响肠道菌群的组成。

图8 主坐标分析Fig.8 PCoA
2.4.2 肠道菌群组成
珍珠龙胆石斑鱼肠道门水平菌群组成如图9所示,在门水平上,对照组和甘露寡糖组珍珠龙胆石斑鱼肠道中的菌群组成相同,包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、蓝藻门(Cyanobacteria)和厚壁菌门(Firmicutes),四者总相对丰度都超过了98%,还有部分未鉴定出及相对丰度极少的门类。不同门类菌群在2组中相对丰度有差异,甘露寡糖组中变形菌门相对丰度小于对照组,而拟杆菌门、蓝藻门、厚壁菌门相对丰度高于对照组,其中,甘露寡糖组拟杆菌门和厚壁菌门相对丰度显著高于对照组(P<0.05)。

A:单个样品中菌群相对丰度;B:不同组中菌群的平均相对丰度;C:优势菌群相对丰度比较。*代表与对照组差异显著(P<0.05)。下表同。A: microflora relative abundance of single sample; B: microflora mean relative abundance of indifferent groups; C: comparison of dominant microflora relative abundance. * mean significant difference compared with the control group (P<0.05). The same as below.图9 珍珠龙胆石斑鱼肠道门水平菌群组成Fig.9 Intestinal microflora composition at phylum level of Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus
如图10所示,在属水平上,对照组和甘露寡糖组珍珠龙胆石斑鱼肠道中菌群组成相同,包括无色杆菌属(Achromobacter)、德沃斯氏菌属(Devosia)、盐单胞菌属(Halomonas)、甲基杆菌属(Methylobacterium)、发光杆菌属(Photobacterium)、红游动菌属(Rhodoplanes)和鞘氨醇单胞菌属(Sphingomonas)。与对照组相比,甘露寡糖组中发光杆菌属相对丰度显著下降(P<0.05),而德沃斯氏菌属、盐单胞菌属和甲基杆菌属相对丰度显著升高(P<0.05)。

图10 珍珠龙胆石斑鱼肠道属水平菌群组成Fig.10 Intestinal microflora composition at genus level of Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus
3 讨 论
3.1 饲料中添加甘露聚糖对珍珠龙胆石斑鱼生长性能的影响
基于国内外研究,饲料中添加甘露寡糖对畜禽类动物幼体有促进生长的作用[8,26]。而饲料中添加适宜的甘露寡糖是否能够有效促进水产动物生长性能尚存在较大的争议[23]。Lu等[27]研究发现,饲料中添加不同水平的甘露寡糖可提高草鱼(Ctenopharyngodonidella)幼鱼终末体重和WGR。马志红等[28]研究发现,饲料中添加1 g/kg甘露寡糖添能显著提高鲤鱼(Cyprinuscarpio)的WGR,降低FCR。高瞻[29]研究表明,饲料中添加甘露寡糖可以降低花鲈(Lateolabraxjaponicas)机体水分含量,同时提高机体粗脂肪和粗蛋白质含量,有效改善鱼肉的品质,提高WGR,降低FCR。本试验中,饲料中添加100 mg/kg甘露寡糖显著提高了珍珠龙胆石斑鱼的终末体重、WGR、SGR和CF,但对SR和FCR无显著影响。但是,Ren等[23]在饲料中添加甘露寡糖的研究表明,添加0.3%~2.0%的甘露寡糖对龙虎斑的生长性能均无显著影响,这可能与甘露寡糖的添加量有直接关系,0.3%~2.0%的甘露寡糖添加量与其他研究相比,明显高出许多。总体而言,上述研究表明,尽管养殖品种有所差异,饲料中添加适量的甘露寡糖可显著提高动物的生长性能。
3.2 饲料中添加甘露寡糖对珍珠龙胆石斑鱼血清免疫指标的影响
SOD可催化氧自由基对过氧化氢和分子氧的歧化作用,提高吞噬细胞防御功能,在动物机体抗氧化防御系统中起重要作用[30]。LZM是一种水解N-乙酰壁酸和N-乙酰葡糖胺的酶,是生物体内重要的免疫因子之一,已在鱼类组织、血清和黏液中发现,并且大量存在于血细胞中。AKP是一种非特异性磷酸水解酶,可催化磷酸单脂的水解,促进磷酸基团的转移反应,在动物代谢中发挥重要调控作用[31]。CAT可清除细胞内活性氧自由基,是一种保护细胞膜结构完整的酶类[32]。甘露寡糖具有抗原的特性,能够刺激动物机体做出免疫应答反应[30]。本试验中,饲料中添加甘露寡糖显著提高了珍珠龙胆石斑鱼血清中SOD、AKP、LZM和CAT活性。与本试验结果一致的是,饲料中添加甘露寡糖显著提高半滑舌鳎(Cynoglossussemilaevis)稚鱼体内SOD、CAT和LZM活性,提高肠道发育和非特异性免疫水平[9];饲料中添加0.2%~0.3%魔芋甘露寡糖可以显著增强黄颡鱼血清SOD和LZM活性,增加其免疫器官指数[33];杨敏等[14]在饲料中添加适宜的甘露寡糖,可显著提高欧洲鳗鲡血清SOD、AKP、LZM活性。刘爱君等[11]研究发现,饲料中添加甘露寡糖能显著提高奥尼罗非鱼血清SOD和AKP活性。MDA是一种有害物质,其含量的升高是氧自由基过多产生的一种反应,损害细胞膜的流动性,MDA含量降低表明对机体产生的毒性降低。此外,在本研究中,甘露聚糖组珍珠龙胆石斑鱼血清MDA含量较对照组显著降低,这与Lu等[27]在草鱼中的研究结果一致。上述研究都表明饲料中添加甘露寡糖能在一定程度提高动物机体的免疫相关酶活性,从而提高动物免疫功能。
3.3 饲料中添加甘露聚糖对珍珠龙胆石斑鱼血细胞转录组的影响
转录组研究可基于特定条件下基因的表达信息来推测未知基因的功能,进而揭示基因在相应通路中的作用机制。在鱼类中,转录组测序已被广泛应用,主要用途包括检测基因功能、筛选DEG及开发分子标记等。例如张海艳等[20]对β-葡聚糖刺激下斜带石斑鱼转录组进行了分析,获得了DEG以及免疫相关条目,并筛选出部分显著性差异表达的免疫基因。石立冬等[34]研究牛磺酸对红鳍东方鲀的热应激调控的影响,获得了DEG的数据以及DEG注释的具体通路,为研究牛磺酸对红鳍东方鲀的热应激调控的影响和牛磺酸抗应激功能提供参考数据。朱婷芳等[35]对大弹涂鱼单核巨噬细胞低氧胁迫比较转录组学分析,获得了不同时间巨噬细胞转录组数据,并且筛选出了相关DEG。珍珠龙胆石斑鱼作为重要的海水养殖品种,其全基因序列还未公布,从基因水平研究饲料中添加甘露寡糖对珍珠龙胆石斑鱼免疫保护机制存在限制。本研究通过转录组测序技术,鉴定出DEG显著影响了鱼体细胞组成、细胞代谢过程和分子功能等方面,这些改变暗示了细胞组织结构与功能可能发生了重大改变。本研究中发现具有最多Unigene的条目是结合、催化活性、细胞过程、代谢过程和细胞组成,这些过程对机体正常生命活动很重要。此外,KEEG通路富集分析发现,DEG被注释到171个通路中,与免疫紧密相关的吞噬体通路、细胞黏附因子通路、细胞因子-细胞因子受体通路以及免疫球蛋白A产生的肠道免疫网络通路差异显著,且显著富集的DEG数目较多,其中吞噬体通路和细胞黏附因子通路是显著富集DEG数目最多的2条信号通路,这些结果提示甘露寡糖的添加对珍珠龙胆石斑鱼的免疫功能产生了显著影响。吞噬体是通过吞噬固有免疫细胞摄取颗粒而形成的高度动态的细胞器,在微生物清除和抗原呈递中发挥关键作用[36]。细胞黏附分子是介导细胞间或细胞与细胞外基质间相互接触和结合分子的统称,以受体-配体结合的形式发挥作用,参与多种细胞活动,是免疫应答、炎症发生等重要生理病理过程的分子基础[37]。细胞因子是指主要由免疫细胞分泌的小分子多肽,具有调节固有免疫和适应性免疫、血细胞生成、细胞生长等多种功能,其发挥作用是通过与靶细胞膜表面的受体相结合并将信号传递到细胞内部而完成的,在免疫应答过程中发挥重要调节作用[38]。由此可见,饲料中添加甘露寡糖调控珍珠龙胆石斑鱼的免疫功能的可能机制是甘露寡糖的摄入激活鱼体内免疫细胞中吞噬体的产生,进而通过细胞黏附分子信号通路将信号传递,刺激产生细胞因子,起到免疫调节作用。这一机制在单胃动物的研究中已被提出[39],但在鱼类中还有待进一步证实。
3.4 饲料中添加甘露寡糖对珍珠龙胆石斑鱼肠道菌群的影响
肠道本身具有重要的功能,肠道微生物的作用也不可忽视,肠道有益菌群具有营养、免疫、抑制病原菌、定植阻抗等作用[40],而有害菌会使黏膜层渗透性增加,让病原和食物大分子穿过黏膜屏障[41]。肠道微生物对鱼类的健康也发挥重要作用。在斑马鱼(Daniorerio)中,肠道微生物可以调节消化道基因的表达,促进营养代谢和免疫反应[42]。在人类及其他哺乳动物、爬行动物蛇[43]和蜥蜴[44]、青石斑鱼[45]肠道菌群中,厚壁菌门和拟杆菌门为优势菌群,其中的大部分细菌参与了食物的消化和代谢。本研究中,饲料中添加甘露寡糖后,珍珠龙胆石斑鱼肠道中拟杆菌门和厚壁菌门相对丰度较对照组显著升高。拟杆菌门和厚壁菌门是人类肠道内的优势有益菌,结合本研究中甘露寡糖对珍珠龙胆石斑鱼免疫的促进作用可知,饲料中添加甘露寡糖可能通过提高珍珠龙胆石斑鱼肠道中有益菌的相对丰度进而使其免疫功能得到提高,这一结果与谭蓉等[46]的研究结果中肠道炎症伴随着拟杆菌门相对丰度的下降相吻合。饲料中添加甘露寡糖后珍珠龙胆石斑鱼肠道菌群在属水平上相对丰度的变化也进一步说明了这一点。与对照组相比,甘露寡糖组石斑鱼肠道中发光杆菌属相对丰度显著下降,而德沃斯氏菌属、盐单胞菌属和甲基杆菌属相对丰度显著升高。发光杆菌属属于弧菌科,由弧菌属细菌引起的疾病是目前水产养殖中危害最大的细菌性疾病[47]。德沃斯氏菌属、盐单胞菌属和甲基杆菌属则是3种已知的益生菌[48]。类似地,王琨等[49]、何远法等[50]和张琴等[51]分别在牙鲆、对虾凡纳滨和刺参中研究发现,饲料中添加甘露寡糖可显著降低肠道弧菌的数量。综合而言,本研究结果表明甘露寡糖可通过调节肠道菌群平衡来提高珍珠龙胆石斑鱼免疫功能,该结果与转录组测序结果相吻合,转录组测序结果表明,免疫球蛋白A产生的肠道免疫网络相关信号通路被显著激活,这也为深入研究甘露寡糖提高鱼类免疫力的作用机制提供了重要参考。
4 结 论
饲料中添加100 mg/kg甘露寡糖可以改善珍珠龙胆石斑鱼的生长性能和肠道菌群结构,提高机体免疫功能,并在转录组水平产生有利的免疫应答效应。

