盐酸小檗碱改善高脂诱导的小鼠非酒精性脂肪肝机制
张秀茹,李婷婷,刘淑文,吴启赐,林志超,潘裕添,古丽米然·阿里同别克
(闽南师范大学菌物产业工程技术中心,福建漳州363000)
非酒精脂肪肝(NAFLD)是一种慢性疾病,被认为是长期高脂肪饮食的结果,其特征是肝脏脂肪堆积,出现炎症和肝组织损伤[1]。NAFLD的临床范围从单纯性脂肪变性到不可逆转的非酒精性脂肪肝炎(NASH),表现为较强的炎症和组织损伤。
盐酸小檗碱(BBR),又名黄连素,是中药黄连的主要成分,基本结构为苯基四羟基喹啉,主要用于腹泻和炎症的治疗。相关研究表明:BBR能显著改善脂代谢紊乱及胰岛素敏感性[2],通过抑制巨噬细胞的促炎因子的表达、分泌以及激活细胞内NF-κB等炎症信号通路,从而改善脂肪细胞的葡萄糖代谢和炎症反应[3],另外,BBR能够通过增高Nrf2的核内表达,降低氧化应激水平,减轻炎症状态,进而缓解NAFLD[4]。目前,BBR在NAFLD的治疗方面是否具有抑制脂肪合成,同时抑制炎症通路激活的双重调控作用尚不清楚。因此,本研究通过高脂饲料诱导构建小鼠NAFLD,观察小鼠肝脏的变化,并初步探讨BBR调节炎症以及抑制脂肪合成的作用机制,以期为NAFLD的治疗提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 药物与试剂
BBR(货号:T4S0797,纯度为97.01%),上海陶素生物科技有限公司;谷丙转氨酶(ALT)、谷草转氨酶(AST)试剂盒,南京建成生物工程研究所;Toll样受体4(TLR4)抗体(abcam,ab13556)、IκBα抗体(abcam,ab32518)、p-IκB抗体(abcam,ab113133)、甾醇调节元件结合蛋白-1c(SREBP-1c)抗体(abcam,ab191857),英国abcam公司贸易有限公司。
1.1.2 实验动物
SPF级C57BL/6小鼠,雄性,8周龄,上海斯莱克实验动物有限责任公司。动物房室内保持12 h昼夜节律,温度(25±2) ℃,自由饮食饮水。
1.1.3 细胞实验
HepG2细胞用含有总体积10%的胎牛血清、100 μ/mL青霉素和100 μg/mL链霉素培养基培养在体积分数5% CO2和37 ℃的培养箱中。
1.2 方法
1.2.1 动物分组
将24只小鼠随机分成3组,即普通饲料喂养组(Control)、高脂饲料喂养组(HFD)、BBR给药组(HFD +BBR),每组8只。
1.2.2 造模及给药
对HFD组与HFD+BBR组的小鼠进行HFD高脂喂养8周,造模完成后,HFD+BBR组每天用200 mg/kg BBR灌胃,4周后处死小鼠,收集血液和肝脏(前一晚禁食不禁水)。
1.2.3 肝脏指数及指标的测定
肝脏指数 =肝脏重量(g)/体质量(g)
全自动生化分析仪检测ALT和AST的含量,作为肝脏指标。
1.2.4 肝脏组织的病理观察
参考丁静等[4]的方法,用石蜡包埋肝脏组织,切成4 μm薄片,放入60 ℃烘箱烘干,先后浸泡于二甲苯溶液中15 min,重复3次;置于无水乙醇中浸泡min,重复2次;置于体积分数为95%乙醇溶液中浸泡5 min,重复2次;置于体积分数为85%乙醇溶液中浸泡5 min,1次;置于体积分数为75%乙醇溶液中浸泡5 min,1次;置于体积分数为50%乙醇溶液中5 min,1次。之后进行常规HE染色,置于显微镜下观察,分析小鼠肝脏的病理学变化。
1.2.5 蛋白免疫印迹实验
参考姚笑睿等[5]的方法,从小鼠肝组织中提取总蛋白,以免疫印迹法检测SREBP-1c、TLR4、p-IκB、IκBα的表达情况。
1.2.6 NAFLD体外造模及给药
参考Fang等[6]的方法,用棕榈酸(PA)建立体外NAFLD模型。本研究选用PA的最大无毒浓度(0.258 mmol/L)的培养液孵育HepG2细胞24 h。BBR给药组中PA与PA+BBR同时给药处理24 h。
1.2.7 细胞油红O染色
油红O染色测定HepG2细胞脂质含量。细胞用预冷的磷酸缓冲溶液(PBS)洗涤2次,在体积分数为4%多聚甲醛中固定30 min,再用油红O工作液室温孵育30 min,然后用体积分数为60%异丙醇脱色。用PBS洗涤3次后,苏木精再反染30 s,后置于光学显微镜下拍照。
1.2.8 统计学分析
数据采用 GraphPad Prism 7.0程序进行统计分析。所有数据均用x±s表示,不同分组间采用单因素方差分析统计,并用LSD检验或t检验作两两比较。其中P<0.05为差异,具有统计学意义。
2 结果与讨论
2.1 BBR对小鼠肝脏指数的影响
为了验证BBR对肝脏指数的影响,设计3组不同处理方式的实验对小鼠进行检测,结果见图1。由图1可以看出:与对照组相比,HFD组小鼠的肝脏指数相对较高,经BBR处理后则显著降低。其中,HFD诱导的小鼠的肝脏指数P小于0. 000 1。该结果还表明:HFD诱导的NAFLD小鼠肝脏出现明显的肿胀现象,BBR则可以缓解NAFLD小鼠的肝脏肿胀程度。

图2 经BBR处理NAFLD小鼠肝损伤的抑制作用(HE×100)Fig.2 Liver injury of mice during NAFLD alleviated by BBR treatment(HE×100)
2.2 BBR对小鼠肝组织形态及病理变化的影响
肝组织形态及病理表征对BBR的药理学研究具有重要的参考价值。为了观察经BBR处理后是否会缓解高脂饮食脂肪肝和炎症反应,对肝组织进行了切片染色(图2)。
由图2可知:对照组肝小叶结构清晰分明,肝细胞紧密相连整齐排列,几乎没有脂肪细胞,汇管区也几乎没有炎症细胞;其中,HFD组肝细胞膨胀,排列稀疏,细胞胞质内有许多脂滴空泡,细胞核移至边缘,汇管区有炎症细胞浸润;HFD+BBR组较HFD组脂肪变性显著减轻,炎症细胞减少。该结果提示:HFD组小鼠肝脏发生明显的脂肪化以及炎症反应,经BBR处理后,则可以缓解HFD诱导的NAFLD小鼠的肝脏脂肪化以及炎症反应。
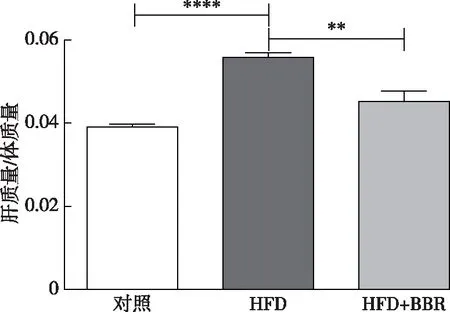
**表示 P<0.01,****表示 P<0.000 1图1 BBR降低NAFLD小鼠肝脏指数Fig.1 Liver index of mice during NAFLD decreased by BBR(n=8)
2.3 BBR对小鼠肝脏生化指标的影响
肝组织中ALT的高低通常可反映肝细胞的损伤程度,患有NAFLD时,ALT水平通常会增高[7]。随着肝细胞损伤程度的不同,AST升高的程度依次出现的病症分别是慢性肝炎、肝癌、肝硬化、急性肝炎、重症肝炎[8]。通过检测肝脏中ALT、AST的水平发现:图3与对照组相比,HFD组肝脏中ALT、AST的水平显著升高;与HFD组相比,HFD+BBR组肝脏中ALT、AST的水平显著下降。该结果提示:HFD诱导的NAFLD小鼠肝脏功能受损,经BBR处理后可以缓解小鼠肝功能的损伤(图3)。
2.4 BBR对小鼠肝脏SREBP-1c和TLR4/IκBα的影响
SREBP-1c是脂肪合成酶(FAS)等成脂蛋白的主要调节因子[9]。BBR对小鼠肝脏SREBP-1c和TLR4/IκBα的影响见图4。由图4可知:与对照组相比,HFD组中脂肪合成酶主要调节因子 SREBP-1c蛋白水平升高,BBR则通过干预,降低了小鼠肝脏中SREBP-1c蛋白的表达水平。该结果提示了HFD诱导小鼠肝脏的脂肪合成,经BBR处理后,则可以抑制HFD诱导的脂肪合成。细胞外抗原可以被TLR4特异性识别,并将被识别的细胞外信号转导入细胞内NF-κB。NF-κB是多种细胞因子产生的重要调控者,可调节炎症基因的表达[10],从而使炎症基因在脂肪性肝炎中被激活[11]。与对照组相比,HFD组中介导炎症反应的蛋白TLR4蛋白水平升高,经BBR干预后,可降低小鼠肝脏中TLR4蛋白的表达水平,并且与对照组相比,HFD组中NF-κB信号通路的关键蛋白IκBα水平降低,磷酸化水平升高;与HFD组相比,HFD+BBR组IκBα蛋白水平升高,并且可以抑制小鼠肝脏中IκBα蛋白的磷酸化表达。该结果提示了由HFD诱导的小鼠肝脏炎症反应,可以经BBR抑制其诱导的炎症反应(图4)。
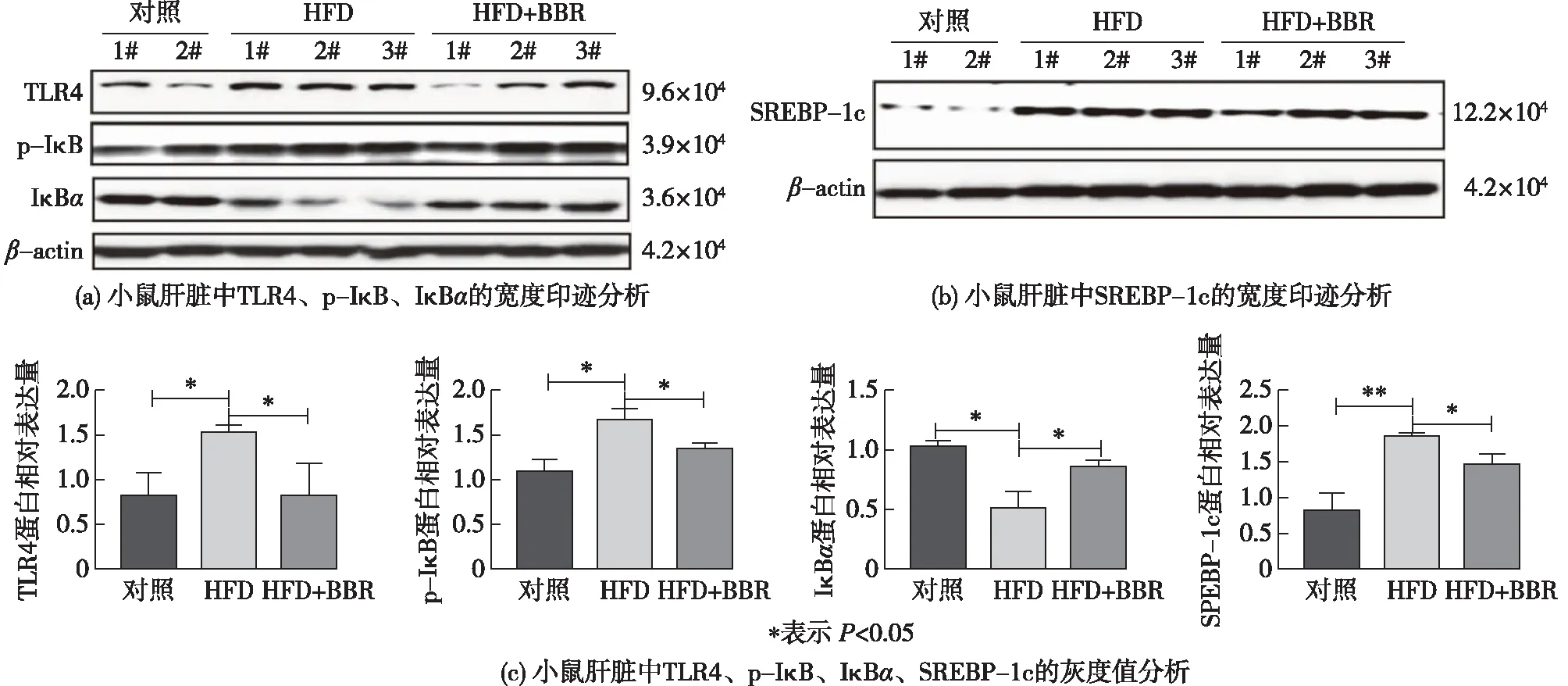
图4 BBR调节HFD诱导的小鼠肝脏组织中TLR4、p-IκB、IκBα、SREBP-1c 的表达Fig.4 Expression of TLR4,p-IκB,IκBα and SREBP-1c in liver of mice with HFD adjusted by BBR treatment
2.5 BBR对小鼠体外PA诱导的细胞内脂质堆积的影响
油红O染色检测脂质在HepG2细胞中的积聚情况见图5。由图5可知:与对照组相比,PA处理组细胞内脂质堆积、脂滴增多;BBR组细胞染色变浅,脂滴明显减少。该结果说明:经BBR处理可以降低PA诱导的HepG2细胞的脂质含量。

图5 BBR改善PA诱导的HepG2细胞脂质堆积Fig.5 BBR improves the lipid accumulation of HepG2 cells induced by PA
3 结论
由于NAFLD的发病率和流行性不断增加,筛选出治疗NAFLD的药物已经变得刻不容缓。本研究通过对小鼠体内与体外相结合的方式,探讨BBR对高脂诱导的脂肪肝的保护机制。经小鼠体内实验结果表明:高脂饮食可诱发小鼠脂肪肝以及炎症细胞的增多,BBR能显著减少肝细胞内脂肪沉积以及炎症细胞数量。与对照组相比,高脂饲料喂养的小鼠的组织病理学改变会导致肝脏中ALT、AST的含量增加,BBR药物在减轻高脂饮食对肝功能指标的影响方面具有显著的治疗效果。研究还证实:经BBR显著下调TLR4的表达量,可以抑制IκBα的磷酸化激活,并且能抑制SREBP-1c的表达。体外实验油红O染色检测结果表明:BBR显著降低了经PA诱导的肝细胞脂质含量。
综上可知:BBR可以通过抑制SREBP-1c的活性,从而抑制脂肪的合成,同时抑制TLR4/NF-κB通路的触发,进而减轻肝脏炎症。基于BBR的抗炎和抗脂双重调节作用,有望成为治疗NAFLD的药物,但其分子机制仍有待进一步地深入探究。

