雷公藤甲素抑制PGC-1α诱导的小鼠睾丸和附睾损伤及其分子作用机制
任朝兴,朱志铭,顾春阳,邓哲文,胡文俊,谢王栩,陈佳怡,马 博
(南京工业大学药学院,江苏南京211800)
雷公藤甲素(triptolide, TP)作为中药雷公藤(TWHF)的主要活性成分[1],具有抗风湿、抗肿瘤、消肿止痛以及治疗狼疮性肾炎等免疫性疾病的药理学作用[2]。虽然TP在临床上对众多疾病具有良好的疗效,但长期使用后容易对机体产生严重的毒副作用,如:肝脏毒性、肠道毒性以及生殖毒性等[3-4],尤其会造成男性不育,是限制其临床应用的重要原因。因此,研究TP对男性生殖系统的毒性作用及其机制,将有助于推动TP及其衍生物的进一步开发和规范其临床使用。
Wang等[5]研究发现:TP可以有效抑制Ras相似物GTP酶(Rho GTPases),导致睾丸支持细胞骨架发生异常改变,破坏细胞与细胞之间的连接,是导致生精异常的主要原因。Wang等[6]的前期研究结果显示:TP可以干扰睾丸组织的能量代谢行为,产生大量活性氧,抑制体内抗氧化的转录因子,即核因子E2相关因子(Nrf 2)的激活,诱导c-Jun氨基末端激酶(JNK)依赖的凋亡通路,导致睾丸支持细胞损伤,从而造成生精功能障碍。睾丸间质细胞凋亡及睾酮分泌水平的降低也是导致生精功能障碍的主要原因之一,由此可见睾丸组织可能是TP诱发生精子功能障碍的主要靶组织。除此之外,TP诱导的精原细胞凋亡也是导致精子异常的原因[7]。而对于作为输送、贮存和促进精子成熟的附睾组织,TP对其的毒性作用则鲜有报道。
过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)是一种参与代谢和应激反应的转录辅激活因子[8]。PGC-1α在正常条件下表达,并根据代谢需要或氧化应激反应而发生明显改变[9]。PGC-1α参与大量基因的调控,包括PPAR,核呼吸因子1(NRF1),核呼吸因子2(NRF2),线粒体转录因子A(TFAM),解偶联蛋白2(UCP2)和雌激素相关受体(ERRs)等,并能够调节线粒体的活性氧(ROS)生成[10],是影响线粒体动力学和线粒体质量的重要转录因子[11]。PGC-1α的抑制是导致机体组织功能丧失和损伤的主要原因。
因此,本课题采用TP诱导睾丸和附睾损伤模型,通过从精子形态,睾丸和附睾的组织形态学,氧化应激反应及PGC-1α的表达等方面,全面系统地阐述TP对睾丸和附睾的毒性作用和可能的分子作用机制,以期为进一步阐明该化合物对雄性生殖毒性的药理学作用提供数据支持,并为其今后的临床应用提供理论依据。
1 材料与方法
1.1 实验材料
TP(纯度≥98%),上海源叶生物公司;精子快速染液,南京建成生物工程研究所;免疫组化试剂盒,武汉博士德生物工程有限公司;一抗PGC-1α, 上海Affinity公司;一抗8-羟脱氧鸟苷(8-OHdG),北京Bioss公司;β-actin,美国Cell Signaling Technology(CST)公司;二抗生物素化山羊抗兔(IgG)、三抗链霉亲和素-生物素复合物(SABC),氧化二氨联苯胺(DAB)、苏木素,上海碧云天生物技术有限公司。
1.2 实验方法
1.2.1 模型建立
ICR雄性小鼠16只,体质量(20±2)g,将小鼠随机分成2组,即正常对照组、TP模型组,每组8只。各组的具体给药方式为正常对照组:腹腔注射生理盐水0.1 mL/10 g;模型组:腹腔注射TP给药剂量为120 μg/kg,给药体积为0.1 mL/10 g;以上两组分别连续给药14 d。结束后,将小鼠称质量,处死并收集血液,取睾丸、附睾以备用。
1.2.2 睾丸和附睾的指数
处死小鼠后,即刻取出双侧睾丸、附睾,剥去周围的脂肪组织,记录其质量,并按式(1)和(2)计算睾丸指数和附睾指数[12]。
睾丸指数=睾丸质量(g)/体质量(g)
(1)
附睾指数=附睾质量(g)/体质量(g)
(2)
1.2.3 精子计数与染色
选择一侧附睾,剪碎在37 ℃的生理盐水中,游离出精子,稀释固定后进行精子计数。同时将游离精子进行涂片,固定后用精子染色液染色,先用核染液染色3 min,流水洗净。再用浆染液染色1 min,立即滴加增色液混合5 s,再冲洗干净,显微镜下观察其形态。
1.2.4 睾丸和附睾组织形态学的分析
取右侧睾丸和附睾组织放入质量分数为4%的多聚甲醛固定液中固定48 h,接着经石蜡包埋,切片,二甲苯脱蜡,梯度乙醇脱水。按照文献[13]报道的方法进行HE染色,置于光镜下拍照观察组织微观结构。
1.2.5 氧化应激生化指标的检测
称取睾丸和附睾,按照试剂盒说明书进行样品的预处理,然后使用分光光度计分别测定睾丸和附睾组织中的H2O2,丙二醛(MDA),谷胱甘肽(GSH)的吸光度值,同时将同批次样本用二辛可宁酸(BCA)蛋白浓度试剂盒进行蛋白浓度的测定并进行含量的计算。
1.2.6 免疫组化
切片经二甲苯脱蜡,梯度乙醇脱水,去过氧化氢酶。采用0.01 mol/L枸橼酸钠缓冲溶液微波中高火修复8 min,共3次。用体积分数为0.5%trinton-100打孔,体积分数为5%封闭液封闭,一抗PGC-1α(1∶ 200稀释)和一抗8-OHdG(1∶ 600稀释)共同孵育,4 ℃过夜。随后,磷酸盐缓冲溶液(PBS)液漂洗3 次,滴加二抗IgG,37 ℃孵育1 h。PBS 缓冲液漂洗3次后,滴加三抗SABC,37 ℃孵育30 min。采用DAB显色并用苏木素复染3min,自来水下反蓝后,中性树胶封片,置于光学显微镜下观察拍照。
1.2.7 数据统计
各实验组数据以均数±标准差(Mean± SD) 表示,采用系统统计软件GraphPad Prism 7 进行单因素方差分析(one-way ANOVA),按照参考文献[14]的方法,以P<0.05为差异有统计学意义。
2 结果与讨论
2.1 TP对睾丸和附睾指数的影响
取各组小鼠双侧睾丸、附睾并称质量,考察TP对小鼠睾丸、附睾指数的影响,结果见图1。由图1(a)可知:与正常组相比,TP模型组睾丸指数有显著降低(P<0.001),表明TP会造成小鼠睾丸组织的萎缩。由图1(b)可知:TP模型组的小鼠附睾指数相对于正常组出现了显著下降(P<0.05),表明TP造成了小鼠睾丸以及附睾组织的萎缩。
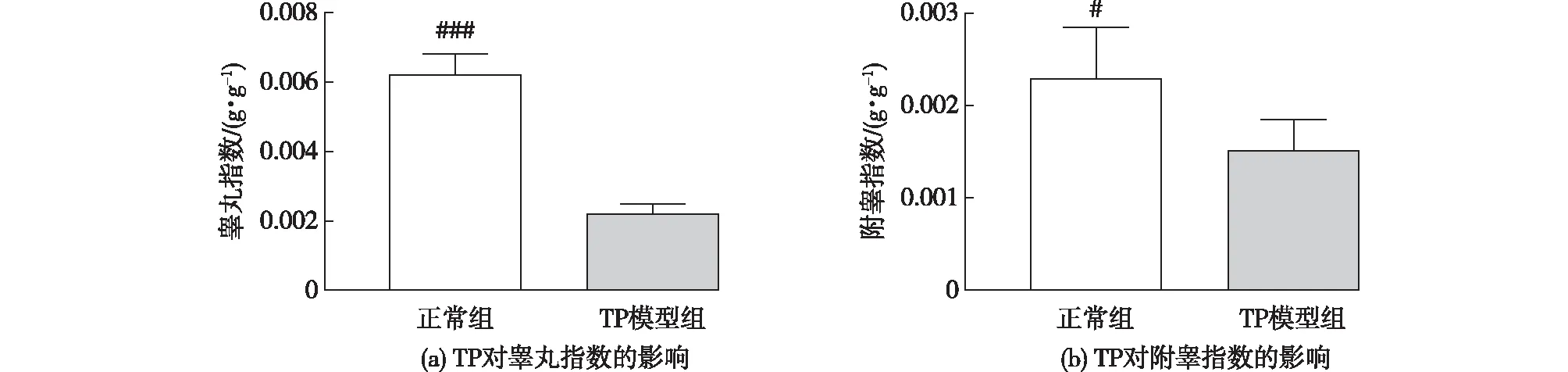
###为TP模型组与正常组相比,P<0.001;#为TP模型组与正常组相比,P<0.05图1 TP对睾丸指数和附睾指数的影响Fig.1 Effects of TP on testicular index and epididymal index
TP对睾丸和附睾形状和大小的影响见图2。由图2(a)可知:小鼠睾丸的TP模型组与正常组在形状上没有出现显著性差异,依旧形如卵圆形。但是在TP的毒性作用下,模型组的睾丸体积相较于正常组出现了明显的缩小,趋向于干扁状,同时表面也不似正常组那样光滑呈浅粉红色,表明TP会导致严重的睾丸萎缩。由图2(b)可知:小鼠的附睾在TP的毒性作用下,形状上与正常组相比也没有显著性差异,但是模型组的附睾头,附睾尾和附睾长度相较于正常组都出现了明显缩短。同时模型组的附睾头和附睾尾体积相较于正常组显著减小,这表明TP会导致附睾萎缩。在李凡等[15]的研究中,当给予大鼠TP 100 μg/kg时,检测到大鼠睾丸变化不明显,反而是附睾出现了显著萎缩,于是判断TP对于生殖系毒性作用的靶器官主要为附睾。通过本次实验在120 μg/kg药物剂量干预下的实验结果表明:TP对于生殖系统毒性作用是通过同时损伤睾丸和附睾来实现的。

图2 TP对睾丸和附睾整体形状和大小的影响Fig.2 Effects of TP on the overall shape and size of testis and epididymis
2.2 TP对精子数量与形态的影响
通过对正常组与TP模型组的精子进行计数和染色,TP对精子数量与形态的影响见图3。如图3(a)所示:给药14 d后,与正常组相比,TP模型组小鼠精子数量显著降低(P<0.001),提示TP造成了小鼠的生精功能异常。同时,如图3(b)所示:正常组视野里精子数量较多,且精子形态完整,头尾完整,没有或极少出现畸形精子。但是TP模型组中视野里的精子数量极少,且普遍为形态结构异常的,还出现了断头或者无尾等畸形精子。
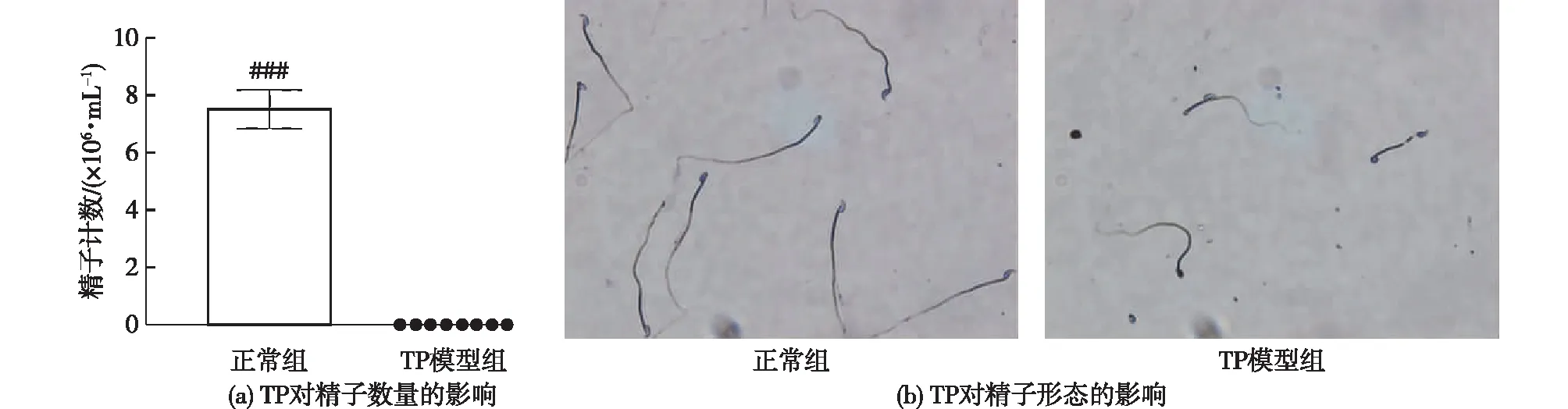
图3 TP对精子数量和精子形态的影响Fig.3 Effects of TP on sperm count and morphology
2.3 TP对睾丸和附睾组织形态学的影响
睾丸和附睾是雄性的主要生殖器官,睾丸具有精子发生和合成雄性激素的生理功能,并且影响精子的获能和受精过程[16]。附睾提供的微环境是精子成熟的必要条件,同时精子质量和运动能力也会受其影响[17]。故而,睾丸和附睾的结构和功能的正常,是雄性正常生育的必要条件。
通过HE染色观察TP对睾丸和附睾组织形态学的影响见图4,其中蓝色为细胞核。由图4(a)可知:正常组小鼠的睾丸组织结构清楚,细胞层次丰富,大部分生精小管内各级生精细胞排列规则,基底面至腔面可见精原细胞、初级精母细胞、精子细胞等各个发育阶段细胞,腔内可见成熟精子。TP模型组中小鼠睾丸组织结构混乱,细胞层次被破坏,生精上皮明显变薄,生精小管发生萎缩,腔内出现大面积空洞,未见各级生精细胞和成熟精子,睾丸支持细胞损伤严重。这表明TP导致了睾丸组织损伤和生精过程异常。由图4(b)可知:正常组中附睾管排列有序,附睾管内被大量精子填满管腔;而TP给药14 d后,模型组附睾结构萎缩,附睾管管腔缩小,管间间隙明显,异常脱落的精子聚集成团,部分附睾上皮细胞水肿,呈空泡状,附睾管内基本上看不到精子的存在。这表明TP对附睾储存精子和提供精子微环境的功能造成了严重破坏。以上结果均表明,TP对睾丸和附睾同时造成了生殖毒性。
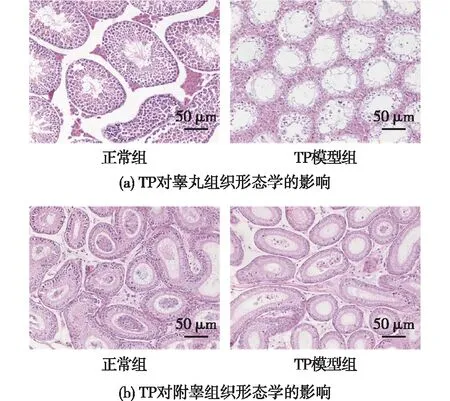
图4 TP对睾丸和附睾组织形态学的影响Fig.4 Effects of TP on morphology of testis and epididymis
2.4 TP对睾丸和附睾组织中氧化应激生化指标的影响
在之前的研究中已经证明了TP对生殖器官睾丸和附睾的毒性作用可能与激素水平和相关标志酶等有关[18],并且通路中以氧化应激反应与炎症为主要的研究方向,笔者则立足于氧化应激反应来探究TP产生生殖毒性可能的分子作用机制。
活性氧自由基(ROS)是一类具有很强氧化作用的化学活性物质,广泛参与机体的生理与病理过程[19],且已被证明多种因素如紫外线、药物、糖尿病等均会导致体内ROS水平的升高。睾丸和附睾是男性身体重要的生殖器官,其中富含多种能量代谢的酶和众多的线粒体数目,其维持正常的生殖系统功能都需要ROS的参与,但大量ROS的累积则容易导致线粒体的损伤和随之诱发的细胞凋亡。一般氧化应激标志物MDA、H2O2和GSH异常,即表明氧化应激水平异常。有害刺激引起的异常氧化应激反应还会破坏机体的细胞大分子,比如蛋白质、脂质和DNA等[20],导致细胞功能损害并进一步损伤细胞[21]。
睾丸组织中,与正常组相比,TP导致了TP模型组中H2O2和MDA含量的显著性升高(P<0.001),详情见图5。由图5可知:与正常组相比,TP模型组附睾组织中H2O2和MDA含量也同样显著性升高(P<0.05)。以上结果表明,TP模型组中睾丸和附睾的氧化应激水平是显著性升高的。与此同时,为了进一步检验组织中GSH含量,如图5(c)所示:睾丸组织TP模型组中GSH含量相较于正常组显著性降低(P<0.01),同时附睾组织中的结果,也表现出和睾丸一样的趋势。以上实验结果均表明,TP诱导的氧化应激反应可能是导致生殖功能障碍的重要原因。
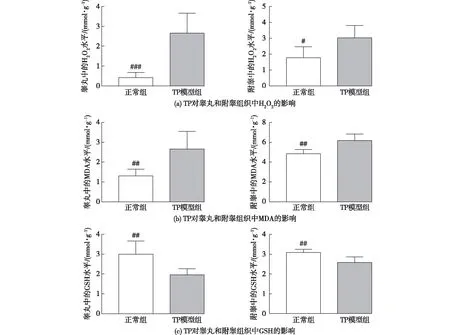
##为TP模型组与正常组相比较,P<0.01图5 TP对睾丸和附睾组织中氧化应激指标的影响Fig.5 Effects of TP on oxidative stress in testis and epididymis
2.5 TP对睾丸组织和附睾组织中PGC-1α的影响
PGC-1α在体内正常水平的表达,会促进体内产生许多与氧化应激反应有关的酶,从而保护机体不被过高的ROS所损伤,同时PGC-1α也是促进线粒体合成的关键转录因子,在维持线粒体动态平衡过程中发挥着至关重要的作用。有研究显示:上调PGC-1α的表达可以诱导线粒体NAD依赖性脱乙酰基酶SIRT3的转录,这是PGC-1α抑制ROS和线粒体生物发生作用所必需的[22]。PGC-1α是细胞应激反应的关键调节因子,它可以由缺乏营养,能量缺失和氧化等原因所诱导,并在调节线粒体动力学,清除ROS和调控脂质代谢等方面发挥着举足轻重的作用。PGC-1α相关通路在癌细胞中被激活,从而使它们获得对抗治疗的能力[23],通常通过抑制PGC-1α会导致组织的损伤。
通过免疫组化检测组织中PGC-1α的含量,结果见图6,蓝色为细胞核,棕色为PGC-1α蛋白染色。由图6(a)可知:TP模型组睾丸组织中的PGC-1α表达量相较于正常组呈显著性降低(P<0.001),在正常组精母细胞附近PGC-1α的表达是最高的,其他细胞附近也有相对较高的表达。但是在TP模型组中,细胞结构发生了破坏,且在组织细胞中PGC-1α表达呈显著性降低。该结果表明TP造成了PGC-1α的表达量下降,导致睾丸细胞暴露在过度氧化应激的反应条件下。由图6(b)可知:TP模型组附睾组织中PGC-1α的表达量相较于正常组呈显著性降低(P<0.001),这表明TP不仅会降低睾丸中PGC-1α的表达量,还会降低附睾中PGC-1α的表达。综上所述:TP的生殖毒性可能是通过抑制小鼠睾丸、附睾内的PGC-1α蛋白的表达,导致氧化还原失衡,从而导致睾丸细胞凋亡,附睾内的精子大面积丧失而造成的。
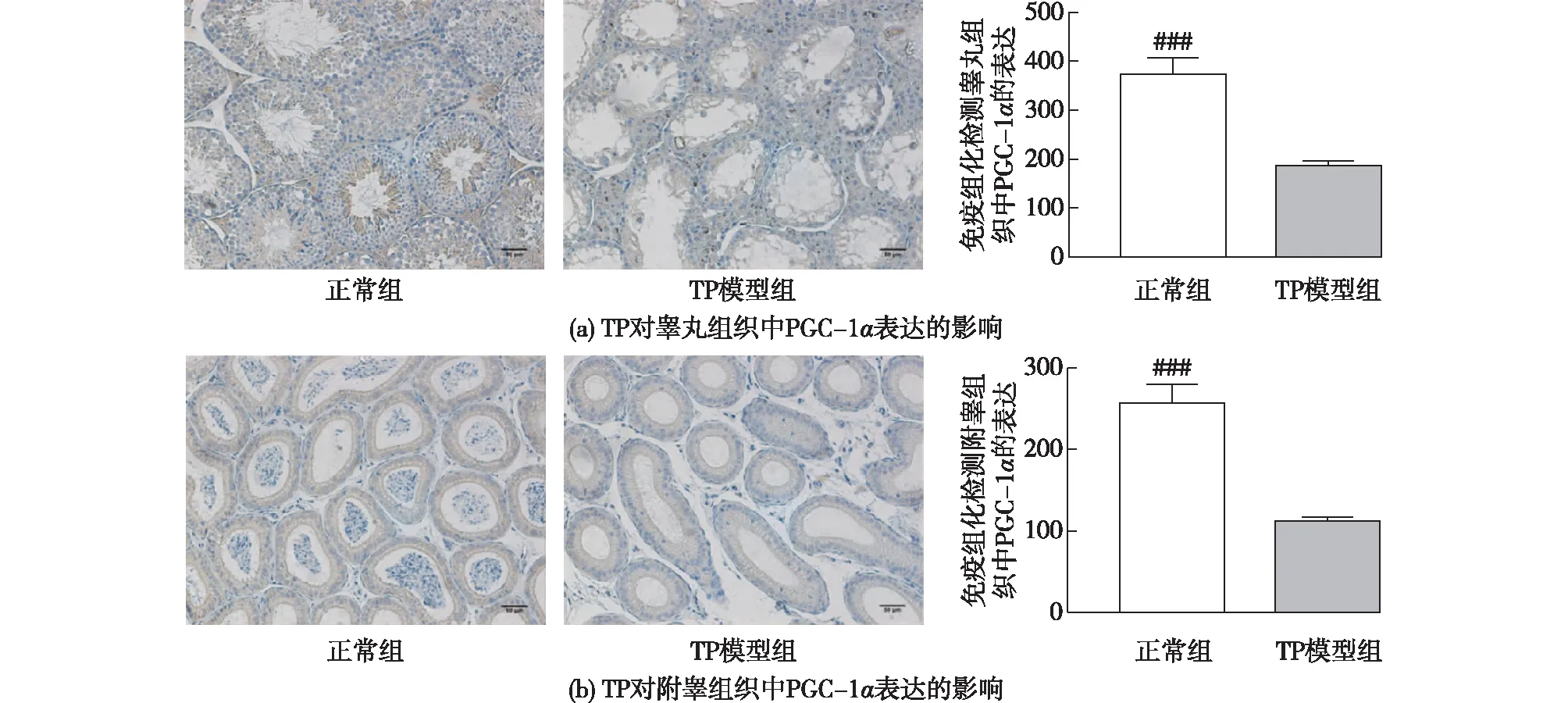
###为TP模型组与正常组相比较,P<0.001图6 TP对睾丸组织和附睾组织中PGC-1α蛋白表达的影响Fig.6 Effects of TP on PGC-1α protein expression in testis and epididymis
2.6 TP对睾丸组织和附睾组织中8-OHdG的影响
Hruszkewycz等[24]和徐婷等[25]的研究表明:8-OHdG 可作为 DNA 氧化应激的诊断标志,且TP产生的ROS是导致组织产生毒性的主要原因。长期的TP干预会导致肝脏细胞凋亡率增加,线粒体去极化,ROS大量产生,ATP的产生减少和线粒体片段化等[26]。而通过抑制氧化应激反应可以改善TP造成的肝、肾毒性[27-28]。
8-OHdG作为DNA氧化损伤的标志物,其在组织中的含量水平可以反映组织DNA 氧化损伤的程度,同时也可侧面反映出组织的氧化应激水平和ROS活性情况,结果见图7。由图7可知:通过免疫组化法来考察组织中8-OHdG含量,蓝色为细胞核,棕色为8-OHdG染色。由图7(a)可知:TP模型组中睾丸组织的8-OHdG的表达量相较于正常组呈显著性增加(P<0.001),在TP模型组中观察到残留的细胞中经8-OHdG染色的棕色较深。这说明在TP的毒性作用下,睾丸组织发生了严重的DNA氧化损伤。由图7(b)可知:在附睾中,TP模型组8-OHdG的表达量相较于正常组呈显著性升高(P<0.001),模型组中附睾细胞的棕色较深,而正常组基本上没有棕色。这说明在TP的毒性作用下,附睾组织细胞同样发生了严重的DNA氧化损伤。
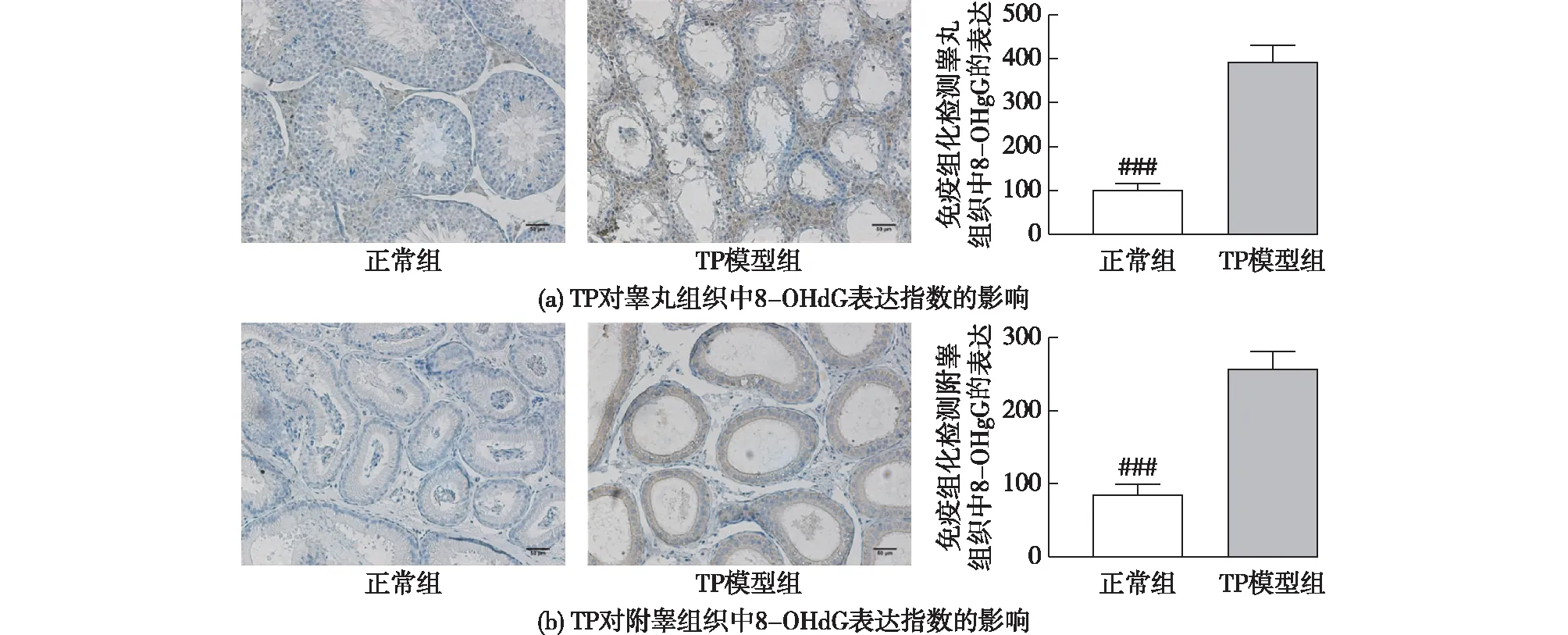
###为TP模型组与正常组相比较,P<0.001图7 TP对睾丸组织和附睾组织中8-OHdG蛋白表达的影响Fig.7 Effects of TP on 8-OHdG protein expression in testis and epididymis
本实验证明了TP造成的生殖毒性主要与氧化应激反应有关。细胞防御系统控制着一系列细胞保护性基因以抵消氧化应激反应。Nrf2是最著名的核转录家族成员之一,其主要的细胞保护作用是通过响应氧化反应和亲电子应激反应实现的[29]。有研究中也证明了可以通过Nrf2通路来控制氧化应激水平,从而改善睾丸损伤造成的生殖功能障碍[30-31]。以上研究均揭示了可以通过控制生殖器官的氧化应激水平来抵御TP所产生的生殖毒性。并且还有研究指出以脂质体或者纳米材料作为药物载体, 可明显减轻TP对生殖系统的毒性[32]。若两者结合运用,对于TP在临床上的应用将会是重大的进步。
3 结论
本研究发现TP在一定剂量下可以同时损伤睾丸和附睾,造成了不可逆的生殖毒性,即TP产生生殖毒性的靶器官可能是睾丸和附睾,而不是单一的某一个器官。
TP产生严重生殖毒性的可能作用机制是通过抑制PGC-1α的表达,从而导致了DNA的氧化损伤,影响了下游H2O2、MDA和GSH在机体中作用的发挥,从而诱导睾丸和附睾产生了严重的氧化应激反应,继而造成了睾丸和附睾的损伤。
系统研究了TP对睾丸,附睾及精子的毒性作用,首次从PGC-1α方向探究了TP产生生殖毒性的可能机制,为进一步阐明该化合物的雄性生殖毒性提供了理论依据,并为其今后的临床应用提供了需要改进的方向和数据支持。

