基于网络药理学和分子对接探讨芍药甘草汤治疗脑梗死后痉挛性偏瘫的作用机制
李宇霄,李润桥,付思慧,王嘉麟
脑卒中是指急性起病的以局灶性神经功能缺损为共同特点的脑血管疾病,分为脑出血和脑梗死,其高发率、高残疾率、高死亡率已成为全球性公共卫生问题。据统计,我国每年新发脑卒中病人约 200万人,并以每年8.7%的速度增长[1]。研究指出,约有75%的脑卒中病人存在不同程度的残疾,其中重度残疾约占40%[2]。在诸多脑卒中后遗症中,偏瘫病人数位居前列,其中,80%的病人为痉挛性偏瘫,痉挛性偏瘫一般出现在发病3周后,主要由于脑卒中后神经元受损,高级中枢对低级中枢的控制力减弱,导致肢体活动时阻力增加,协调性不佳,出现以痉挛为基础的异常运动模式[3]。临床主要表现为运动模式异常且粗大、腱反射亢进、肌张力增高等,并形成“偏瘫步态”,即患肩压低,上肢屈肌呈“挎篮子状”,患肢抬高、下肢伸肌式呈“划圈状”[4]。痉挛性偏瘫会引起患肢疼痛、关节挛缩甚至完全丧失肢体功能和自理能力,其治疗费用比没有脑卒中后痉挛状态病人高出近4倍[5]。
目前,治疗痉挛性偏瘫主要是缓解肌肉痉挛,方法有口服、鞘内注射、局部注射肌肉松弛剂、现代康复训练、外科手术等,存在疗程长、疗效差、费用昂贵、不良反应多等缺点。一项系统评价分析结果显示,采用芍药甘草汤治疗脑卒中后肢体痉挛,可以提高病人肢体运动功能,改善日常生活能力,显著提高临床有效率[6]。相关动物实验证明,芍药甘草汤可以缓解肢体痉挛、减轻神经损伤[7-8]。芍药甘草汤出自《伤寒论》,原文指出:“伤寒脉浮,自汗出,小便数,微恶寒,脚挛急……若厥愈、足温者,更作芍药甘草汤与之,其脚即伸。”方中白芍味苦、酸,养血敛阴、柔肝止痛;甘草味甘,补中益气、缓急止痛,二者等量合用,酸甘化阴,养血平肝,缓解筋脉拘急,善治气血亏虚型痉挛性疼痛,在《朱氏经验集》中有“去杖汤”的美称。本研究基于网络药理学技术、分子对接预测分析芍药甘草汤治疗脑梗死后痉挛性偏瘫的药效成分和相关靶点,探讨其作用机制,为后续研究提供科学依据。
1 资料与方法
1.1 药物有效化学成分筛选及靶点获取 采用中药系统药理学数据库(Traditional Chinese Medicine System Pharmacology Database,TCMSP,http://ibts.hkbu.edu.hk/LSP/tcmsp.php)检索芍药甘草汤药物名称(白芍、甘草)的有效化学成分,筛选条件为口服利用度(OB)≥30%、类药性(DL)≥0.18。采用DurgBank(https://www.drugbank.ca/)、Uniprot(https://www.UniProt.org/)数据库获取药物靶点。
1.2 疾病靶点和药物-疾病共有靶点的获取 采用基因名片数据库(GeneCards,https://www.genecards.org/)与OMIM-NCBI(https://www.ncbi.nlm.nih.gov/omim)数据库提取疾病靶点。应用R软件中的Draw Venn Diagrams工具对提取到的药物靶点与疾病靶点进行处理,获得共有靶点。
1.3 药物成分-靶点网络图的构建 应用 Cytoscape 3.7.1软件,将药物有效化学成分、药物-疾病共有靶点导入,构建药物成分-靶点网络图。
1.4 芍药甘草汤治疗缺血性脑卒中后痉挛性偏瘫的核心靶蛋白相互作用(protein protein interaction,PPI)网络构建 应用Bisogenet插件进行PPI蛋白网络构建,应用Cyto NCA插件进行网络拓扑分析,得出核心靶蛋白。
1.5 基因本体(GO)、京都基因和基因组百科全书(KEGG)通路富集分析 基于GO数据库(Gene Ontology,http://geneontology.org)对共有靶点进行生物学过程(BP)、分子功能(MF)、细胞成分(CC)分析,将结果按q值大小进行降序排列,绘制GO功能分析图;基于KEGG通路数据库(Kyoto Encyclopedia of Genes and Genomes,https://www.kegg.jp)对共有靶点发生作用的信号通路进行分析,将结果按P值大小进行降序排列,绘制KEGG通路富集分析图。
1.6 成分-靶点-通路互作图的构建 筛选与疾病相关性强的信号通路,应用 Cytoscape 3.7.1 软件构建成分-靶点-通路互作图。
1.7 分子对接 将1.4中筛选得到的核心靶蛋白利用RCSB PDB数据库(http://www.rcsb.org/)下载核心蛋白所对应的3D结构,利用有机小分子生物活性(PubChem)数据库中确定活性成分的化合物名称、分子量和2D结构。利用AutoDock Vina软件(http://vina.scripps.edu/)对核心蛋白和活性成分进行分子对接,affinity kcal/mol值越低,代表结合能力越低,配体与受体结合越稳定。并采用Pymol软件分析和观察对接结果。
2 结 果
2.1 药物化学成分及靶点 本研究共收集芍药甘草汤药有效化学成分36种,预测药物靶点572个,通过 UniProt数据库将所有蛋白名称转换成基因名称。芍药甘草汤中,白芍有效成分13种,预测靶点984个;甘草有效成分23种,预测靶点2 507个,各中药有效成分详见表1。

表1 中药有效成分
2.2 疾病靶点的获取和药物-疾病共有靶点的提取 在GeneCards与OMIM-NCBI 数据库中进行检索,GeneCards数据库设置条件为Relevance score≥25,将2个数据库中所得的疾病靶点汇总并删除重复,通过UniProt数据库将所有蛋白名称转换成基因名称,共获得72个靶点,将其作为处方的候选靶标来源。将获取的药物靶点与疾病靶点数据导入R软件,应用 Draw Venn Diagrams工具获得共有靶点41个,绘制韦恩图。详见图1。

图1 药物-疾病共有靶点韦恩图
2.3 构建成分-靶点网络图 将36种有效化学成分、41个共有靶点导入 Cytoscape 3.7.1中,采用Network Analyze插件构建药物成分-靶点作用网络,详见图2。核心靶蛋白为黄色方形,有效化学成分为椭圆形,不同颜色表示不同药物,甘草为蓝色,芍药为红色。根据度值得出排名前5位的关键活性成分有山萘酚(kaempferol)、β-谷甾醇(beta-sitosterol)、刺芒柄花素(formononetin)、刺果甘草查耳酮(glypallichalcone)、shinpterocarpin。由图可知,芍药甘草汤治疗脑梗死后痉挛性偏瘫是通过多成分、多靶点起效的。
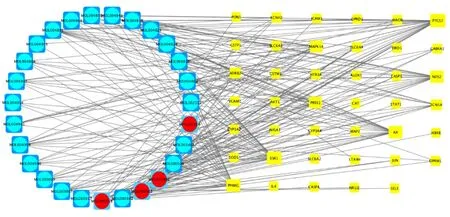
图2 药物成分-靶点网络图
2.4 共有靶点PPI网络构建与分析 将共有靶点导入Cytoscape 3.7.1的Bisogenet 插件中,初步构建共有靶点PPI网络,详见图3;应用CytoNCA 插件对PPI网络进行进一步拓扑分析,筛选核心靶点,排名前5位的核心靶点分别是前列腺素内过氧化物合酶2(PTGS2)、AKT丝氨酸/苏氨酸激酶1(AKT1)、半胱氨酸蛋白酶3(CASP3)、过氧化氢酶(CAT)、超氧化物歧化酶1(SOD1)。
2.5 GO功能分析和KEGG通路富集分析 在GO数据库和 KEGG 通路数据库中,设置条件为P值cutoff=0.05且q值cutoff=0.05,余采用原始设置。选取排名前30位的项目绘制图形,详见图4、图 5,横坐标表示靶点个数,纵坐标表示生物学过程,颜色表示q值,颜色越偏红色代表q值越小,颜色越偏蓝代表q值越大。GO功能分析发现共有靶点主要参与了对营养水平的作用、对脂多糖的作用、突触膜的固有成分等过程。KEGG通路富集分析提示主要参与肿瘤坏死因子信号通路、晚期糖基化终末产物受体(AGE)-晚期糖基化产物(RAGE)信号通路、C型凝集素受体信号通路、Toll样受体信号通路,白细胞介素-17信号通路。应用 Cytoscape 3.7.1做可视化处理,构建成分-靶点-通路互作图,详见图 6。

图4 GO功能分析
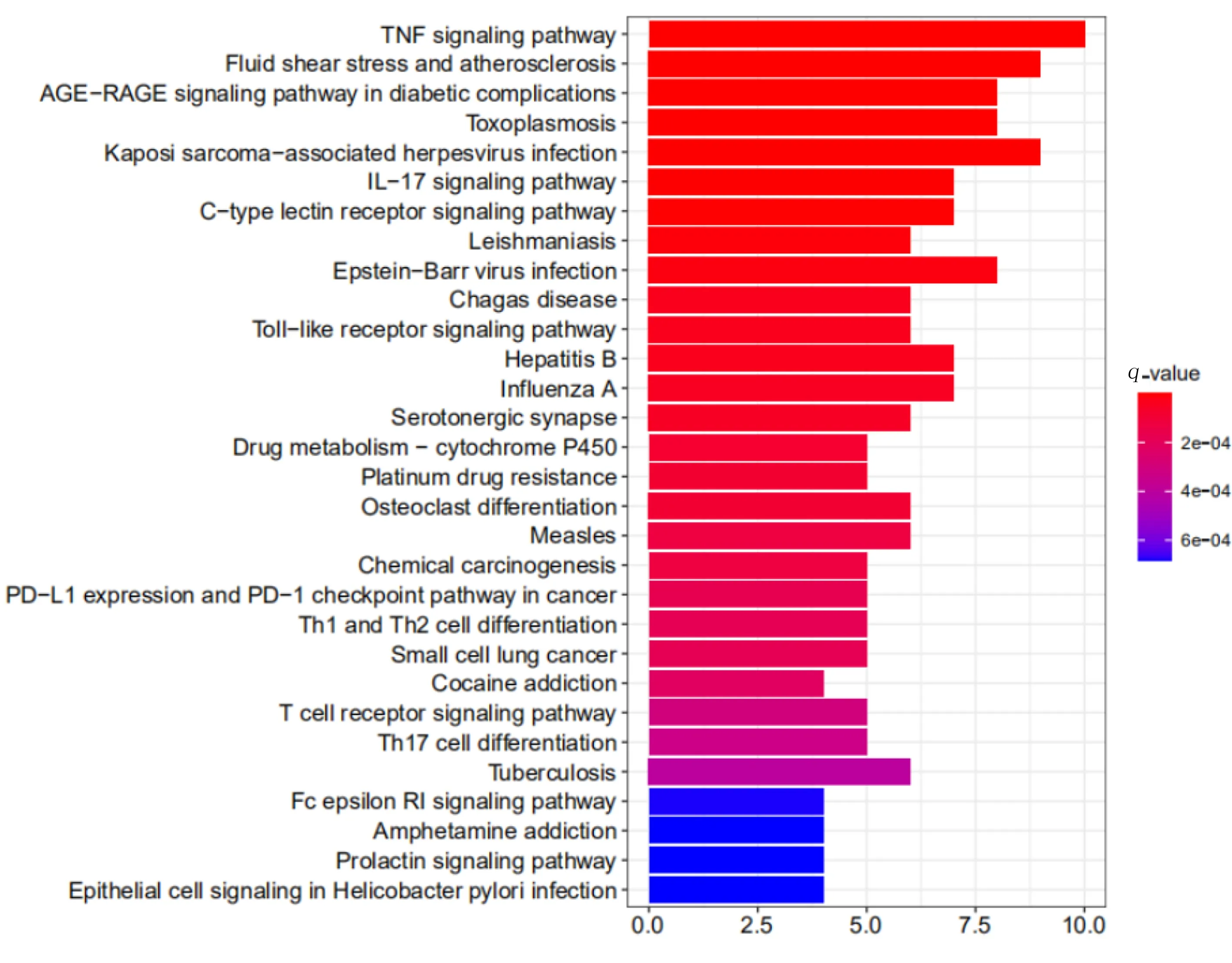
图5 KEGG通路富集分析

图6 成分-靶点-通路图
2.6 分子对接结果 以2.4得到的5个核心蛋白为配体,以芍药甘草汤的36种活性成分为受体,利用AutoDock Vina软件进行分子对接,得到的affinity(kcal/mol)值越低,代表结合能力越低,配体与受体结合越稳定。并采用Pymol软件进行可视化处理。详见图7、图8。

图7 分子对接能量热图

图8 核心蛋白和活性成分分子对接图
3 讨 论
中医学中,痉挛性偏瘫属于“拘挛”“痉证”等范畴,《景岳全书·论治血气》云:“偏枯拘急痿弱之类,本由阴虚气中无血,则病为抽掣”,认为拘挛是由于阴虚气血亏虚,无以濡养经脉,表现为肢体挛急。《医贯·中风要旨》云:“其手足牵掣,口眼歪斜,乃水不荣筋,筋急而纵也”,认为阴虚津液亏损,无以濡养经脉而出现痉挛、拘急。由此可见,脑卒中后痉挛性偏瘫其病位在筋,病因为脑卒中后风火痰瘀阻滞肢体筋脉,气血无以濡养筋脉,从而肢体拘急挛缩,治宜养血舒筋、缓急止痛。芍药甘草汤中白芍味苦、酸,养血柔肝、敛阴止汗止痛;甘草味甘,补中益气、缓急止痛,合用则酸甘化阴,养血舒筋,缓解筋脉拘挛,因此,本研究基于网络药理学和分子对接方法对芍药甘草汤治疗脑梗死后痉挛性偏瘫的作用机制进行了探讨。首先利用TCMSP、DrugBank、GeneCards、OMIM-NCBI数据库获取了芍药甘草汤的药物活性成分、药物靶点、疾病靶点及药物-疾病共有靶点,利用 Cytoscape 3.7.1软件构建了芍药甘草汤的成分-靶点网络。构建PPI视图并进一步进行网络拓扑分析得出排名前5位的核心靶点分别是:PTGS2、AKT1、CASP3、CAT、SOD1。PTGS2即环氧合酶2(COX2),又称前列腺素内过氧化物合酶2,是合成前列腺素(PGS)的限速酶,越来越多的证据支持氧化应激和神经炎症在脑缺血损伤进展中起着关键作用的观点,PGS是脑内主要的炎症介质,参与脑缺血损伤的病理生理过程[9-10]。PGS的生成由COX介导,其病理生理过程为:当脑出血发生后,释放大量花生四烯酸(AA),经COX催化、细胞特异性合成酶代谢,生成5种PGS,这5种PGS与指定的G蛋白耦联受体结合,引发对环磷酸腺苷(CAMP)循环、磷酸肌醇转化和钙动员的特异性反应[11]。COX有两种形式:COX1和COX2,其中COX2为诱导性酶,在正常条件下,可以促进基本脑功能的运行,如神经元突触活动、记忆巩固、功能性充血[12]。研究表明,使用COX抑制剂可以减轻脑缺血后的神经元损伤[9-10]。SOD1、CAT均为抗氧化应激相关因子,正常情况下,脑组织代谢产生的氧自由基、过氧化氢等活性氧的生成与清除属于平衡状态,当脑组织缺血缺氧后,平衡状态被打破,脑组织内活性氧增多,超过生理限度,引起神经元损伤,其含量与活性与脑组织的结构和功能密切相关[13]。CASP3是一种常被激活的死亡蛋白酶,催化多种细胞关键蛋白的特异性断裂,是细胞凋亡过程最关键的凋亡执行蛋白酶[14]。动物实验证明,通过抑制CASP3蛋白的表达可以抑制脑缺血大鼠的脑细胞凋亡[15]。AKT包含3种亚型,分别为AKT1、AKT2和AKT3。其中AKT1能调节代谢、促进血管生成,与细胞增殖、细胞存活、生长密切相关[16]。AKT1基因与外周血管疾病、动脉粥样硬化、闭塞性冠状动脉疾病、斑块易损性和心功能不全等密切相关[17-19]。而动脉粥样硬化是脑卒中的主要诱发因素。通过构建活性成分-靶点网络图,得到关键活性成分有kaempferol(山萘酚)、beta-sitosterol(β-谷甾醇)formononetin(刺芒柄花素)、glypallichalcone(刺果甘草查耳酮)、shinpterocarpin等。现代药理学研究发现,山萘酚和刺芒柄花素均有抗炎、抗氧化应激、清除自由基、抑制肿瘤生长等作用[20-22]。研究表明,芒柄花黄素对小鼠脑缺血再灌注损伤有保护作用,可能是通过降低相关炎性因子的表达、抑制炎症反应来实现[23]。研究发现,山萘酚具有抗血小板聚集和抗血小板过度活化的作用[24]。β-谷甾醇有抗氧化、抗炎、抗动脉粥样硬化、抗癌、降低胆固醇水平和雌激素样作用[25]。β-谷甾醇可增加抗氧化应激相关因子的活性,降低过氧化氢酶活性,从而发挥清除自由基作用;β-谷甾醇有血管生成作用,有助于缺血再灌注损伤小鼠的运动功能的恢复[26-27]。
GO功能富集分析发现共有靶点主要参与了对营养水平的作用、对脂多糖的作用、突触膜的固有成分等过程。KEGG 通路富集分析发现芍药甘草汤治疗脑梗死后痉挛性偏瘫的信号通路主要涉及肿瘤坏死因子信号通路、Toll样受体信号通路、AGE-RAGE信号通路、C型凝集素受体信号通路、白细胞介素-17信号通路等。脑梗死或再灌注后,使炎性因子肿瘤坏死因子-α(TNF-α)等大量释放,致抗氧化应激相关因子过度消耗,生成细胞毒性物质,而炎性因子TNF-α反过来会刺激和产生炎性因子,引发炎症联级反应[28-29]。研究发现,一些药物可能是通过抑制脑缺血再灌注大鼠氧化应激、炎症反应,下调基质金属蛋白酶-2(MMP-2)、MMP-9和核转录因子-κB(NF-κB)蛋白表达,从而发挥神经保护作用实现的[30]。脑血管意外发生后,分布在神经元、胶质细胞、星形胶质细胞、内皮细胞的Toll样受体家族(TLRs)被激活表达,刺激产生大量炎性因子,从而加重脑组织损伤。研究发现,对糖尿病合并脑缺血损伤大鼠使用某药物后,通过抑制toll样受体4(TLR4)/髓样分化因子88(Myd88)信号通路介导的炎症反应可以减轻脑组织损伤[31]。在发生脑缺血之前,对大鼠进行TLRs预处理,会抑制TNF-α以及其他由NF-κB 诱导产生的促炎性因子,并通过非依赖性MyD88 信号通路,促进干扰素调节因子3(IRF3)诱导产生干扰素调节因子β,可以减轻脑缺血损伤后的炎症联级反应、缺血再灌注损伤、脑水肿、减少脑梗死面积,最终产生脑缺血耐受,保护脑组织作用[32]。
综上所述,本研究基于网络药理学,筛选分析芍药甘草汤和脑梗死后痉挛性偏瘫的相关靶点,构建成分-靶点-通路互作网络图,进行了有效成分和核心蛋白的分子对接,结果显示,活性成分和核心蛋白对接良好。芍药甘草汤治疗脑梗死后痉挛性偏瘫的可能机制是通过调控PTGS2、AKT1、CASP3、CAT、SOD1等核心蛋白发挥抗氧化应激、清除自由基、减少炎症反应的产生实现的,体现了芍药甘草汤多成分、多靶点、多通路协同治疗疾病的特点,为临床治疗脑梗死后痉挛性偏瘫及进一步研究相关机制提供理论依据。

