人参皂苷Rg1对冠心病大鼠心肌细胞凋亡的影响及机制研究
郭施勉,楚英杰
冠心病是指由冠状动脉血管发生粥样硬化引起的血管狭窄、阻塞,从而造成心肌缺血、缺氧甚至坏死的心脏疾病,是临床上常见的心血管疾病[1]。冠心病主要高发于中老年或合并心血管基础疾病的病人,随着社会人口老龄化的加快以及生活习惯的改变,冠心病发病率逐年增加,由冠心病导致的猝死也时有发生,严重威胁人们的生命健康和安全[2]。人参皂苷Rg1是从人参中提取的一种中药活性物质,研究表明,人参皂苷Rg1在中枢神经系统、免疫系统及抗肿瘤方面均发挥着重要的调节作用[3]。近代药理研究证明,人参皂苷对缺血性心脏病、心律失常、心力衰竭以及心肌缺血再灌注损伤等多种心血管系统疾病具有深远的临床意义,但关于人参皂苷Rg1在心血管系统中的作用仍鲜有报道[4]。研究发现,人参皂苷Rg1对神经细胞内质网的应激反应具有一定的抑制作用,可抑制神经细胞凋亡[5]。本研究拟通过构建大鼠冠心病模型,在体内外实验中观察人参皂苷Rg1对心肌细胞凋亡的作用,为人参皂苷Rg1在冠心病中的作用研究提供理论依据。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级健康雄性SD大鼠50只,体质量(200±20)g,动物房中适应性饲养1周,室温(22±5)℃,相对湿度(50±5)%,通风良好,环境安静,自由饮水、摄食。实验动物购于广东省医学实验动物中心。所有动物实验均经伦理委员会批准。
1.2 实验试剂 人参总皂苷 Rg1(浙江康恩贝制药股份有限公司);酶联免疫吸附试验(ELISA)试剂盒(美国PeproTech公司);超氧化物歧化酶(SOD)、丙二醛(MDA)测定试剂盒均购自南京建成生物工程研究所;Trizol裂解液、BCA蛋白定量试剂盒均购自美国Invitrogen公司;实时荧光定量逆转录试剂盒、实时荧光定量聚合酶链式反应(PCR)试剂盒均购自日本TaKaRa公司;兔抗鼠β-actin单克隆抗体、兔抗鼠Bcl-2单克隆抗体、兔抗鼠Bax单克隆抗体、兔抗鼠Caspase-3单克隆抗体均购自美国Abcam公司;Tunel试剂盒(美国Roche公司);磷酸缓冲盐溶液(PBS)、蛋白上样缓冲液均购自中国上海碧云天生物工程研究所;多聚甲醛、无水乙醇均产自天津化学试剂厂。
1.3 实验方法
1.3.1 动物分组与模型构建 本研究采用高脂饮食饲养联合腹腔注射垂体后叶素构建大鼠冠心病模型,每日高脂饮食连续饲养6周后,间隔24 h腹腔注射垂体后叶素30 μg/kg,连续3次[6]。实验大鼠随机分为对照组、模型组、人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组,每组10只。对照组常规饮食,不进行冠心病造模,给予人参皂苷Rg1等体积生理盐水灌胃,每日1次;模型组构建冠心病模型,给予人参皂苷Rg1等体积生理盐水灌胃,每日1次;人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组、人参皂苷Rg1高剂量组均构建冠心病模型,术后分别给予50 mg/kg、75 mg/kg、100 mg/kg人参皂苷Rg1灌胃,每日1次。所有实验动物均连续灌胃12周。
1.3.2 心肌组织缺血区细胞形态观察 断头法处理实验大鼠,各组大鼠取适量心肌均匀切成5片,每片厚度约为2.0 mm,置于包埋盒内,浸于4%多聚甲醛中固定过夜。常规乙醇梯度脱水,随后取出,置于包埋机中2 h进行石蜡包埋。随后将切片置于二甲苯及梯度乙醇中依次浸泡脱蜡,采用苏木素染色40 s,1%盐酸乙醇冲洗后,置于伊红溶液中染色3 s后自来水冲洗。冲洗后将切片置于梯度乙醇及二甲苯溶液中进行脱水和透明处理。使用中性树脂覆盖玻片进行封固。于光学显微镜下观察并采集图片,应用Image Pro Plus 6.0图像分析软件处理并作统计。
1.3.3 心肌组织中炎性因子含量检测 每只大鼠取心肌组织约50 mg,制成10%的匀浆液,3 000 r/min,4 ℃下离心10 min,收集上清液,采用ELISA试剂盒检测上清液中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)含量。使用酶标仪(美国Molecular Devices)在450 nm下测定OD值。所有实验重复3次。
1.3.4 SOD、MDA含量检测 每只大鼠取心肌组织约50 mg,于预冷生理盐水中漂洗后,除去血液,采用手术剪将心肌组织块剪碎,转移至匀浆管中,制成10%的组织浆液。3 000 r/min离心10 min,使组织匀浆化,取上清液,严格按照各个试剂盒说明书操作,检测心肌组织SOD活性及MDA含量。所有实验重复3次。
1.3.5 凋亡相关蛋白 mRNA表达情况检测 逆转录聚合酶链式反应(RT-PCR)检测心肌组织中凋亡相关蛋白 mRNA表达情况。采用Trizol法提取各组大鼠心肌组织细胞总RNA。采用紫外分光光度仪测定总RNA浓度与纯度,A260/280在1.8~2.0。参照mRNA反转录试剂盒操作说明进行反转录和RT-PCR检测,反应程序:95 ℃ 2 min,95 ℃ 15 s,60 ℃ 30 s,68 ℃ 60 s,40个循环,最后95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s收集荧光信号,计算相对定量结果,所有实验重复3次。Bax、Bcl-2、Caspase-3引物及内参甘油醛-3-磷酸脱氢酶(GAPDH)引物均由上海捷瑞生物工程有限公司设计合成。
1.3.6 凋亡相关蛋白表达情况检测 蛋白免疫印迹法(Western Blot)检测心肌组织中凋亡相关蛋白表达情况。每只大鼠取心肌组织约50 mg,加入组织蛋白提取液,4 ℃充分碾磨10 000 r/min离心10 min,取上清液。采用BCA 蛋白定量试剂盒对提取的蛋白进行定量,各组以30~60 μg 相同的蛋白上样量,煮沸变性后进行凝胶电泳,随后使用半干转仪转移至聚偏二氟乙烯膜(PVDF),5%脱脂牛奶封闭 1 h,抗Bax单克隆抗体(1∶1 000)、抗Bcl-2单克隆抗体(1∶1 000)、抗Caspase-3单克隆抗体(1∶800)4 ℃孵育过夜。PBS-Tween 20液漂洗,HRP标记的二抗反应,PBS-Tween 20液洗膜,化学发光法(ECL)显色,凝胶成像仪曝光拍照。检测各组实验大鼠心肌组织中Bax、Bcl-2及Caspase-3等凋亡标志蛋白表达情况。所有实验重复3次,灰度值采用Image Pro Plus 6.0软件检测分析。

2 结 果
2.1 5组心肌组织细胞形态比较 光学显微镜下观察,对照组大鼠心肌组织细胞形态正常,排列整齐,细胞核膜完整,核仁清晰可见,无明显核固缩表现;模型组大鼠心肌组织细胞体积明显缩小,核固缩明显,呈深染色表现,细胞水肿明显,细胞间隙有明显的细胞浸润表现,可见明显的坏死细胞;人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组大鼠心肌组织细胞水肿状态均较模型组有所改善,细胞水肿状态呈现不同程度减轻,其中,人参皂苷Rg1高剂量组细胞肿胀程度缓解最为明显,其细胞核深染明显减轻,细胞皱缩明显缓解,细胞形态基本趋于正常。详见图1。
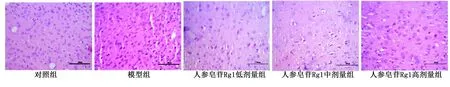
图1 5组心肌组织细胞形态比较
2.2 5组心肌组织炎性因子含量比较 与对照组比较,模型组、人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组IL-1β、IL-6、TNF-α水平均明显升高,差异均有统计学意义(P<0.05);与模型组比较,人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组IL-1β、IL-6、TNF-α水平明显降低,差异均有统计学意义(P<0.05);与人参皂苷Rg1中剂量组比较,人参皂苷Rg1高剂量组IL-1β、IL-6、TNF-α水平明显降低,差异均有统计学意义(P<0.05);与人参皂苷Rg1低剂量组比较,人参皂苷Rg1高剂量组IL-1β、IL-6、TNF-α水平明显降低,差异均有统计学意义(P<0.05)。详见表1。

表1 各组大鼠心肌组织炎性因子含量比较 () 单位:ng/L
2.3 5组SOD活性及MDA含量比较 与对照组比较,模型组、人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组SOD活性明显降低,MDA含量明显升高,差异均有统计学意义(P<0.05);与模型组比较,人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组SOD活性明显升高,MDA含量明显降低,差异均有统计学意义(P<0.05);与人参皂苷Rg1中剂量组比较,人参皂苷Rg1高剂量组SOD活性明显升高,MDA含量明显降低,差异均有统计学意义(P<0.05);与人参皂苷Rg1低剂量组比较,人参皂苷Rg1高剂量组SOD活性明显升高,MDA含量明显降低,差异均有统计学意义(P<0.05)。详见表2。

表2 5组SOD活性及MDA含量比较 ()
2.4 5组凋亡相关蛋白mRNA表达比较 与对照组比较,模型组、人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组、人参皂苷Rg1高剂量组Bax及Caspase-3 mRNA表达水平明显升高,Bcl-2 mRNA表达水平明显降低,差异均有统计学意义(P<0.05);与模型组比较,人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组Bax及Caspase-3 mRNA表达水平明显降低,Bcl-2 mRNA表达水平明显升高,差异均有统计学意义(P<0.05);与人参皂苷Rg1中剂量组比较,人参皂苷Rg1高剂量组Bax及Caspase-3 mRNA表达水平明显降低,Bcl-2 mRNA表达水平明显升高,差异均有统计学意义(P<0.05);与人参皂苷Rg1低剂量组比较,人参皂苷Rg1高剂量组Bax及Caspase-3 mRNA表达水平明显降低,Bcl-2 mRNA表达水平明显升高,差异均有统计学意义(P<0.05)。详见图2。
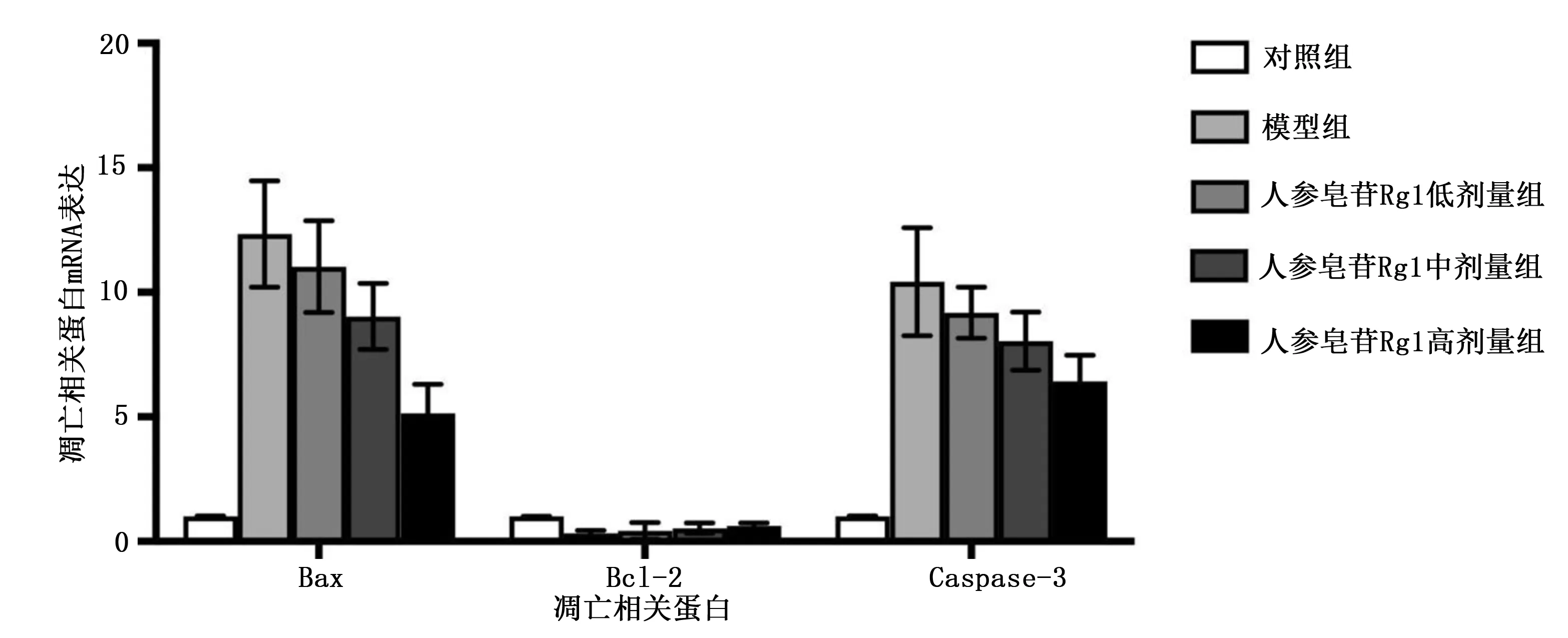
图2 5组凋亡相关蛋白mRNA表达比较
2.5 5组凋亡相关蛋白表达比较 与对照组比较,模型组、人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组、人参皂苷Rg1高剂量组Bax及Caspase-3蛋白表达水平明显升高,Bcl-2蛋白表达水平明显降低,差异均有统计学意义(P<0.05);与模型组比较,人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组Bax及Caspase-3蛋白表达水平明显降低,Bcl-2蛋白表达水平明显升高,差异均有统计学意义(P<0.05);与人参皂苷Rg1中剂量组比较,人参皂苷Rg1高剂量组Bax及Caspase-3蛋白表达水平明显降低,Bcl-2蛋白表达水平明显升高,差异均有统计学意义(P<0.05);与人参皂苷Rg1低剂量组比较,人参皂苷Rg1高剂量组Bax及Caspase-3蛋白表达水平明显降低,Bcl-2蛋白表达水平明显升高,差异均有统计学意义(P<0.05)。详见图3。
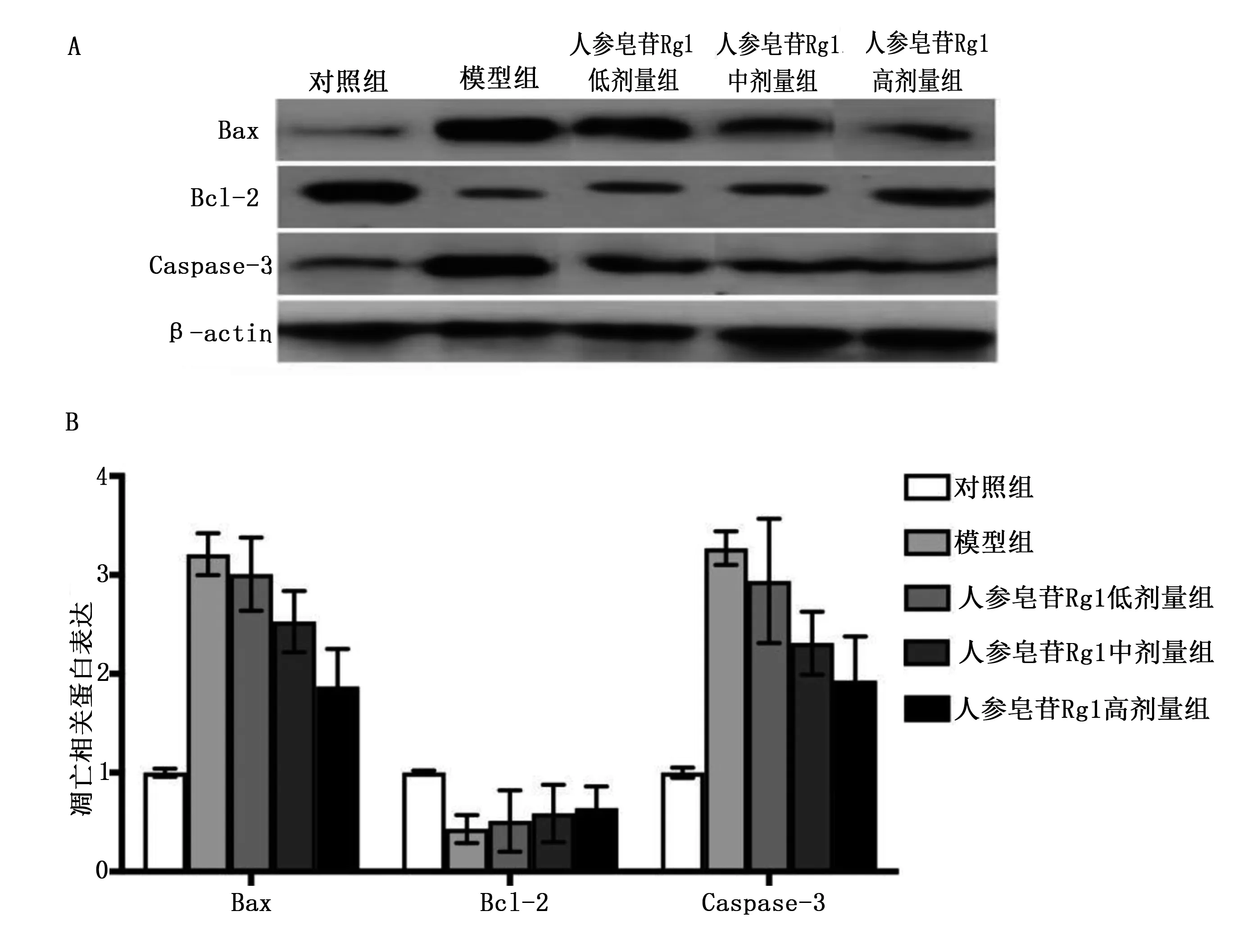
图3 5组凋亡相关蛋白表达比较
3 讨 论
冠心病是一类常见的严重危害人类健康的心血管系统疾病,其发生与动脉粥样硬化、血管再狭窄、心肌缺血再灌注损伤等密切相关[7]。研究显示,心肌细胞凋亡在动脉粥样硬化、心肌缺血、再灌注损伤以及急性心肌梗死等心血管系统疾病的发生发展中扮演着重要角色[8]。细胞凋亡又称为程序性细胞死亡,是细胞自我有效消亡的过程,在形态特征上有别于细胞坏死,但同属于细胞死亡[9]。随着对冠心病发病机制研究的不断深入,心肌细胞凋亡与冠心病的关系逐渐成为临床研究的热点话题。
人参皂苷是人参的主要活性成分,对神经系统、心脑血管系统、消化系统、免疫系统等具有不同程度的保护作用,尤其在心血管系统疾病的防治中具有重要意义[10]。人参皂苷Rg1属于人参三醇型皂苷,有研究显示,人参皂苷Rg1对缺血心肌具有保护作用,不仅可通过与糖皮质激素受体结合,促进血管内皮细胞产生一氧化氮(NO),扩张冠状动脉,增加冠状动脉血流量,保护心肌功能,还可通过降低缺血缺氧心肌细胞内钙离子浓度,调节心肌细胞内钙离子平衡紊乱,保护心肌细胞[11-12]。近年来研究发现,人参皂苷Rg1在血管新生方面也具有积极作用,可通过促进内皮细胞增殖、迁移,参与血管重构与新生,从而发挥心肌保护作用[13-14]。此外,人参皂苷Rg1在一定程度上可增加冠心病病灶区的血管密度,提高血管内皮生长因子表达,在急性心肌梗死中发挥保护作用[15]。人参皂苷Rg1已作为复方制剂的成分之一投入到临床使用中,目前临床上广泛应用的血栓通注射液的主要成分即为人参皂苷Rg1,但目前人参皂苷Rg1心肌保护作用的研究多在细胞水平,人参皂苷Rg1通过何种途径影响冠心病的发展和预后仍不清楚。本研究以人参皂苷Rg1对冠心病心肌细胞凋亡的分子机制为切入点,以大鼠冠心病模型为研究对象,探讨人参皂苷Rg1影响心肌细胞凋亡的可能机制。
本研究结果显示,给予人参皂苷Rg1不同剂量干预后,人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组大鼠心肌细胞水肿状态均较模型组改善,细胞水肿状态呈现不同程度减轻,提示人参皂苷Rg1对于缓解心肌细胞水肿有一定作用,且人参皂苷Rg1高剂量组细胞肿胀程度缓解最为明显。IL-1β是炎症反应的重要介质,可通过刺激黏附分子异常高表达,介导粒细胞在血管内皮细胞间的黏附和浸润,还可通过刺激血管内皮细胞,诱导相关血管活性物质的合成与分泌,促进微血栓的形成[16]。IL-6在缺血再灌注损伤发病早期即可通过异常高表达刺激炎性细胞介质释放发挥促炎作用[17]。TNF-α作为一种常见的炎性因子,在众多炎症中均有着明显的异常表达,主要在炎症发生的初始阶段发挥前炎性因子作用[18]。本研究结果显示,模型组大鼠心肌组织中IL-1β、IL-6、TNF-α水平明显高于人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组(P<0.05),且人参皂苷Rg1高剂量组大鼠心肌组织中IL-1β、IL-6、TNF-α水平明显低于人参皂苷Rg1低、中高剂量组(P<0.05),提示人参皂苷Rg1能有效抑制冠心病发生过程中的炎症反应,且其对心肌细胞损伤的抗炎效应与剂量密切相关。SOD广泛存在于人体,是心肌组织中清除自由基的有效成分,MDA是脂质过氧化的最终产物,可通过干预氧自由基的生成量间接反映细胞损伤的程度[19-20]。本实验结果显示,模型组SOD活性明显低于人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组(P<0.05),而MDA含量明显高于人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组(P<0.05),表明人参皂苷Rg1能增强冠心病大鼠心肌组织中SOD活性,同时降低MDA水平,从而减轻氧自由基的破坏作用,保护心肌细胞,与其抗炎作用一致。与模型组比较,人参皂苷Rg1低剂量组、人参皂苷Rg1中剂量组及人参皂苷Rg1高剂量组大鼠心肌组织中凋亡相关蛋白Bax、Caspase-3 mRNA及蛋白表达量明显降低(P<0.05),Bcl-2 mRNA及蛋白表达量则明显升高(P<0.05),提示人参皂苷Rg1对冠心病心肌组织细胞凋亡具有一定的抑制作用。本研究实验结果表明,人参皂苷Rg1在降低炎症水平及氧自由基作用的同时,还可抑制心肌细胞凋亡,其抑制凋亡效应可能与线粒体凋亡信号通路的失活有关。
综上所述,人参皂苷Rg1可通过降低损伤后炎症反应、抗氧化、抑制线粒体凋亡信号通路作用,发挥对冠心病大鼠心肌细胞的保护作用,其作用效果与干预剂量明显相关。

