RNAi转基因大豆品系‘B5C9123-5’的RPA可视化检测技术
张 晨 雷 展 李 凯 李飞武 商 颖* 许文涛*
(1.昆明理工大学 农业与食品学院,昆明 650504;2.中国农业大学 食品科学与营养工程学院/北京食品营养与人类健康高精尖创新中心,北京 100083;3.农业农村部农业转基因生物安全评价(食用)重点实验室,北京 100083;4.吉林省农业科学院 农业质量标准与检测技术研究所,长春 130033)
在真核生物中,RNA干扰(RNA interference, RNAi)是通过双链RNA触发内源性RNA诱导沉默复合物(RNA-induced silencing complex, RISC)抑制特定基因表达的一种生物机制。在精确抑制相关基因表达时,RNAi不会影响其他基因表达的特点使其成为一种很有前途的基因调控方法。在植物中,RNAi通过靶向关键基因为培育抗病、抗虫的高产优良品种开辟了新的途径。然而,新兴技术的应用和发展往往会伴随着很多争议和关注。因此,为规范RNAi作物的田间监管,亟待开发新型RNAi作物的快速检测方法。
由于分子特征的相似性,RNAi作物被纳入转基因作物管理体系中进行监管。现阶段,针对转基因作物的检测手段主要分为两大类,一类是蛋白质分析,另一类是特异性DNA检测方法。通过检测外源蛋白在不同作物或同一作物的不同组织中的表达,蛋白质分析可用于检测多个特征,但蛋白质分析不具备特异性检测转基因品系的能力。外源插入片段的侧翼序列是位于基因构建体和5′(或3′)侧翼基因组DNA序列交界处的独特序列。根据侧翼序列建立的特异性DNA检测方法,是对转基因植物及其产品进行有效监督管理的一个重要依据。由于较高的灵敏度和特异性,聚合酶链式反应(Polymerase Chain Reaction, PCR)已经成为检测转基因作物的标准。然而,常规PCR需要繁琐的样品前处理,拥有专业设备的特定实验室以及训练有素的操作人员,这些要求极大地限制了PCR在快速、现场检测方面的应用。近年来,恒温扩增技术的发展为转基因作物的快速检测提供了新的契机,例如环介导等温扩增(Loop-mediated isothermal amplification, LAMP)、重组酶聚合酶扩增(Recombinase polymerase amplification, RPA)和滚环扩增(Rolling circle amplification, RCA)等等。通过模拟体内DNA重组,在37~42 ℃恒温条件下,应用RPA可在30 min内快速扩增DNA。RPA的恒温、快速和高特异扩增靶标的特点使其特别适合开发快速、现场检测技术。在RPA的基础上,已经建立了许多新的快速核酸扩增检测方法,例如RPA促进四甲基联苯胺显色用于快速筛选结核分枝杆菌,RPA与横向流动试纸条偶联用于快速鉴定羊肉掺假以及RPA与电活性物质结合用于快速检测血清或血液中痕量DNA序列等。此外,RPA检测可在现场使用便携式检测仪器实现靶标检测,包括现场检测和鉴定HIV-1种/亚种以及用于级联扩增的无标记视觉生物传感器检测沙门氏菌等。
RNAi转基因样本是吉林省农业科学院采用农杆菌介导法将外源SMV
-NIb
基因RNAi片段导入栽培大豆品种‘沈农9号’,获得的抗病转基因大豆新品种‘B5C9123-5’。目前,基于RPA进行RNAi转基因作物现场检测的相关研究还鲜有报道。本研究在RNAi转基因作物的测序基础上,通过RPA特异性引物和可视化荧光染料SYBR Green Ⅰ,旨在开发RNAi转基因作物的田间可视化鉴定,以期为RNAi转基因植物的商业化应用提供参考。1 材料与方法
1.1 材料
广谱抗花叶病毒转基因大豆品种‘B5C9123-5’由吉林省农业科学院提供。转基因玉米品种混合物(‘GA21’,‘MON89034’,‘MON88017’,‘MIR604’,‘MON87460’,‘MON87427’),转基因棉花品种混合物(‘MON1445’,‘MON531’,‘MON15985’),转基因水稻品种混合物(‘华占水稻’,‘隆两优8387’,‘TT51-1’,‘科丰 6’),由本实验室保存的。
1.2 方法
1
.2
.1
基因组DNA提取应用北京天根公司的植物基因组DNA提取试剂盒(自旋柱型)提取供试材料的DNA。采用琼脂糖凝胶电泳和紫外分光光度计(美国Thermo Fisher Scientific公司的 Nanodrop 2 000)的方法,测定DNA提取的质量和效果。在进行RPA反应前,将DNA样品保存在-20 ℃。
1
.2
.2
引物设计和筛选所有引物设计好后在Primer 5.0软件中测试,以检测序列中是否存在二聚体或特殊结构。在外源插入片段右边界侧翼序列设计引物进行RPA引物筛选,筛选设计上下游共10条引物,首先进行对应筛选,其次进行交叉序号筛选,最终确定最优引物。所用的特异性引物序列,由中国上海生工生物技术有限公司合成,见表1。
表1 转基因大豆‘B5C9123-5’RPA引物序列
Table 1 Primer sequence of transgenic soybean ‘B5C9123-5’
引物名称Primername序列(5′→3′)Sequence(5′→3′)9123-RPA-FP1CCACCACTCCCAATGACAACATTTTTTCGTAATAA9123-RPA-FP2TGAGCTTGGATCAGATTGTCGTTTCCCGCCTTCAG9123-RPA-FP3CAATGACAACATTTTTTCGTAATAACATTTGACGT9123-RPA-FP4ACAACATTTTTTCGTAATAACATTTGACGTTAATT9123-RPA-FP5ATTTTTTCGTAATAACATTTGACGTTAATTTGATA9123-RPA-RP1GCATCTTGAACGATAGCCTTTCCTTTATCGCAATG9123-RPA-RP2TACCACCTATGCCTATGCTGACAAAAAGTGGTTGT9123-RPA-RP3CGATAGCCTTTCCTTTATCGCAATGATGGCATTTG9123-RPA-RP4GCCTTTCCTTTATCGCAATGATGGCATTTGTAGGA9123-RPA-RP5TCCTTTATCGCAATGATGGCATTTGTAGGAGCCAC
1
.2
.3
RPA显色分析为验证RPA引物的有效性和优化RPA体系,对反应的基本条件进行了改进。使用英国Twist Dx公司的Twist Amp Basic kit 进行RPA扩增,每个反应体系为47.5 μL:29.5 μL复水缓冲液,2.4 μL正向和反向引物(10 μmol/L)和2 μL的DNA模板(100拷贝)。然后将反应混合物加入冻干管中,轻弹冻干管直到冻干粉末完全溶解。为引发反应,加入2.5 μL 280 mmol/L醋酸镁(MgAc)。加入MgAc后立即开始RPA反应,在39 ℃的热循环中孵育20 min。扩增产物用2%(w/v
)琼脂糖凝胶电泳分析。RPA显色反应体系中包含29.5 μL缓冲液,2.4 μL 的正向和反向引物(10 μmol/L)和2 μL的DNA模板(100拷贝),然后使用2.5 μL 280 mmol/L MgAc和双蒸水将反应体系补足到46 μL,最后将SYBR Green Ⅰ染料点加在RPA管盖。反应过程与RPA反应相同,反应完成后离心进行可视化和荧光分析,荧光数据使用日本岛津公司的RF6000荧光分光光度计收集,激发波长为497 nm,发射波长为520 nm。
2 结果与分析
2.1 RPA引物筛选
由图1可知,通过筛选得到特异性较好的引物对为9123-RPA-FD2/RP,特异性扩增片段大小为399 bp。由图2 可知,该对引物只在转基因大豆‘B5C9123-5’样品中扩增出399 bp特异性片段,特异性良好。由图3可知,通过对转基因大豆‘B5C9123-5’ 样品的DNA进行梯度稀释(200.00、100.00、50.00、10.00、5.00、1.00、0.50和0.10 ng/μL)后进行扩增,结果表明该对引物的检测灵敏度低至0.50 ng/μL。

1~10,不同引物对;11~12,空白对照;M,2 000 bp DNA分子量标准
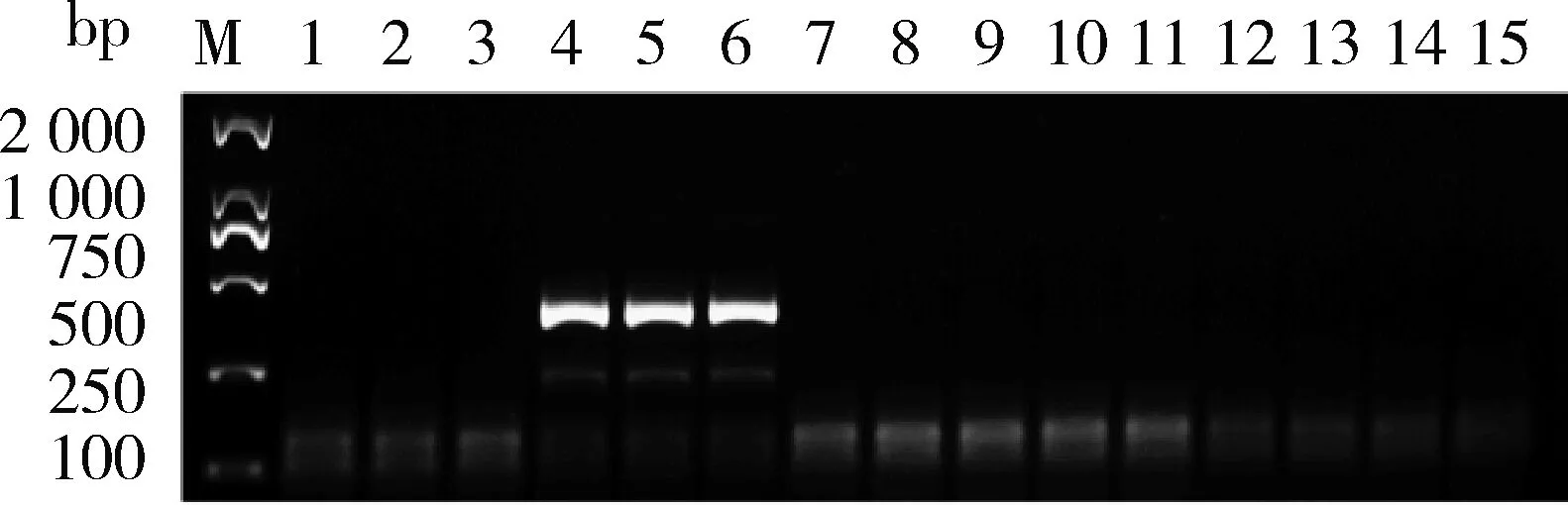
M,2 000 bp DNA分子量标准;4~6,RNAi大豆‘B5C9123-5’阳性样本;7~9转基因玉米,10 ng/μL;10~12转基因棉花,10 ng/μL;13~15转基因水稻,10 ng/μL。

1和2分别是空白和阴性对照;3~10分别为RNAi大豆‘B5C9123-5’阳性样本浓度200.00,100.00,50.00,10.00,5.00,1.00,0.50和0.10 ng/μL;M,2 000 bp DNA分子量标准。
2.2 可行性验证
由图4(a)和(b)可知,RPA完成后,阴性和阳性样品溶液颜色具有明显差别,荧光强度也反映阴性和阳性样品之间的差异。此外,由图4(c)和(d)可知,荧光数据以及电泳结果也证明阴性样品和阳性样品之间的差异。

1,空白对照;2,阳性对照;M,DNA marker 2 000
2.3 参数优化
2
.3
.1
时间优化在RPA反应后5 min,开始观察溶液的颜色变化。由图5可知,在开始反应后的25 min内,随着时间的延长,溶液颜色逐渐由黄色转变为绿色。在反应到达15 min后,溶液颜色和荧光强度变化较小。荧光结果说明15 min RPA反应已经逐渐达到阈值,荧光强度随反应时间再延长而减弱。因此,选择15 min为RPA可视化分析的最佳检测时间。
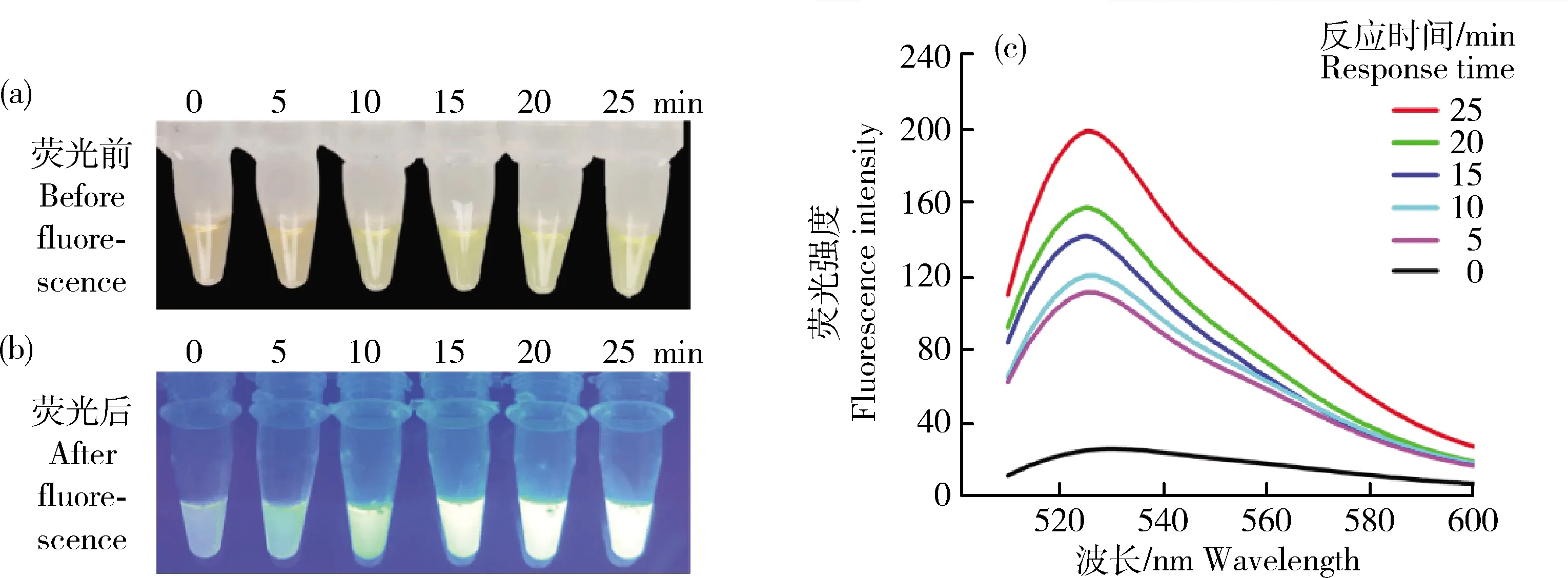
(a)0~25 min RPA可见光条件;(b)0~25 min RPA荧光条件;(c)不同时间段RPA可视化的荧光参数
2
.3
.2
温度优化在31~51 ℃,对RPA可视化的反应温度进行优化。由图6可知,反应发生的15 min后,较低反应温度下(31 ℃)以及较高温度下(51 ℃),溶液颜色均为黄色,而反应温度为39 ℃时溶液颜色呈现最佳的绿色。荧光试验结果说明反应温度为39 ℃时,荧光强度达到最高值。因此,RPA可视化分析的最佳反应温度为39 ℃。

(a)31~51 ℃ RPA可见光;(b)31~51 ℃ RPA荧光;(c)不同温度下RPA荧光强度
2.4 特异性测试
使用不同转基因植物的混合DNA,评估优化后RPA可视化分析的特异性。结果显示,仅有RNAi转基因大豆样品溶液的颜色发生变化。由图7可知,溶液颜色由黄色转变为绿色,其余样品溶液颜色均未发生改变。由图8可知,荧光结果有力地佐证了RPA可视化分析在RNAi转基因大豆可视化检测中的特异性。

a1~a3,非转基因大豆;b1~b3,转基因玉米;c1~c3,RNAi转基因大豆‘B5C9123-5’;d1~d3,转基因棉花;e1~e3,转基因水稻;各种植物的DNA含量为50.0 ng/μL。
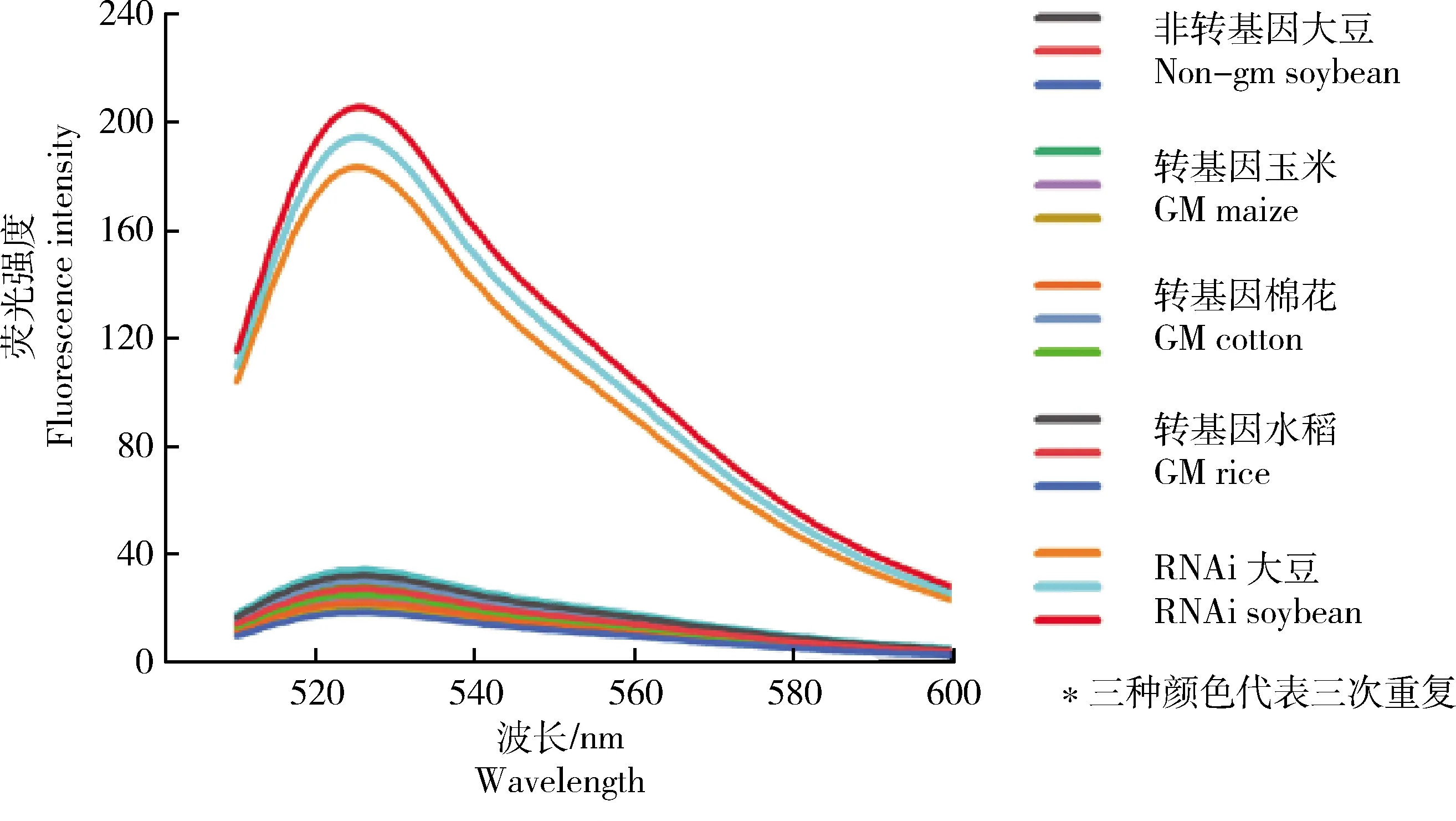
图8 不同转基因作物RPA可视化特异性荧光强度验证
2.5 灵敏度测试
在优化后的试验条件下,使用混有不同RNAi转基因大豆成分(200.00、100.00、50.00、10.00、5.00、1.00、0.50和0.10 ng/μL)的大豆粉末,验证RPA可视化分析的灵敏度。随着RNAi转基因大豆DNA的浓度逐渐降低,溶液颜色逐渐由绿色向黄色发生偏移。由图9可知,RPA可视化分析的检测限为1.00 ng/μL。荧光条件下,RPA可视化分析的检测限为0.50 ng/μL。由图10可知,荧光数据验证了RPA可视化分析的灵敏度。

图9 不同浓度RNAi转基因大豆DNA的RPA可视化灵敏度结果

图10 RNAi转基因大豆RPA可视化验证灵敏度荧光强度
3 讨 论
自20世纪90年代中期,美国孟山都公司生产的第一种转基因大豆在美国商品化生产以来,现代生物技术在大豆中得到了广泛的商业化应用。然而,现代生物技术在农作物中的应用也带来了对于食品安全、环境风险和伦理问题等的担忧。
与PCR相比,重组酶聚合酶扩增(RPA)反应需要相对较长的引物与重组酶结合,这一过程会导致大量引物二聚体的产生。在可行性验证过程中,大量引物二聚体导致空白对照出现较强的背景信号。本研究通过改进RPA反应的基本条件,实现了降低背景值及获得最大颜色差异的目的。在进行时间优化时,观察到RPA最快在5 min内就启动反应。随时间延长RPA反应扩增产物不断增加并在15 min后达到阈值。在对温度进行优化时,发现RPA在较大的温度范围内(35~43 ℃)发挥作用。以上结果均表明RPA反应体系的快速、高效以及对于开发新型现场检测技术的潜在适用性。在进行灵敏度研究时,比色法的检测限为1.00 ng/μL,而荧光条件下检测限为0.50 ng/μL。这是因为黄色和绿色较为相近导致在进行低浓度样品比色测定时阳性与阴性样品的区分度差。为实现低浓度样品的快速检测,使用手持式荧光或采用混合染料对样品进行测定可能是一个不错的解决方案。在分子扩增检测技术中,DNA提取和纯化是其检测过程中的关键点。虽然,市场上已经出现了针对多种不同材料的商业化DNA提取试剂盒,但是,提取过程中所需的涡旋、离心设备,多次的移液步骤和相对复杂的操作过程使其难以应用于现场检测应用。最近,一些研究也报道了使用磁珠或不同类型的膜(氧化铝,纤维素和二氧化硅等)捕获和结合DNA,从而加快DNA提取过程,缩短DNA提取时间。虽然,这类技术提取的DNA质量可能会比商业化DNA提取试剂盒的提取效果差,但是,相对简单的操作,不依赖其他设备优势使其完全满足现场检测的要求。
除了RNAi转基因作物以外,具有2种或2种以上转基因性状(堆叠)的转基因作物的种植也在世界各地迅速增加。虽然所建立的RPA现场可视化分析已经取得了一些进展,但是多重RPA检测技术仍然相对较为复杂。多重放大反应受多种因素的影响,包括扩增子长度、模板浓度和退火温度等。然而,所有倍数放大的本质都是引物与靶标的特异性结合引起的。多引物的存在增加了反应体系的复杂性,并且不同引物的扩增效率不同。通用引物似乎是有效地解决这些问题的关键。通用引物可保证每个目标的均匀放大效率。目前,已经出现许多基于通用引物的检测方法用于检测多个目标,包括识别4种肉(牛、猪、马和鸡),区分食品样本中3种不同细菌以及特异性检测堆叠转基因玉米(‘Bt11’和‘GA21’)等,但是在RPA体系中使用通用引物扩增多重靶标仍需要进一步探究。
4 结 论
综上所述,基于SYBR Green Ⅰ染料,设计了1种转基因大豆现场可视化RPA检测方法。结果表明,该方法可在20 min内筛选出混有1.00 ng/μL RNAi转基因大豆的混合样品。该技术与快速DNA提取方法联用,可极大简化检测过程,提高检测效率。同时,使用便携式恒温加热仪器来进行RPA反应,可降低检测成本。

