miRNAs调节脐带间充质干细胞向内皮细胞分化的研究
李华 肖萍萍 苏俊男 赖 冬 林姝婷 黄金梅 田丽红
(1 厦门医学院附属第二医院科教部,福建 厦门 361021;2 厦门医学院附属第二医院血液/风湿免疫科,福建 厦门 361021;3 厦门医学院附属第二医院输血科,福建 厦门 361021)
缺血性疾病是临床常见病,严重影响患者的生活质量,甚至危及生命,长期缺血容易对血管内皮细胞(VEC)造成不可逆的伤害,导致血管供血不足,器官衰竭,最终导致严重的并发症[1]。缺血性脑血管病(如脑梗死)、缺血性心脏病(如心肌梗死)、缺血性下肢病变(如闭塞性血栓血管炎)在临床上较为常见,严重危害人类健康。但药物治疗和血管搭桥治疗严重缺血性血管疾病存在一定的局限性。组织工程血管移植是一种很有前景的缺血性疾病治疗技术。血管再生是组织修复、组织移植和手术修复的关键因素之一。内皮细胞是血管壁形成的重要组成部分,也是是组织工程血管移植的重要材料,内皮细胞的植入有助于形成复杂的、有功能的新生血管系统[2-3]。然而,内皮细胞来源的不足,限制了内皮细胞的临床应用[4]。人间充质干细胞(human mesenchymal stem cells,MSCs)可以从多种组织中分离出来,如羊膜、绒毛膜、华通氏胶、羊水、脐带血和骨髓等。MSCs具有多向分化和自我更新的特性,利用其分化为平滑肌细胞和内皮细胞的能力,可以用作血管组织移植[2,4]。
MicroRNA(miRNA)是短链非编码RNA,长度为20~25 nt,它通过抑制翻译或破坏靶mRNA的稳定来调节靶mRNA的表达,参与调节多种重要的生物学过程,包括细胞周期、造血、神经发生、衰老、癌症和心血管疾病[5]。有证据表明,miRNA是内皮细胞功能的关键调节因子,尤其是血管生成的重要调节因子。Hu等[6]发现,上调miR-126可以抑制EVH1结构域含蛋白1、磷酸肌醇-3激酶调节亚基2和血管细胞黏附分子1三个靶基因来促进小鼠的血管生成。Lou教授等研究发现,miR-122-5p通过靶向内皮细胞中的AGPAT1增强脂肪酸的使用,促进小鼠的微血管生成,显示miR-122-5p在组织修复中的治疗潜力[7]。VEGF也是miR调节的一个靶点,miR-146[8]和miR-126均可增强VEGF的促血管生成作用,促进血管形成[9]。下调miR-26a-5p促进微血管内皮细胞的管形成[10]。过表达miR-34a会通过靶向Notch通路增加vWF和CD31的表达,从而促进脑肿瘤干细胞向血管内皮细胞分化[11]。下调microRNA-145可提高vWF和CD31的表达,从而调节脂肪干细胞向微血管内皮细胞分化,促进血管生成[12]。是否脐带来源的间充质干细胞向血管内皮分化具有可行性,通过MicroRNA的调控来阐明其部分分化机制,有利于未来血管组织工程学的研究和临床应用。
因此,本研究旨在鉴定与人脐带间充质干细胞(hUCMSCs)向血管内皮细胞分化相关的miRNA,从而阐明调控这一过程的miRNA分子。本研究从脐带中分离出MSCs,并分化为内皮细胞,检测分化过程中vWF和CD31的水平以及分化前后miRNAs的变化。
1 材料与方法
1.1 MSCs的分离和培养 本项目经厦门医学院第二附属医院伦理委员会批准(2016012),在知情同意的情况下,从健康的孕产妇捐赠者处获取脐带。用含25 mg/L庆大霉素的生理盐水清洗3次后,将脐带剪成1 cm×1 cm的小块,然后切除下方的血管周围沃顿氏果冻组织。将切除的组织切成3 mm×3 mm的切片,置于10 cm的组织培养皿中,培养皿中含有5 mL无血清的MSCs培养液(Yocon,北京),置于含5% CO2的37 ℃培养箱进行培养。第3天加入5 mL培养基,第7天更换培养基,培养7~9 d后,当细胞生长至融合传代时,第13天用含1 mmol/L EDTA 2.5g/L胰蛋白酶消化,离心去上清,收集细胞,以8000个/cm2的密度接种到培养皿中。
1.2 MSCs向内皮细胞分化 采用EBMTM-2内皮细胞生长基础培养基-2(Lonza),第三代的MSCs以5×104/cm2的浓度接种于10 cm培养皿中,用EGMTM-2 MV微血管内皮细胞培养基(Lonza)诱导分化。根据试剂盒说明诱导2~3周后,收集细胞并通过流式细胞仪鉴定。
1.3 流式细胞术鉴定细胞 收集细胞并用磷酸盐缓冲盐水(PBS)冲洗一次。流式细胞仪计数活细胞,制片1×106细胞,用100 μL PBS重悬。在细胞中加入荧光抗体(5 μL),在25 ℃下孵育10 min。PBS洗涤3次后,每个样本用100 μL PBS重悬,使用NovoCyteTM流式细胞仪(ACEA,San Diego,CA,美国)分析。
1.4 RNA水平检测 使用Trizol(Ambion,上海)从细胞中提取RNA,并使用Hiscript逆转录酶(VAZYME,南京,)逆转录为cDNA。按照Xu等[13]文献描述。利用特异性引物完成miRNA的逆转录。然后采用SYBR Green Master Mix(VAZYME,南京,)对该cDNA进行进行实时PCR(RT-PCR)检测RNA水平,miRNA水平检测采用相同的逆转录引物。
1.5 蛋白质水平检测 采用Western blot方法检测CD31和vWF蛋白水平,使用冷的RIPA缓冲液(beyotime,上海)、PVDF膜(Millipore,上海)和抗体,根据Zheng等[14]文献所述步骤进行操作。
1.6 双荧光素报告酶分析 获得用于双荧光素酶报告基因检测的CD313'UTR和vWF 3'UTR质粒,分别命名为CD313'UTR和vWF 3'UTR。采用HEK293细胞(IMMOCELL,厦门,)进行双荧光素酶报告基因检测,如Xu等[15]所述。将CD313'UTR与阴性对照miRNA mimic(miRNA-nc)或miR-26a-5p mimic共转染到细胞中;vWF 3'UTR与阴性对照miRNA-NC或miR-15a-5p,miR-761,miR-335-5p and miR-16-5p mimic共转染到细胞中。并使用Lipofectamine 2000(Invitrogen公司,上海),根据试剂说明共转染到HEK293细胞。48 h后,采用双荧光素酶报告基因检测系统(Promega,北京)进行双荧光素酶报告基因检测。
1.7 成管实验 通过体外血管形成实验来检测MSCs的血管生成潜能,如前所述[16],将基质(康宁)与培养基按等比例混合,以50 μL/孔的体积加到96孔板中。将分化9天的细胞收获,以2×104细胞/孔的密度播种于96孔板中,孵育12 h。倒置显微镜下拍照观察管的形成情况。
1.8 统计学分析 两组比较采用非配对样本t检验,多组间比较采用方差分析。结果在P<0.05被认为有统计学差异。所有统计分析均采用SPSS软件(22.0版)。图表和热图使用GraphPad Prism 8制作。
2 结果
2.1 间充质干细胞的增殖与鉴定 从新鲜人脐带中分离的细胞呈成纤维细胞样,梭形形态,呈黏附生长(图1A)。从第7代到第8代,增殖率显著增加(图1B)。流式细胞术结果显示,MSCs标志物CD29、CD44、CD105表达,不表达HLA-G、HLA-DR、CD80、CD86、CD45、CD31、CD34、vWF(图1C)。这些结果表明,间充质干细胞被成功地分离和增殖。
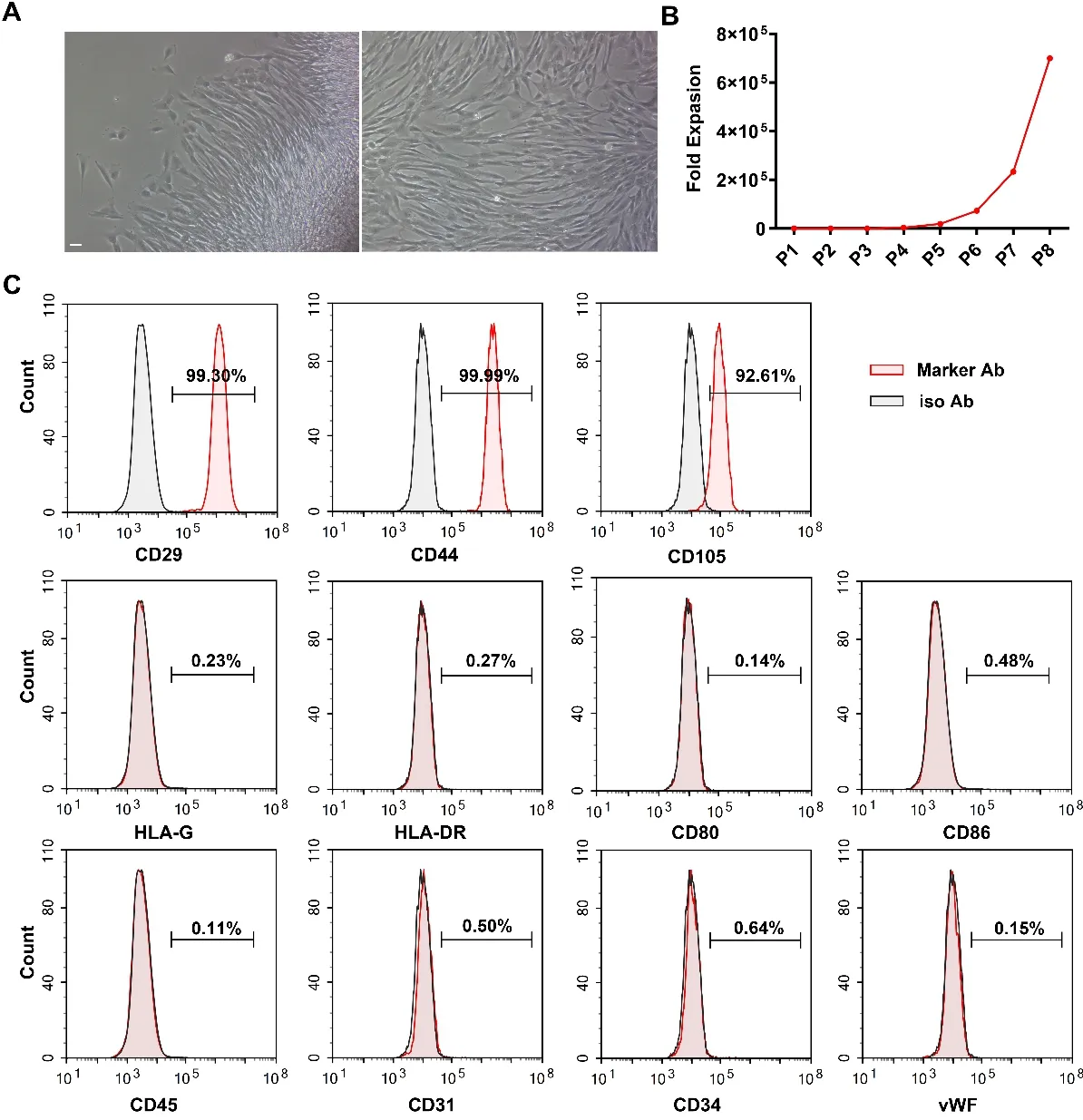
图1 间充质干细胞的特征
2.2 MSCs向内皮细胞分化的诱导 诱导分化后,MSCs呈短梭形,与未分化的MSCs明显不同(图2A)。诱导分化9天的细胞能够形成独立条索状的血管样结构(图2B)。在诱导期,细胞生长迅速。Western blot、RT-PCR和流式细胞术检测CD31和vWF的表达(图3)。诱导第9天,约60%的培养细胞中观察到CD31和vWF的表达(图3A)。随着培养的进行,CD31和vWF的表达逐渐诱导增加,而未分化的MSCs(第0天)在整个细胞培养过程中不表达内皮标志物(图3B-3D),表明MSCs成功分化为内皮细胞。
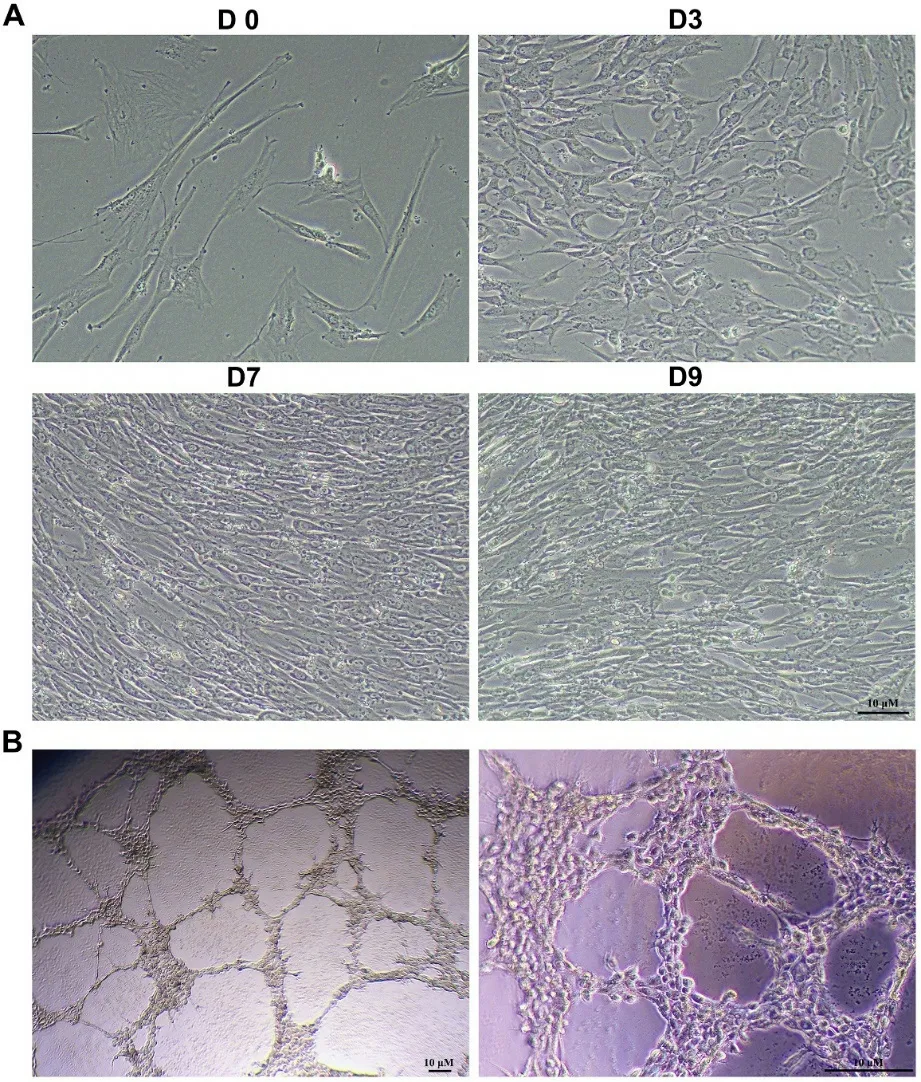
图2 (A)不同时间点诱导分化后MSCs的形态特征。(B)分化9 d后细胞间充质细胞被诱导形成血管。

图3 (A)诱导9天后流式细胞术鉴定诱导的间充质干细胞。(B)RTPCR检测内皮特异性标志物的表达。(C-D)western blot检测内皮特异性标志物的表达。ns:无差异;*:P<0.05;**:P<0.01;***:P<0.001;****:P<0.0001
2.3 靶向CD31和vWF的miRNA的预测和验证 使用TarBase、miRDB和mirDIP预测靶向CD31或vWF的miRNA。这三个数据库只预测了1个靶向CD31的miRNA和9个靶向vWF的miRNA(图4A,4B)。为了鉴定参与MSCs向内皮细胞分化的miRNA,分别收集分化0、3、7和9天的MSCs。随后检测细胞中这些miRNA的水平,发现分化第9天,靶向CD31的miR-26a-5p水平显著下降,靶向vWF的miR-24-3p、miR-15b-5p、miR-497-5p、miR-214-3p、miR-761、miR-335-5p和miR-16-5p水平显著下降。而miR-15a-5p、miR-195-5p与诱导前无显著差异(图4C-4E)。基于以上结果,本研究选择miR-26a-5p、miR-15a-5p、miR-761、miR-355-5p和miR-16-5p通过双荧光素酶报告基因检测进行验证。结果表明,miR-26a-5p靶向CD31的3'UTR,miR-761、miR-335-5p和miR-16-5p靶向vWF的3'UTR,而miR-15a-5p不靶向vWF的3'UTR(图4F)。

图4 预测和鉴定靶向CD31或vWF的miRNA。(A)预测靶向CD31的miRNA。(B)预测靶向vWF的miRNA。(C-E)不同分化时间点miRNA的表达。(F)双荧光素酶报告基因实验,验证miRNAs靶向CD31或vWF的能力。ns:无差异;*:P<0.05;**:P<0.01;***:P<0.001;****:P<0.0001
3 讨论
间充质干细胞在再生医学中具有潜在的治疗能力,特别是MSCs在体外诱导内皮细胞功能,体内促进血管生成。因此,MSCs作为一种有前景的治疗方法将在缺血性疾病中被广泛研究。心肌梗死、缺血性脑卒中和严重肢体缺血的动物研究表明,人MSCs能促进个体发生,加速组织再生。在MSC来源方面,脐带与其他组织相比,具有以下几个优点:获得比替代组织更安全,冷冻保存仍能保持细胞活力,传播微生物和体细胞突变的风险低,获取该组织不存在道德和伦理问题。因此,脐带是间充质干细胞的重要来源。此外,血管内皮生长因子(VEGF)和碱性成纤维细胞生长因子(bFGF)已经被证明可以诱导MSCs向内皮细胞分化[15]。EGF和VEGF的结合可以诱导MSCs具有内皮细胞的一些特征,内皮细胞有助于新生血管的形成,通常表达特异性的表面生物标志物,包括CD31、CD34、vWF、VE-Cadherin、血管内皮生长因子受体-2(VEGFR-2)。有研究报道,VEGF、bFGF、IGF、EGF同时刺激MSCs可更有效地诱导MSCs向内皮细胞分化。在这项研究中,本研究利用上述刺激因子诱导脐带来源的MSCs分化成内皮细胞。但是间充质干细胞分化为内皮细胞涉及多种基因和相互作用的信号通路的调节关系,MSCs向内皮细胞分化的基因表达变化尚不完全清楚。通过探索mirRNA的调控机制,部分阐明相关调控机制,为临床缺血性疾病的治疗提供依据。
证据表明,miRNA在MSCs向内皮细胞分化中发挥关键作用。miRNA是一种包含17-25个核苷酸的单链小RNA,不编码任何蛋白质,被认为是生物过程的调节者。miRNA通过与靶mRNA的3'-非翻译区(3'-UTR)结合,导致其降解或抑制其翻译,从而调控基因表达。研究表明,miRNA靶向MSCs分化相关的关键转录因子[17]。过表达miR-126通过激活PI3K/Akt和MAPK/ERK通路并释放旁分泌因子促进MSCs向内皮细胞分化[18]。本研究探索了参与MSCs分化内皮细胞的miRNA。本研究筛选和验证的变化水平的miRNA针对CD31或vWF是内皮细胞的表面标记。分化后发现,miR-26a-5p的水平,miR-24-3p,miR-15b-5p,mir-497-5-p,mir-214-3-p,mir-761,mir-335-5p,和miR-16-5p被降低了。有报道称,下调miR-26a-5p可促进微血管内皮细胞的形成,这与本研究类似。miR-15b/miR-16抑制血管生成[19]。miR-24靶向GATA4和PAK 2抑制血管生成[20]。据报道,miR-214可调节血管内皮对血管生成刺激的反应[21];miR-335-5p与血管生成调控相关[22]。这些研究与本研究工作一致,本研究利用荧光素酶报告系统也验证了其调控作用。然而,人脐带来源的MSCs衍生的血管内皮细胞在体内形成血管的能力仍有待进一步探索。这些miRNA调控MSCs向内皮细胞分化的具体分子机制尚待进一步研究。
总之,本研究成功地分离和诱导了脐带间充质干细胞向血管内皮细胞的分化,同时还发现MSCs分化后,靶向CD31的miR-26a-5p和靶向vWF的miRNAs(包括miR-24-3p、miR-15b-5p、miR-497-5p、miR-214-3p、miR-761、miR-335-5p、miR-16-5p)水平下降,初步揭示了MSCs向内皮细胞分化的分子机制,为体外血管形成的进一步研究奠定了基础。

