基于蛋白模板金纳米簇及羟基氧化钴纳米片的激活型荧光纳米探针用于免标记和灵敏检测生物硫醇
李 硕,张桂华,王郁敏,俞 英,林碧霞,张 立,曹玉娟,郭慢丽
(华南师范大学 化学学院 广州市生物医药分析化学重点实验室,广东 广州 510006)
自石墨烯在2004 年被发现以来,超薄二维(2D)纳米材料引起了越来越多的研究兴趣[1-2]。2D 石墨烯及其衍生物具有独特的物理化学特性,如电导率和荧光猝灭效率高、电子流动性强等,这些特性使其在诸多领域有着广泛的应用前景[3-4]。具有优异性能的2D 纳米材料,如二硫化钼(MoS2)纳米片[5]、黑磷纳米片[6]、碳化钛(Ti3C2)纳米片[7]和氮化碳(gC3N4)纳米片[8],也已被报道并成功应用于生物传感和生物分析。但大多数2D纳米材料的合成步骤复杂,且有些在制备过程中依赖有机试剂,可能会限制其在生物医学和生物分析中的实际应用[9-10]。另外,部分2D 纳米材料水溶性差,在后续的应用过程中需改善其亲水性[11-12]。同时大部分2D纳米材料很难被生物降解,生物毒性较大[13-14],这导致其在生物系统中的应用受到限制。
近年来,一种新兴的二维过渡金属纳米材料—CoOOH 纳米片引起了众多研究领域科学家的兴趣[15]。CoOOH纳米片的优点之一是可以简单便捷地在短时间内进行大规模制备。此外,CoOOH纳米片的生物相容性好,表面具有丰富的羟基,具有良好的水分散性,这些特性使之在生物传感和生物成像领域的应用更具优势[16-17]。类似于石墨烯纳米片,CoOOH 纳米片不具有荧光,将其应用于开发新型荧光生物传感方法时,需要引入荧光报告分子。迄今为止,已经报道了各种基于CoOOH 纳米片与荧光无机纳米材料制备的荧光纳米探针[18-20]。然而,这些纳米探针中的荧光无机纳米材料的合成过程通常耗时且复杂,且大多数探针局限应用于抗坏血酸(AA)的检测。因此,进一步发展基于CoOOH 纳米片的荧光纳米探针并扩展其生物学应用具有重要的意义。目前,研究者发现单链DNA 可通过静电作用吸附到CoOOH 纳米片表面,并报道了DNA 与CoOOH 纳米片之间的相互作用[21-22],同时基于CoOOH 纳米片对有机荧光团标记的DNA的高效猝灭效率,实现了对多核苷酸激酶和DNA的检测。但以上所构建的荧光生物传感新方法仍无法克服需要用有机荧光团标记、合成成本高、标记过程复杂等固有缺点。因此基于CoOOH纳米片构建新型荧光纳米探针具有十分重要的意义。
蛋白质是生命系统中最丰富、最重要的生物大分子,具有许多不同的功能基团、特定的氨基酸序列和二级结构[23]。此外,蛋白质可以作为模板原位合成荧光金属纳米簇(如金、银和铜纳米簇)[24]。生物硫醇主要包括半胱氨酸(Cys)、高半胱氨酸(Hcy)和谷胱甘肽(GSH)。研究表明,人体内生物硫醇的含量异常与多种疾病密切相关。本文研究了CoOOH 纳米片与蛋白质之间的相互作用,同时,基于CoOOH 纳米片和蛋白质模板金纳米簇开发了一种新型、激活式的荧光纳米探针用于生物硫醇检测,并将其用于实际血清样品中生物硫醇的测定,结果满意。
1 实验部分
1.1 试剂与仪器
氢氧化钠(NaOH)、氯金酸(HAuCl4)、氯化钴、次氯酸钠(阿拉丁(上海)有限公司);牛血清白蛋白(BSA)、L半胱氨酸盐酸盐(Cys)、L高半胱氨酸(Hcy)(美国Sigma 公司);谷胱甘肽(GSH)(麦克林(上海)有限公司);实验所用试剂均为分析纯;实验用水均为超纯水。
FL-4600荧光分光光度计、能量色散光谱仪(EDS)(日本日立公司);UV-2700型紫外-可见分光光度计(日本岛津公司);场发射2100F TEM 透射电子显微镜(日本JEOL 公司);Zetasizer Nano ZS90 电势分析仪(英国Malvern公司);Metrohm Autolab PGSTAT302 N电化学工作站(荷兰Eco Chemie公司)。
1.2 BSA模板金纳米簇(BSA@AuNCs)的合成
将5.0 mL 氯金酸(10 mmol/L)水溶液逐滴添加到5.0 mL BSA(50 mg/mL)水溶液中,并将混合物在37 ℃下剧烈搅拌。反应2 min后,逐滴加入0.5 mL氢氧化钠溶液(1 mol/L),保持剧烈搅拌,在37 ℃下进行原位还原反应11 h。透析除去过量的氢氧化钠和氯金酸得到纯化的BSA@AuNCs。
1.3 CoOOH纳米片的制备
将250µL氢氧化钠溶液(1 mol/L)快速与1.0 mL氯化钴溶液(10 mmol/L)混合,并将混合物在室温下超声处理2 min。然后,将50µL的次氯酸钠溶液(0.9 mol/L)添加到混合物中,在室温下超声处理15 min后,离心弃去上清液,再用超纯水洗涤,制备得到CoOOH纳米片,置于4 ℃保存。
1.4 BSA@AuNCs-CoOOH 纳米探针的制备
将50 µL CoOOH 纳米片(0.2 mg/mL)和25 µL BSA@AuNCs 溶液(0.5 µmol/L)加入到25 µL NaAc-HAc缓冲液(80 mmol/L,pH 5.0)中,加超纯水至总体积为200µL,然后将混合物在避光条件下剧烈搅拌40 min。离心去除上清液中过量的BSA@AuNCs,将制备好的BSA@AuNCs-CoOOH 纳米探针重新分散在水溶液中。
1.5 定量检测生物硫醇
在一系列离心管中依次加入75µL BSA@AuNCs-CoOOH 纳米探针和25µL NaAc-HAc(10 mmol/L,pH 5.0)缓冲液,然后分别加入200µL 不同浓度(0、0.05、0.5、5、50、100、150、200、300、400、500µmol/L)的生物硫醇溶液,加超纯水至总体积为500µL,混合均匀后置于37 ℃水浴锅中反应15 min。每组平行3次,利用荧光光谱仪记录荧光光谱。
1.6 血清样品中生物硫醇的检测
将1.0 mL血液样品与1.5 mL乙腈溶液混合后于室温下振荡30 min,离心10 min后取上清液,使用0.22µm滤膜过滤后以超纯水稀释100倍。取50µL上述血清样品,向其中加入150µL超纯水或不同浓度的生物硫醇溶液后充分振荡混匀后,按“1.5”实验方法测定样品中生物硫醇的含量。
2 结果与讨论
2.1 实验原理
基于BSA@AuNCs 和CoOOH 纳米片的激活型荧光纳米探针的制备及其用于生物硫醇检测的示意图见图1。首先,蛋白内部特定的氨基酸捕获金离子形成BSA-Au 复合物,碱性条件下,酪氨酸残基将原位螯合的金离子还原成红色荧光的BSA@AuNCs(图1A);其次,带负电的BSA@AuNCs 通过静电作用组装到带正电的CoOOH 纳米片表面形成BSA@AuNCs-CoOOH 纳米探针,此时,由于内滤效应(IFE),BSA@AuNCs 的荧光被CoOOH 纳米片猝灭。当加入生物硫醇后,BSA@AuNCs-CoOOH 纳米探针中的CoOOH 纳米片与生物硫醇发生氧化还原反应,CoOOH纳米片被溶解并生成Co2+,同时释放出BSA@AuNCs,BSA@AuNCs 被猝灭的荧光信号得以恢复。因此可以通过BSA@AuNCs 荧光信号的变化来测定生物硫醇的含量。
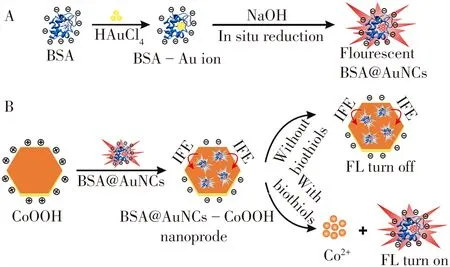
图1 BSA@AuNCs的合成过程(A)及BSA@AuNCs-CoOOH 纳米探针的制备及用于生物硫醇检测的原理图(B)Fig.1 Schematic illustration of the synthetic process of BSA@AuNCs(A),and the preparation of BSA@AuNCs-CoOOH nanoprobe and its application for the detection of biothiols(B)
2.2 CoOOH 纳米片与BSA@AuNCs 的相互作用及荧光猝灭机理研究
由图2A 可见,随着CoOOH 纳米片质量浓度的增加,BSA@AuNCs 的荧光逐渐被猝灭。据文献报道,BSA 的等电点为4.8,理论上BSA 在pH 5.0 条件下带负电荷[25]。如图2B 所示,BSA 和BSA@AuNCs 均在pH 5.0 条件下带负电,而CoOOH 纳米片在相同的实验条件下带正电,BSA@AuNCs 与CoOOH 纳米片作用后形成的BSA@AuNCs-CoOOH 纳米探针则带负电。该结果表明BSA@AuNCs 与CoOOH 纳米片之间的相互作用源于静电吸附。如图2C 所示,CoOOH 纳米片吸收光谱(黑线)与BSA@AuNCs 的荧光激发和发射光谱(蓝线和红线)存在重叠,表明荧光猝灭可能由内滤效应(IFE)引起[19]。
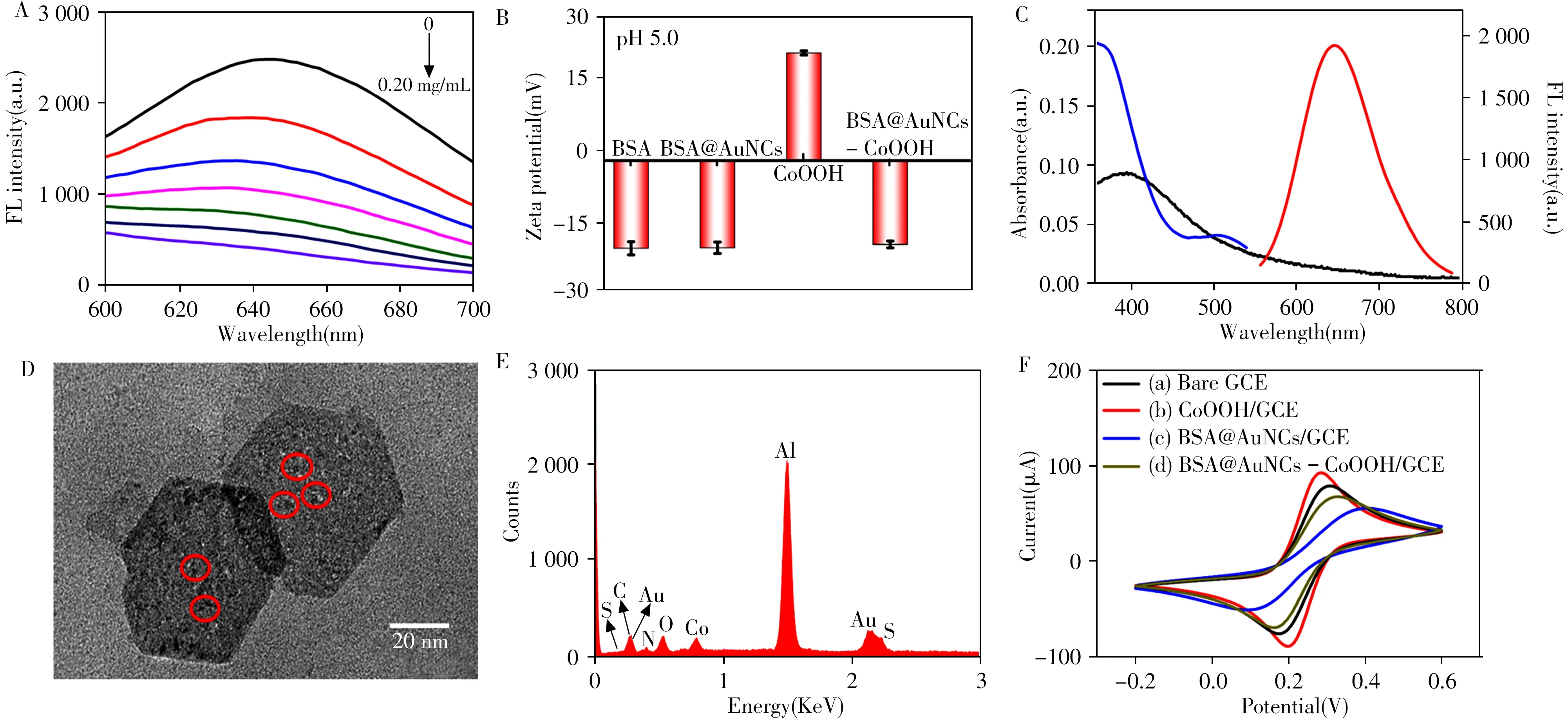
图2 加入不同质量浓度CoOOH 后BSA@AuNCs 的荧光光谱(A),BSA、BSA@AuNCs、CoOOH 和BSA@AuNCs-CoOOH的Zeta电位(B),CoOOH的紫外可见吸收光谱(黑线)、BSA@AuNCs的荧光激发(蓝线)和发射光谱(红线)(C);BSA@AuNCs-CoOOH的TEM图像(D)和EDS(E)以及玻碳电极不同修饰状态下的循环伏安曲线(F)Fig.2 Fluorescence spectra of BSA@AuNCs with addition of different amounts of CoOOH(A);Zeta potential of BSA,BSA@AuNCs,CoOOH and BSA@AuNCs-CoOOH(B);spectral overlap showing the UV-Vis absorption spectrum of CoOOH(black line),fluorescence excitation(blue line)and emission spectrum(red line)of the BSA@AuNCs(C);TEM image(D)and EDS(E)of BSA@AuNCs-CoOOH nanoprobe;cyclic voltammograms(F)of bare GCE(a),CoOOH/GCE(b),BSA@AuNCs/GCE(c)and BSA@AuNCs-CoOOH/GCE(d)
图2D 显示,BSA@AuNCs 很好地分散在六边形CoOOH 纳米片的表面上。BSA@AuNCs-CoOOH 纳米探针的能量色散光谱上出现Co、O、S和Au元素的特征峰(图2E)。如图2F所示,与玻碳电极(GCE)相比,当CoOOH 组装在GCE 表面时,氧化还原电流峰值增大;而当BSA@AuNCs 吸附在电极表面后,氧化还原电流峰值急剧下降;当BSA@AuNCs-CoOOH 滴涂在电极表面时,氧化还原电流峰值有所减小。以上数据证实了AuNCs 和CoOOH 纳米片之间的强相互作用以及BSA@AuNCs-CoOOH 纳米探针的成功制备。
2.3 BSA@AuNCs-CoOOH 纳米探针用于生物硫醇测定的可行性验证
如图3A 所示,在360 nm 光激发下,BSA@AuNCs 在650 nm 处的发射峰发出很强的荧光信号(曲线a),其水溶液在紫外光下呈亮红色(图3B 插图)。相反,BSA@AuNCs-CoOOH 纳米探针的荧光信号大大降低(图3A 曲线b 和3B),对应的溶液呈无色(图3B 插图b)。当加入生物硫醇Cys 时,CoOOH 在400 nm 处的特征吸收峰值下降(图3A 插图曲线b),表明BSA@AuNCs-CoOOH 纳米探针中的CoOOH 通过氧化还原反应被溶解,同时释放出BSA@AuNCs,此时,BSA@AuNCs 在650 nm 处的强荧光信号得以恢复(图3A 曲线c)。另外,反应混合物的颜色变为最初的亮红色(图3B 插图c、d、e)。
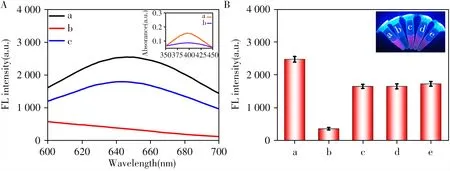
图3 BSA@AuNCs(a)、BSA@AuNCs-CoOOH(b)和BSA@AuNCs-CoOOH+Cys(c)的荧光光谱(激发波长360 nm)(A),以及BSA@AuNCs(a)、BSA@AuNCs-CoOOH(b)、BSA@AuNCs-CoOOH+Cys(c)、BSA@AuNCs-CoOOH+GSH(d)和BSA@AuNCs-CoOOH+Hcy(e)在650 nm处的荧光峰值(B)Fig.3 Fluorescence emission spectra of BSA@AuNCs(a),BSA@AuNCs-CoOOH(b)and BSA@AuNCs-CoOOH+Cys(c)with excitation wavelength at 360 nm(A);fluorescence peak at 650 nm(B)of BSA@AuNCs(a),BSA@AuNCs-CoOOH(b),BSA@AuNCs-CoOOH+Cys(c),BSA@AuNCs-CoOOH+GSH(d)and BSA@AuNCs-CoOOH+Hcy(e)inset A:UV-Vis absorption spectra of BSA@AuNCs-CoOOH(a)and BSA@AuNCs-CoOOH+Cys(b);inset B:photographs of corresponding reaction mixtures under UV irradiation
利用BSA@AuNCs-CoOOH 纳米探针对Cys、GSH 和Hcy 进行定量分析。如图4 所示,随着生物硫醇浓度从0.05µmol/L 增加至500µmol/L,BSA@AuNCs 的荧光信号逐渐恢复,且荧光峰(650 nm)强度比值(IF/IF0)与生物硫醇浓度(0.05~150 µmol/L)的对数值(lgc)呈良好的线性关系,拟合得到Cys、GSH 和Hcy 的线性方程分别为IF/IF0= 2.88 + 0.808 lgcCys(r2= 0.990)、IF/IF0= 2.80 + 1.05 lgcGSH(r2=0.998)和IF/IF0= 2.99 + 0.973 lgcHcy(r2= 0.992)。根据空白溶液3 倍标准偏差计算得到Cys、GSH和Hcy 的检出限(LOD)为30 nmol/L。相比于其他生物硫醇的光学检测方法,本方法具有相当或更低的检出限[26-28]。
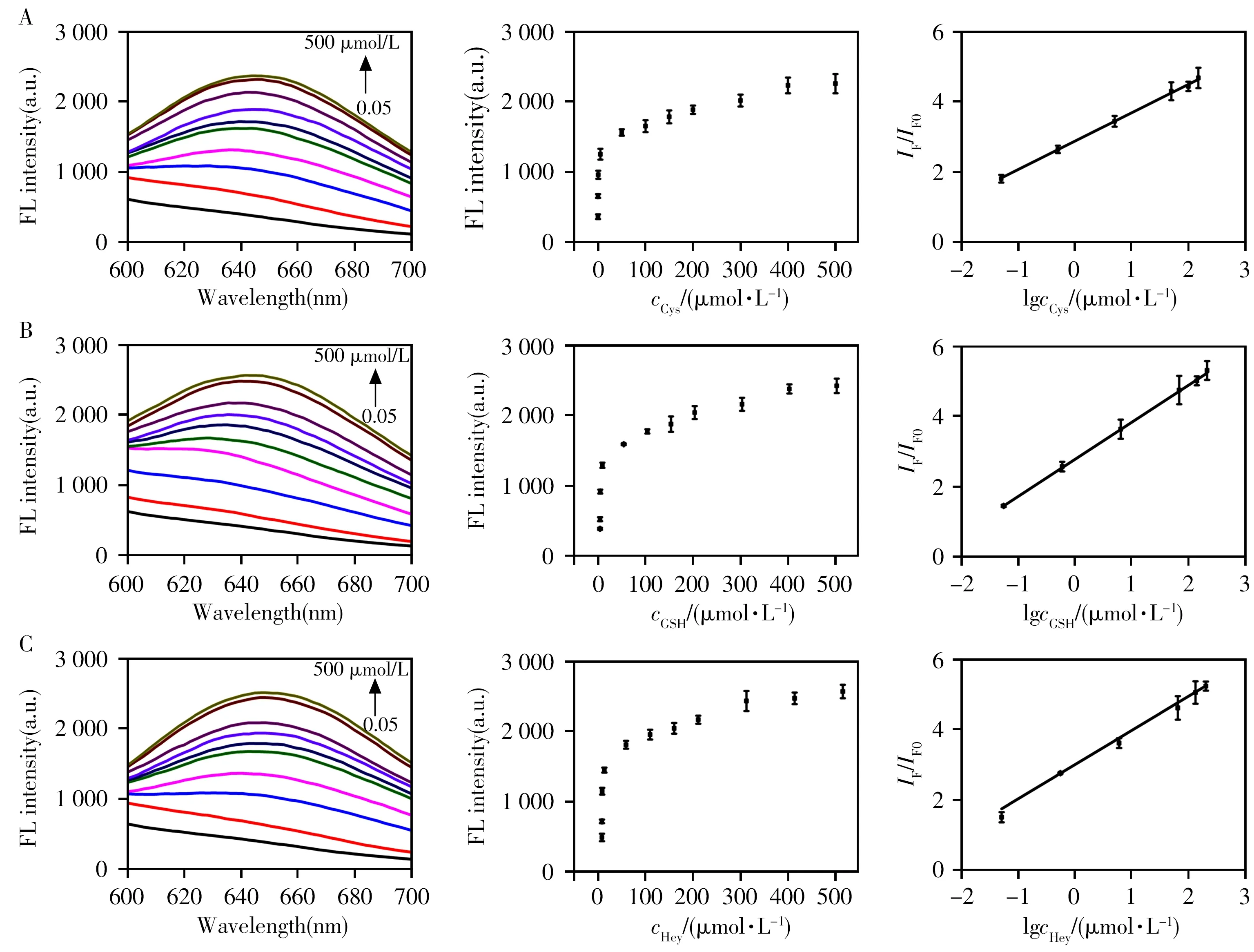
图4 BSA@AuNCs-CoOOH纳米探针与生物硫醇Cys(A)、GSH(B)和Hcy(C)反应的荧光响应及拟合曲线Fig.4 Fluorescence response and fitted curves of BSA@AuNCs-CoOOH nanoprobe in the presence of different concentrations of biothiols:Cys(A),GSH(B)and Hcy(C)left:fluorescence emission spectra;middle:plot of fluorescence peak intensities at 650 nm versus biothiols concentrations;right:linear plot of relative fluorescence intensity(IF/IF0)against logarithmic concentrations of added biothiols
2.4 BSA@AuNCs-CoOOH 纳米探针的传感性能
为了进一步评估本纳米探针对生物硫醇检测的特异性,选取氨基酸、金属离子和糖类化合物作为干扰物。如图5 所示,仅在加入生物硫醇时,探针的荧光信号得以恢复。结果表明,BSA@AuNCs-CoOOH纳米探针可用于选择性检测生物硫醇。
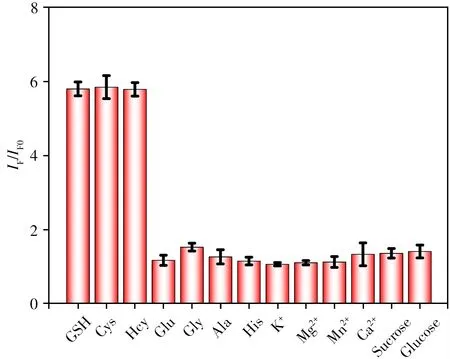
图5 BSA@AuNCs-CoOOH纳米探针对生物硫醇的选择性Fig.5 Selectivity of BSA@AuNCs-CoOOH nanoprobe toward biothiols
2.5 人血清样品中生物硫醇的测定
为了考察该方法的实际应用能力,对人血清样品中的生物硫醇含量进行检测。由于Cys 是人血清中大量存在的生物硫醇,因此选择Cys 作为分析对象[29]。检测结果如表1 所示,其回收率为96.0%~104%,相对偏差(RSD)为1.6%~3.7%。与经典的Ellman 方法所得结果一致,表明本方法可用于实际样品中生物硫醇的测定。
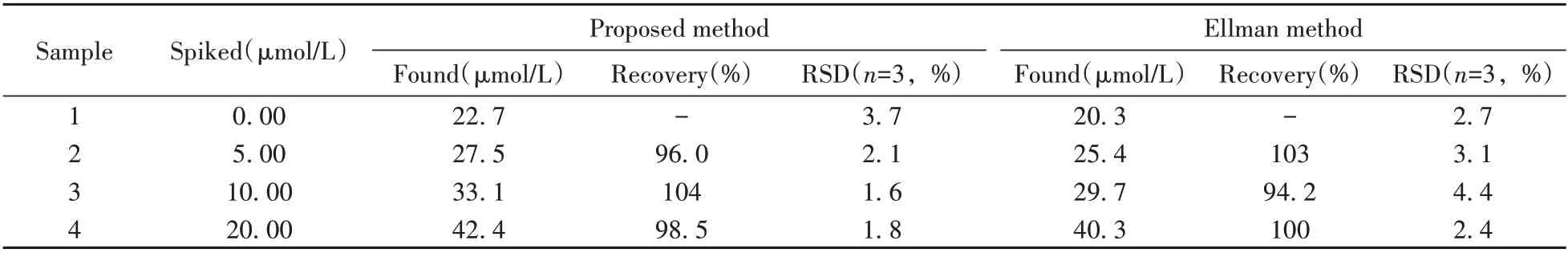
表1 BSA@AuNCs-CoOOH 纳米探针用于人血清样品中生物硫醇的检测Table 1 Detection of biothiols in human serum samples using BSA@AuNCs-CoOOH nanoprobe
3 结 论
本研究基于CoOOH 纳米片和BSA@AuNCs 构建了一种激活型荧光纳米探针,带负电的BSA@AuNCs 可通过静电作用组装到带正电荷的CoOOH 纳米片的表面形成纳米探针,BSA@AuNCs 的荧光信号由于IFE 被CoOOH 纳米片有效猝灭。基于纳米探针与生物硫醇之间的氧化还原反应,建立了一种简单、成本低、免标记、灵敏、选择性的荧光传感新方法用于生物硫醇检测,检出限约30 nmol/L。方法可用于人血清中生物硫醇的测定,有望为相关疾病的早期诊断和生物样品分析提供新的手段。

