基于适配体胶体金侧向层析试纸快速检测卡那霉素的方法研究
常 芮,蔡伊娜,王周平,彭池方*
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡214122;3.深圳海关食品检验检疫技术中心,广东 深圳 518045)
抗生素被广泛应用于现代医疗保健和畜牧业中,主要用于治疗细菌感染[1]。其中,卡那霉素是一种氨基糖苷类抗生素,由于其水溶性强、对许多革兰氏阴性菌和革兰氏阳性菌均有广谱抗菌作用,同时兼具价格便宜和用药方便等优点,被广泛应用于兽药和饲料添加剂[2]。然而,抗生素的过度使用会对人类健康和环境安全带来很大的问题。一般来说,抗生素的滥用会导致细菌耐药性的增加和其他副作用,如耳毒性、肾毒性等毒性作用,并对神经肌肉接头产生阻滞作用,引起过敏反应等,严重时致人死亡[3-4]。近年来,抗生素滥用已经成为全球范围内一个严重的公共卫生问题。对食品中的抗生素设置限量是食品安全管控的重要手段,如欧盟委员会明确规定牛奶中卡那霉素的最高残留量为150µg/kg[5]。目前常见食品中卡那霉素残留的检测方法有高效液相色谱法(HPLC)[6-7]、液相色谱-质谱法[8-9]等,但这些方法存在仪器昂贵、检测繁琐耗时和要求专业人员等限制因素,无法满足卡那霉素的现场检测要求。为了保障食品的质量和安全,有必要建立简单、快速的卡那霉素检测方法。
目前许多研究者采用免疫分析法[10-11]、荧光测定法和比色法[12-15]等技术实现了卡那霉素的快速检测。其中,侧流免疫层析分析试纸是最受人们关注的一种技术。它具有便携、易保存、操作简便、成本低等优点,特别适于即时检测和现场检测,在食品质量安全检测、环境检测以及医疗诊断等诸多方面均有很广泛的应用[16-17]。在侧流层析试纸条的检测方法中,最常用的检测模式是基于胶体金标记物的比色法。目前,侧流层析分析技术也被应用于抗生素的检测,但利用抗体识别进行检测的较多。由于抗体生产周期长、稳定性较差、成本高,使基于抗体的试纸条的应用受到限制。Song 等[18]利用亲和层析的SELEX 系统成功地筛选出高亲和力的卡那霉素及其衍生物的适配体。截止目前,仅有少数研究者将该适配体应用于试纸条实现卡那霉素的检测。例如,Ying 等[19]采用DNA 功能化的金纳米球(AuNPs-DNA)作为探针,采用磁性微球(MMS)快速分离卡那霉素适配体的互补链(cDNA),应用层析试纸检测cDNA,并将其转换为卡那霉素浓度,以此完成卡那霉素的高灵敏检测。因此,具有高亲和力、高特异性的卡那霉素适配体,为开发基于适配体的侧流层析技术检测卡那霉素提供了机会。
经典的核酸与金纳米粒子偶联方式是利用巯基修饰的核酸与纳米金粒子通过共价键相结合。然而,巯基化核酸与纳米金粒子的结合方式不能控制纳米粒子表面核酸的空间构象,其表面核酸杂交速率较慢。Wu 等[20]利用多聚腺苷(PolyA)作为核酸链的锚定块实现了与纳米金粒子的非共价结合。该方法可有效调节纳米金粒子表面核酸的构象和密度,并显著提高AuNPs-DNA 复合物与核酸链的杂交速率以及核酸检测的灵敏度。本文尝试将AuNPs@polyA-DNA 复合物作为探针应用于侧向层析试纸条,通过简化设计构建的胶体金试纸条即可实现快速、灵敏的卡那霉素检测。
1 实验部分
1.1 试剂与仪器
牛血清白蛋白(BSA,上海生工生物工程有限公司);氯金酸(HAuCl4)、柠檬酸三钠(Sigma-Aldrich);十二水合磷酸氢二钠、二水合磷酸二氢钠、磷酸三钠、蔗糖、吐温-20(国药集团化学试剂有限公司);上述试剂均为分析纯。链霉亲和素(SA,生物技术级别,活性:15 U/mg,上海生工生物工程有限公司);硫酸卡那霉素(USP 级别,效价:750µg/mg,上海生工生物工程有限公司);硝酸纤维素膜(NC,HF130)、玻璃纤维素膜(金标垫,VL78)、玻璃纤维素膜(样品垫,SB06)、吸水纸(SX27)、PVC胶板,均购于上海金标公司。实验用水均为18.2 MΩ·cm的Millipore超纯水。
QL-901 漩涡混匀器(江苏海门其林医用仪器厂);JEOL-2100 透射电镜(日本电子株式会式);ZJ-600 多通道胶体金读取仪(无锡中德伯尔生物技术有限公司;VS-100C 恒温混匀仪(无锡沃信仪器有限公司);pH计(梅特勒-托利多仪器上海有限公司);分析天平;高速冷冻离心机(上海力申科学仪器有限公司)。所有的寡核苷酸链(HPLC纯度)均由上海生工生物技术有限公司合成(见表1)。
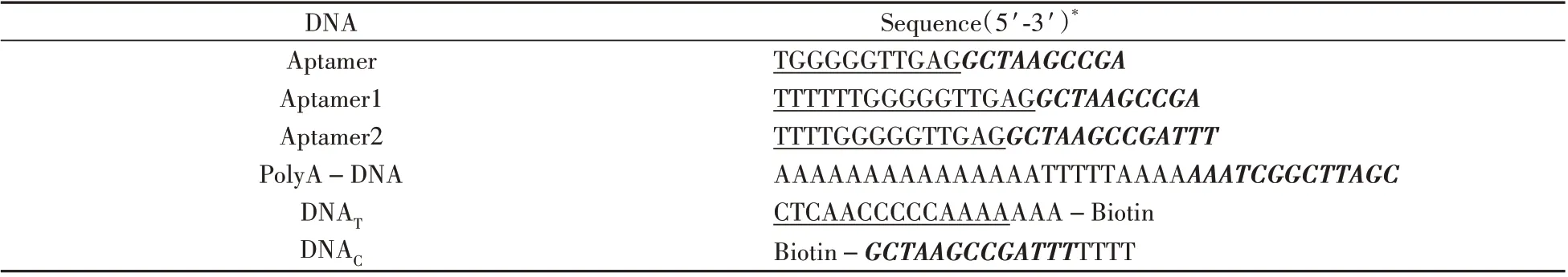
表1 卡那霉素适配体侧向层析试纸条所用的核酸序列Table1 Nucleic acid sequence for kanamycin aptamer lateral chromatographic strip
1.2 AuNPs的合成与功能化
AuNPs 的制备采用文献报道的柠檬酸钠还原法[20]:将100 mL 0.01%的HAuCl4加入250 mL 锥形瓶中,加热搅拌至溶液爆沸,保持1~2 min。随后,迅速加入2 mL 1%的柠檬酸三钠溶液,继续加热搅拌。溶液的颜色由浅黄色逐渐变为深紫色,最后变成酒红色,保持加热10 min,室温冷却,4 ℃冷藏备用。实验用于合成和储备纳米材料的玻璃器皿均用王水(盐酸∶硝酸=3∶1)浸泡12 h,用水洗涤干净后使用。
AuNPs 的功能化参考文献报道制备[21]:将5~15µL 100µmol/L 的polyA-DNA 加入1 mL 4 倍浓缩的柠檬酸三钠还原的纳米金(10 nmol/L)中混合均匀,然后加入20 µL 500 mmol/L 的柠檬酸缓冲液(pH 3.0)。混合均匀后,在室温下孵育30~60 min。孵育完成后,加入60 µL pH 7.6 的500 mmol/L HEPES 缓冲液,调整AuNPs 溶液的pH 至中性,室温下孵育2~4 h。以10 000 r/min 离心20 min,沉淀物加入重悬液(20 mmol/L Na3PO4,5%BSA,10%蔗糖,0.25%Tween-20)复溶,10 000 r/min 20 min 离心3次除去未反应的核酸,最终加入400µL重悬液,4 ℃冷藏备用。
1.3 SA-生物素-DNAT和SA-生物素-DNAC的制备
DNAT被用于固定在检测线(T zone)上用于捕获适配体进一步形成AuNPs-DNA-Apt-DNAT复合物,DNAC被固定在控制线(C zone)从而捕获AuNPs@polyA-DNA形成AuNPs@polyA-DNA-DNAC复合物。SA与DNAT、DNAC端部修饰的生物素具有较高的亲和力,因此,制备了SA-DNAT和SA-DNAC偶联物。100µL 2.5 mg/mL的SA与100µL 250µmol/L生物素化的DNAT和DNAC在4 ℃下孵育1 h,以完成SA 与Biotin-DNAT和Biotin-DNAC的结合。为除去游离的生物素化核酸,使用超滤管(MWCO 30 kDa)6 000 r/min 20 min离心3次,重悬于300µL 10 mmol/L PBS中,制备好的复合物储存于4 ℃。
1.4 侧向层析试纸条的组装
试纸条由样品垫、结合垫(金标垫)、硝酸纤维素膜、吸水垫和PVC 胶板组成。将样品垫和结合垫切成适当的尺寸,加入10 mmol/L PBS 浸泡30 min 后,在45 ℃下干燥。将之前制备的75 µL AuNPs@polyA-DNA 探针均匀地喷涂在结合垫上,37 ℃干燥2 h。用三维喷点仪器将30 µL 的SADNAT和SA-DNAC复合物均匀喷涂在NC 膜上,分别作为T 线区域和C 线区域,T 线和C 线之间的距离固定为5 mm。在NC 膜上喷涂T 线和C 线,37 ℃干燥12 h 后,将样品垫、结合垫、NC 膜、吸水垫按图1依次粘贴在PVC板上,将组装好的试纸条均匀切割为4 mm的宽度,放入分装带中,密封保存。
1.5 卡那霉素的检测
卡那霉素标准溶液用缓冲液分别稀释至终浓度为5、8、15、25、50、125、250 ng/mL,适配体用水稀释至1µmol/L。将99µL 不同浓度的卡那霉素标准溶液与1µL 适配体溶液混合孵育20 min,反应完成后将混合液加入到样品垫进行检测,反应3 min后测定相对信号强度(T/C)。
1.6 特异性分析
为评估制备的侧流层析试纸条的特异性,选用土霉素(TER)、硫酸庆大霉素(GEN)、阿卡米星(AMI)、阿泊拉霉素(APR)、卡那霉素(KAN)进行特异性验证。各种抗生素的质量浓度为100 ng/mL,其它检测条件均相同,测定并比较检测区域的颜色强度。
1.7 样品的加标回收实验
根据GB 31650-2019食品安全国家标准规定,动物源性食品中卡那霉素的添加量不得高于100µg/kg[12]。因此,选取接近最高检出限的3个浓度(50、125、250 ng/mL)验证试纸条对样品检测的可行性。将蜂蜜样本稀释10倍,用0.22µm微孔滤膜过滤。添加不同浓度的卡那霉素后,将1µL适配体(1µmol/L)与99µL预处理后的蜂蜜溶液混合,孵育20 min后,加样于上述试纸条检测卡那霉素。3 min后,测试试纸条的显色信号。
2 结果与讨论
2.1 AuNPs的表征
用传统的柠檬酸钠还原法合成AuNPs,并在试纸条中作为探针。用透射电子显微镜对制备的AuNPs 进行表征,显示AuNPs 的分散良好,粒径在15 nm 左右(图1A)。不同粒径的AuNPs 在可见光段具有特异的吸收光,本文制备的15 nm 的AuNPs 在520 nm 处有单一的特征吸收峰,当与polyA-DNA结合时,最大吸收波长红移至530 nm(图1B),初步证明polyA-DNA成功修饰了纳米金颗粒。
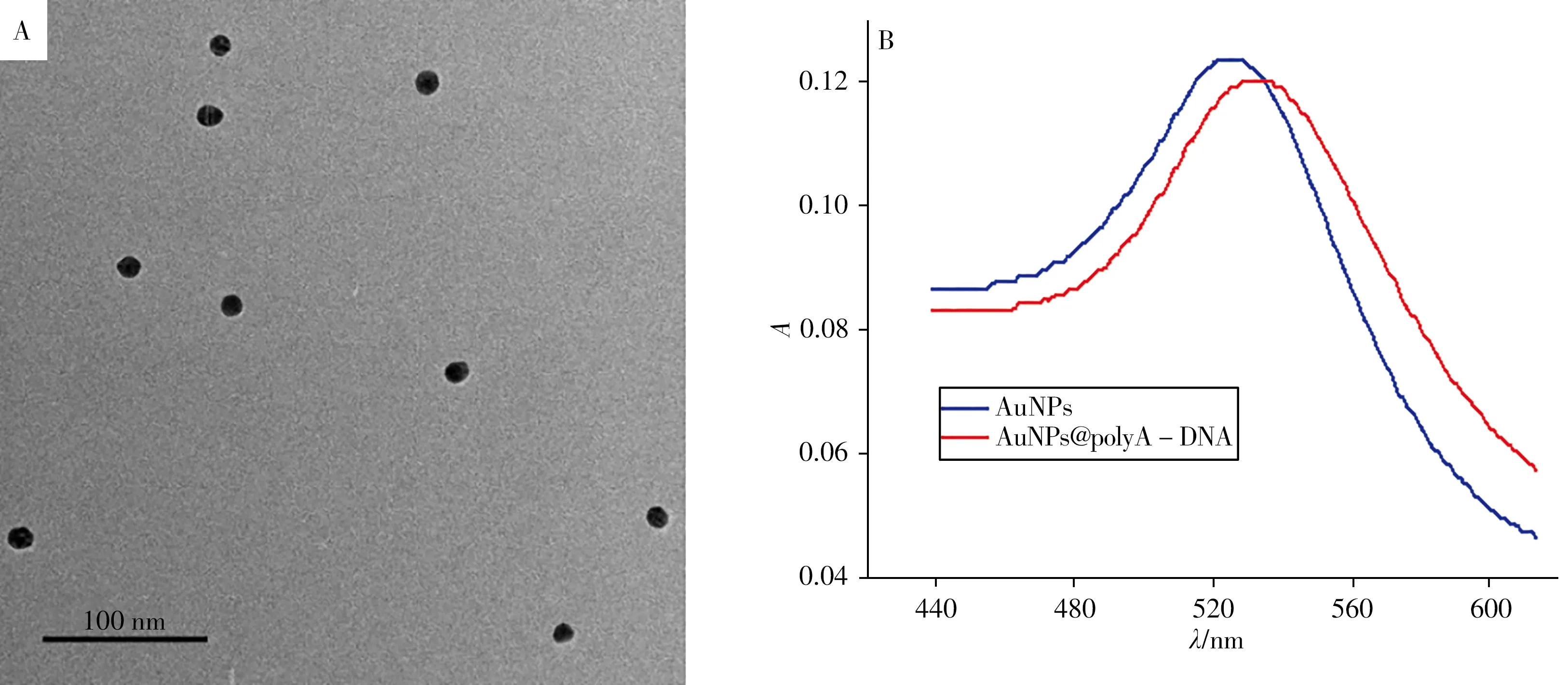
图1 AuNPs的TEM图(A)及紫外-可见吸收光谱图(B)Fig.1 TEM image(A)and UV-Vis absorption spectra(B)of AuNPs
2.2 卡那霉素适配体试纸条的设计
本试纸条的设计是基于核酸适配体链与卡那霉素结合后导致其与AuNPs@polyA-DNA 探针的结合能力下降或丧失此性质。如图2 所示,当样品溶液中不含卡那霉素时,卡那霉素的适配体与AuNPs@polyA-DNA探针结合,并在T线区域被DNAT捕获形成AuNPs-DNA-Aptamer-DNAT复合物。由于AuNPs 的富集,在T 线区域可以观察到清晰的红色条带。当样品溶液中含卡那霉素时,卡那霉素可与适配体结合。此时,样品溶液中的适配体不能与AuNPs@polyA-DNA 探针结合,从而在T 线区域难以捕获AuNPs@polyA-DNA,T 线较浅或不显色。此外,AuNPs@polyA-DNA 探针上含有一段可与C 线上核酸链序列DNAC互补的序列,无论AuNPs@polyA-DNA 探针是否与适配体链结合,都可使AuNPs@polyA-DNA探针在C线区域被DNAc捕获而呈红色。

图2 基于侧向层析试纸条检测卡那霉素的原理图Fig.2 Schematic illustration of kanamycin detection based on lateral chromatographic strip
2.3 检测参数的优化
系统地优化了试纸条制备过程中的实验条件,包括SA 与DNAT的比例、SA-Biotin-DNAT偶联物浓度、适配体浓度、孵育时间和温度,以实现在T 线和C 线区域呈现清晰的条带和对卡那霉素产生灵敏稳定的响应。上述实验以胶体金试纸定量分析仪测得的T线区域的光强度及变化为指标进行优化。
2.3.1 缓冲液的选择选择了3 种大分子,包括牛血清白蛋白(BSA)、酪蛋白(Casein)、吐温-20(Tween 20),作为缓冲液的封闭剂,比较了它们对显色结果的影响。由于封闭剂的浓度会影响溶液在试纸条上的流动,因此配制了4xSSC(0.1%Tween 20)、4xSSC(0.5%Tween 20)、4xSSC(1%Tween 20)以及不同浓度BSA和Casein共9种溶液,在核酸适配体试纸条上滴加60µL缓冲液,并比较试纸条的显色效果。结果如图3 所示,当选择的封闭剂为BSA 和Casein 时,在对照组的T 线上存在一定非特异性吸附,而选择Tween 20 为封闭剂时,对照组的T 线上未见非特异性吸附。此外,当Tween 20 的浓度大于0.5%时,检测组有明显的红色条带,且Tween 20的浓度增加,条带的颜色基本不变。因此本实验选择缓冲液为4xSSC(0.5%Tween 20)。
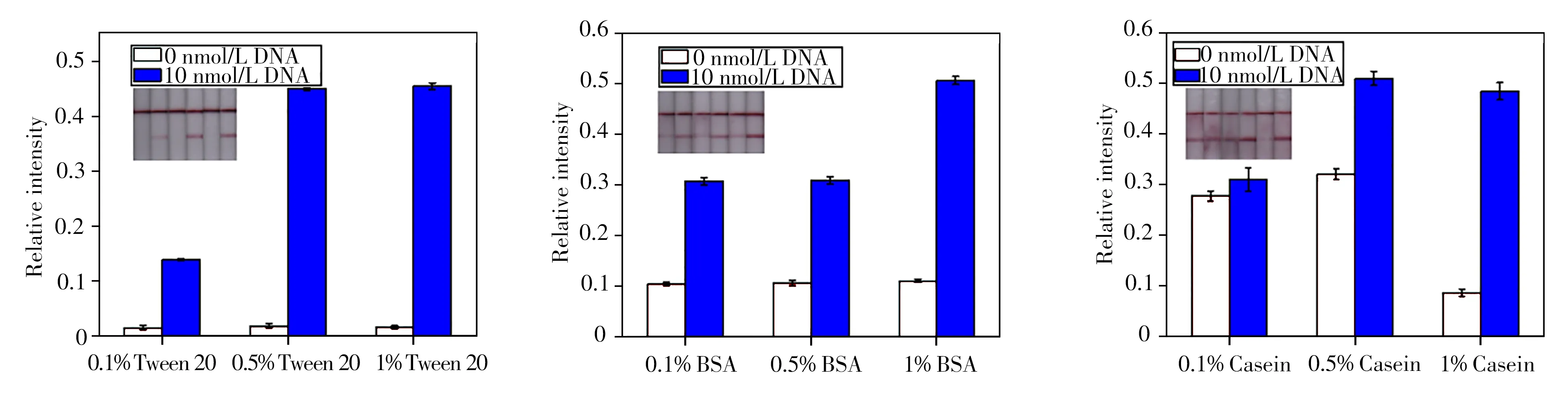
图3 不同Running buffer对试纸条显色的影响Fig.3 Effects of different running buffers on lateral flow strip coloration
2.3.2 SA与DNAT比例的影响SA 可静电吸附固定在NC 膜上,并通过与生物素的特异性结合将生物素修饰的核酸固定在NC 膜上。SA 与生物素修饰核酸的偶联不仅影响核酸在NC膜上的固定量,也影响核酸与探针的杂交效率。有研究报道SA 与生物素化核酸制备复合物所用的最优摩尔比为1∶6[20]。为获得最佳的显色效果,以SA的终浓度为3 µmol/L,考察了SA 与Biotin-DNAT的不同摩尔比(2∶1、1∶1、1∶3、1∶6、1∶9、1∶12)对试纸条T 线显色信号强度的影响。将所得的各种复合物分别喷涂在NC 膜上,组装成试纸条,并分别测试试纸条T 线区域的信号强度。结果如图4 所示,在1∶6 的比例下,条带的光信号强度达到最大值。因此,选择SA 与DNAT的最佳摩尔比为1∶6。

图4 SA与Biotin-DNAT的比例对试纸条T线信号强度的影响(n=3)Fig.4 Effect of streptavidin to Biotin-DNAT ratio on signal intensity of T line of lateral chromatographic strip(n=3)
2.3.3 SA-Biotin-DNAT偶联物浓度的影响在NC 膜的检测区域固定SA-Biotin-DNAT偶联物,通过DNAT与Aptamer 互补序列之间的杂交,捕获AuNPs@polyADNA-Aptamer 复合物。因此,在检测区上固定适当量的SA-Biotin-DNAT偶联物是确保AuNPs@polyA-DNAAptamer 复合物在检测区被捕获并获得清晰条带的关键因素。为了取得更好的显色效果,本实验分别将1~7µmol/L的SA-Biotin-DNAT偶联物喷涂检测区,测试试纸条T线区域的信号强度。结果如图5所示,随着偶联物浓度的增加,检测区的信号强度增强,当达到4 µmol/L 时,光强度达到最大,继续增大偶联物浓度,光强度基本保持稳定。因此,本实验选择4 µmol/L SA-Biotin-DNAT偶联物喷涂检测区。

图5 SA-Biotin-DNAT偶联物浓度对试纸条T线信号强度的影响Fig.5 Effect of streptavidin-Biotin-DNAT conjugate concentration on signal intensity of T line of lateral chromatographic strip
2.3.4 适配体浓度的影响将不同浓度Aptamer(1、5、10、15 nmol/L)与25 ng/mL 卡那霉素结合。结果如图6 所示,当Aptamer浓度较高(15 nmol/L)时,卡那霉素与其结合后,游离状态的Aptamer 存在较多,可与AuNPs@polyADNA和DNAT杂交,使得T线显色较深。当Aptamer浓度较低(1 nmol/L)时,即使不存在卡那霉素,T线的显色很弱。当Aptamer 的浓度为5 或10 nmol/L 时,即便无卡那霉素,试纸条T 线上的显色均比较清晰,而加入25 ng/mL 卡那霉素后,信号强度明显降低。其中,以10 nmol/L Aptamer对卡那霉素响应信号的变化值最大。因此,本实验采用Aptamer的最佳浓度为10 nmol/L。

图6 适配体浓度对卡那霉素检测的影响Fig.6 Effect of aptamer concentration on kanamycin detection
2.3.5 孵育时间与温度对卡那霉素检测的影响为确保卡那霉素与Aptamer完全结合,优化了体系的孵育时间和温度。结果显示,随着卡那霉素与适配体孵育时间的增加,检测区的信号强度增加。当孵育时间大于20 min时,试纸条的检测信号强度可保持稳定。因此,选择20 min 作为卡那霉素与适配体的孵育时间。此外,孵育温度在20 ℃~40 ℃之间变化时,试纸条的检测信号强度基本保持不变。因此,选用室温孵育即可。
2.4 适配体链的优化及试纸条的检测性能
在前述实验中,所选用的卡那霉素Aptamer 链有21个碱基,与AuNPs@polyA-DNA 和DNAT的互补碱基分别为10 个和11 个碱基,互补链之间的亲和力偏低;这可能使得杂交效率偏低,从而导致所需适配体的浓度偏高,并影响卡那霉素的检测。适当的增加Aptamer 链与AuNPs@polyA-DNA 和DNAT的互补碱基数,有助于提高杂交效率并可能改善对卡那霉素的检测。因此,本实验在Aptamer链的末端适当增加了碱基数。其中Aptamer 1为在Aptamer 链5′端增加了5 个碱基,Aptamer 2 为Aptamer 链5′端和3′端各增加了3 个碱基。Aptamer、Aptamer 1和Aptamer 2浓度分别为20、20、10 nmol/L时,测试了试纸条对0~250 ng/mL 范围内卡那霉素的响应。结果显示,3 种适配体链均呈现较好的线性和较高的灵敏度。当选用Aptamer 2时,肉眼可分辨25 ng/mL卡那霉素显著抑制了T 线区域的显色,试纸条对卡那霉素的线性范围为5.0~125 ng/mL(r2= 0.99),检出限(LOD,S/N= 3)为1.5 ng/mL(见图7);而选用Aptamer 和Aptamer 1 时,肉眼可分辨卡那霉素浓度为125 ng/mL,其检出限分别为7.5 ng/mL和4.0 ng/mL。因此,Aptamer 2 链在此试纸条中的检测效果更优。与近年已报道的侧向层析试纸进行比较[19,22-23,25-28](见表1),本方法的检测灵敏度超过典型的荧光检测方法[23-24]和基于辣根过氧化物酶催化信号放大的电化学检测方法[27]。尽管灵敏度低于银纳米粒子信号放大的侧向层析试纸[28],但与磁性纳米富集信号放大的试纸相当[19]。本文所建立的侧向层析试纸无需信号放大步骤,具有操作简单、检测速度快、灵敏度高等优点。

表1 几种卡那霉素检测方法的比较Table 1 Comparison of several methods for kanamycin detection based on nanoparticles
2.5 特异性分析
选用质量浓度均为100 ng/mL 的TER、GEN、AMI、APR、KAN 进行特异性验证。结果显示,只有卡那霉素才会在T 线区域出现明显的显色抑制。测试其他几种常见抗生素的检测信号,结果显示其交叉反应率均小于0.4%,表明无明显交叉反应。因此,该侧流层析试纸条传感器具有很高的特异性。
2.6 加标回收实验
为了验证该侧向层析试纸的实际应用性能,将上述试纸条应用于添加卡那霉素(25、50、250 ng/mL)蜂蜜样本的测试,所得回收率为95.1%~105%,相对标准偏差(RSD)为3.4%~8.5%。结果表明,该侧向层析试纸条应用于实际样品中卡那霉素的检测具有较高的准确性和可靠性。
3 结 论
本文采用AuNPs@polyA-DNA 作为探针,构建了一种简单、灵敏和低成本的卡那霉素适配体侧向层析试纸条。相比常见的巯基化核酸探针,本纳米探针不仅成本显著降低,且能与互补核酸链快速杂交,并在试纸条上完成显色。通过优化互补链(卡那霉素核酸适配体)的序列提高T 线区域的核酸链杂交效率,可将试纸条肉眼分辨和定量分析卡那霉素的灵敏度提高5倍。测得卡那霉素的线性范围为5~125 ng/mL,检出限为1.5 ng/mL。方法具有高灵敏、高特异性、高重复性和架构简单等优点。本文的设计策略主要基于提高检测区上胶体金核酸探针的杂交速度和效率,包括胶体金探针表面核酸密度和核酸链的亲和力,研究结果显示,上述因素对试纸条的检测灵敏度和稳定性具有非常关键的影响。因此,进一步探索如何提高各类核酸纳米探针在侧向层析试纸条的杂交速度和效率,有望开发出更敏感、更稳定的适配体传感检测方法。

