南荻MlNAC2基因差异表达与耐盐生理响应的相关性分析
万 婷, 段钧译, 李 蒙, 陈智勇
(1.湖南农业大学, 湖南 长沙 410128; 2.芒属植物生态应用技术湖南省工程实验室, 湖南 长沙410128;3.国家能源非粮生物质原料研发中心湖南分中心, 湖南 长沙 410128; 4.湖南省蚕桑科学研究所, 湖南 长沙410127)
芒属植物(Miscanthusspp.)为禾本科(Poaceae)C4作物,俗称芒草,全世界共有约14个种,其中芒(M.sinensis)、五节芒(M.floridulus)、荻(M.sacchariflorus)和南荻(M.lutarioriparius)是最具开发潜力的4个种。南荻是我国特有种,具有光合效率高、生物质产量大、抗逆性强、对生态环境友好、生产成本低等优点[1],一次种植可长期收获[2],在作为生物炼制原料、生物能源、生态修复和固碳减排方面均具有重要作用[3]。中国盐碱地总面积3.6×106公顷,滨海盐碱土面积1×106公顷[4],在滨海滩涂及盐碱地种植芒草等新型作物,不仅可以改良土壤和防止荒漠化,同时还能满足社会对材料、能源和环境的需求。因此,培育生物产量高且耐盐的新种质是芒属植物育种研究的重点,而发掘耐盐基因则是其中的关键。
当植物生长在盐渍化土地上时,自身可以感知到盐渍化胁迫信号,然后通过渗透胁迫,激素类信号调节以及离子胁迫等[5]不同的信号转导途径把信号传递给相关的转录因子,通过转录因子发挥作用,相关基因开始表达,获得一系列表达产物,以此来降低盐渍化带来的危害,提高植物自身的存活率[6]。NAC(NAM,ATAF and CUC2)就是其中一种转录因子,其命名取自矮牵牛(Petuniahybrida)的NAM(No apical meristem)基因、拟南芥(Arabidopsisthaliana)的ATAF1/2(Arabidopsis transcription activation factor)基因和CUC2 (Cup-shaped cotyledon)基因的首字母[7],它是近年来发现的具有多种功能的转录因子[8],在植物生长发育过程以及逆境中发挥作用,是植物里最大的转录因子家族之一[9]。NAC家族成员很多,发挥的作用也很广泛,为植物在逆境下的生存提供了巨大的帮助[10]。NAC转录因子C端具有高度变异的转录调控区,它的特点是重复出现一些简单的氨基酸,如脯氨酸、谷氨酸、苏氨酸、丝氨酸,主要作用是转录激活或阻遏[11]。本课题组前期研究中,克隆了南荻的MlNAC2基因,并对其表达模式和特性、基因功能进行了初步研究,发现南荻中的MlNAC2基因在叶片和叶鞘中表达量较高,并且能够响应高盐、干旱、低温的胁迫,MlNAC2在拟南芥中的过表达提高了拟南芥的抗旱性[12]。但盐胁迫下MlNAC2基因的表达会引发植物体哪些生理响应却并不清楚。基于此,以南荻多倍体为试验材料,对盐胁迫下MlNAC2基因差异表达与耐盐生理指标的相关性进行了分析,为耐盐种质的挖掘和高效利用奠定基础。
1 材料与方法
1.1 试验材料
南荻三倍体材料L1~L10,由课题组前期培育,种植于湖南农业大学芒属植物资源圃(28°11′N,113°04′E);母本P1,采自江苏南京(32°04′N,118°50′E);奇岗G为北京市农林科学院草业与环境研究发展中心(39°56′N,116°16′E)范希峰博士所赠;P1和G现保存于湖南农业大学芒属植物资源圃。
1.2 试验设计
参考陈静波等[13]的方法,取南荻的地下根状茎在炼苗室培养。地下茎发芽后,将其种植于底部带孔(4个直径4 mm的小孔)的塑料钵(约0.6 L)中,用洗净的河沙作为基质,每个基因型种植40钵,每钵1~2株苗,然后置于育苗盘(54 cm×28 cm×6 cm)上,每个育苗盘内装1/2 Hoagland’s营养液[14]3 L。培养温度25℃,光照时间8 h。待试验材料长至20 cm时,在距沙面5 cm处将其打顶处理,1个月后不同基因型材料各选择24钵长势均一的植株进行NaCl胁迫,NaCl浓度为0,0.2%,0.5%和0.8%,每个处理6个重复。在盐胁迫的第6天开始测量MlNAC2基因相对表达量,4天为一周期。测量4次,到第3次时各试验材料单株的叶片出现不同程度的发黄萎蔫现象,并且有单株大量死亡,因此,选择MlNAC2基因相对表达量变化最显著的第2次测量结果分析其与当天生理指标的相关性。
1.3 材料存活率测定
材料叶片萎蔫至整株叶片总数90%以上,难以在该浓度NaCl胁迫下继续生长,即判断其死亡。存活率=存活株数/总株数×100%。
1.4 MlNAC2基因的表达量测定
使用实时荧光定量PCR法[15]。引物设计与合成:在GenBank上获取目的基因mRNA的全序列(NCBI:KM017002),选定内参基因为核糖体18S基因[16],用Primer 5.0设计引物的序列,获得引物如表1所示。

表1 荧光定量PCR所用引物
PCR反应体系为:上下游引物各0.5 ul(20 pmol·μL-1),cDNA1 uL,PCR反应mix12.5 uL,用双蒸水定容至25 uL。PCR的扩增程序为:94℃预变性2 min,94℃变性30 s,60℃退火30 s,72℃延伸30 s,72℃延伸10 min,35个循环。用7500荧光定量PCR仪来选择熔解曲线的程序。通过仪器的分析软件来获取熔解曲线,待程序结束后进行分析。基因相对表达量采用2-ΔΔCT计算,其中ΔΔCT = CT待测样本(目的基因-内参基因)— CT校准样本(目的基因—内参基因)。本试验中基因表达量与对照相比差别在3倍以上时才认定为有明显差异。
1.5 相关生理指标测定
采用丙酮乙醇混合浸提法[17]测定叶绿素含量;使用便携式光合速率仪(Li-6400)测定被试材料的净光合速率和气孔导度,光合速率仪使用的固定的红蓝光源的光量子密度为1 200 μmol·m-2·s-1[18];采用硫代巴比妥酸法[19]测定丙二醛含量;茚三酮显色法[20]测定脯氨酸含量;氮蓝四唑光还原法[21]测定超氧化物歧化酶含量。
1.6 数据统计方法
采用Excel进行图表绘制,SPSS 22 进行ANOVA检测。
2 结果与分析
2.1 NaCl胁迫下试验材料的存活率
各试验材料NaCl胁迫18天后的存活率如表2[22]:

表2 各试验材料在不同浓度NaCl胁迫下存活率[22]
2.2 NaCl胁迫下MlNAC2基因表达量
由图1A可知:在NaCl胁迫开始的第6天,仅L3,L7,L9的相对表达量出现3倍以上变化,其他材料的相对表达量均在3倍以内。第10天的MlNAC2基因相对表达量如图1B,材料L6,L7,L9和P1的MlNAC2基因表达量整体出现大幅度上调,上调量多在3倍以上;L6在0.5%,0.8%NaCl胁迫下,L9在0.2%,0.5%,0.8%NaCl胁迫下的表达量上调了10倍以上。胁迫第14天,L4,L5开始出现单株大量死亡,故这两种基因型数据不进行统计。其他材料的MlNAC2基因相对表达量如图1C所示,差异不如第10天显著,但L6,L9响应仍较其他材料积极。胁迫到第18天,如图1D所示,L2在0.8%,L3在0.2%,0.5%,L9在0.2%,0.5%,0.8%,P1在0.5%,0.8%,G在0.2%的NaCl胁迫下上调了3倍以上的表达量。4次测量中,L2,L6,L9,P1的MlNAC2基因响应较积极,出现了较对照提高10倍以上的表达量;而其它材料L1,L5,L8,L10无明显差异,变化量都在3倍以内。

图1 试验材料在不同浓度NaCl胁迫下的MlNAC2基因表达量
2.3 NaCl胁迫下各试验材料生理响应
2.3.1叶绿素含量 从图2中可以看出,L4,L5,L10的叶绿素含量在无胁迫时偏低;与之相反,L3,L7,P1的叶绿素含量无胁迫时在所有材料中最高;不同试验材料之间的叶绿素含量差异较大,L3是L5的7.91倍。在不同浓度的盐胁迫下,叶绿素含量的变化出现不同情况,材料L6,L9,P1在各浓度胁迫下叶绿素含量均高于对照,L1,L3,L4均低于对照。在0.2%胁迫下,材料L6,L8,L9,P1显著增加了叶绿素含量;在0.8%胁迫下,叶绿素含量最高的材料为L6,L7,L8,L9,分别为2.942,2.852,2.814和2.753 mg·g-1。材料L2,L4,P1的叶绿素含量随着盐胁迫浓度的增加逐渐降低。各试验材料的叶绿素含量在不同浓度之间差异显著(P<0.05)。

图2 试验材料在不同浓度NaCl胁迫下的叶绿素含量
2.3.2净光合速率 图3显示,NaCl胁迫的第10天,0.2%NaCl胁迫下,材料L2,L4,L5的净光合速率与对照相比有不同程度的增加,而其他材料的净光合速率都降低了。除L6,L10,其他试验材料在0.8%NaCl处理下的净光合速率较对照均有不同程度增加。材料L1,L2,L4,L5,L9和G在0.8% NaCl胁迫下净光合速率的值最高,材料L3,L7,L8,L10和P1净光合速率的最高值出现在NaCl浓度为0.5%时。各试验材料的净光合速率在不同浓度之间差异显著(P<0.05)。

图3 试验材料在不同浓度NaCl胁迫下的净光合速率
2.3.3气孔导度 由图4可知,试验进行到第10天,各试验材料在0.8% NaCl胁迫下气孔导度多数出现大幅度升高。材料L1~L5,L9,G最大值出现在0.8%NaCl胁迫下,L6,L7,L8,P1的最大值出现在0.5%NaCl胁迫下,而L10的气孔导度在各浓度的胁迫下均较对照低。各试验材料的气孔导度在不同浓度之间差异显著(P<0.05)。

图4 试验材料在不同浓度NaCl胁迫下的气孔导度
2.3.4丙二醛含量 由图5可知,试验第10天,各浓度NaCl胁迫下,材料L3,L8,G的丙二醛含量与对照相比无显著差异,L7则比对照要低。其他材料丙二醛含量与对照相比多有显著增加,L2,L6最高值出现在0.2%NaCl胁迫下,L10最高值出现在0.5%NaCl胁迫下,L1,L4,L5,L9,P1最高值出现在0.8%NaCl胁迫下。

图5 试验材料在不同浓度NaCl胁迫下的丙二醛含量
2.3.5脯氨酸含量 NaCl胁迫的第10天,脯氨酸含量多数都有不同程度的升高(图6),L2,L3,L4,L7,L9的最高值出现在0.8%NaCl胁迫下,其中L2,L3,L7较对照增加了20倍以上;材料L1和G的最高值出现在0.5%NaCl胁迫下;材料L5,L6,L8,L10和P1的最高值出现在0.2%NaCl胁迫下,其中,L6在0.5%NaCl胁迫下脯氨酸含量较对照出现显著降低。各试验材料的脯氨酸含量在不同浓度之间差异显著(P<0.05)。
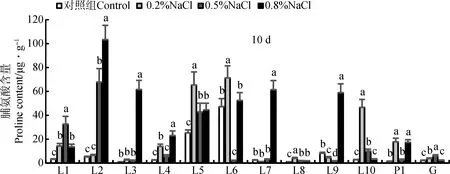
图6 试验材料在不同浓度NaCl胁迫下的脯氨酸含量
2.3.6超氧化物歧化酶活性 由图7可知,试验第10天,L3,P1的最高值出现在0.8%NaCl胁迫下;L2,L5,L6,L9的最高值出现在0.5%NaCl胁迫下,其中L5的超氧化物歧化酶活性在0.2%,0.8%NaCl胁迫下较对照出现大幅降低;L1,L7,L8,L10的值在0.2%NaCl胁迫下最高,但L7在不同浓度之间差异均不显著;而L4,G的值在无胁迫条件下最高,盐胁迫下出现小幅降低。

图7 试验材料在不同浓度NaCl胁迫下的超氧化物歧化酶活性
2.4 NaCl胁迫下不同试验材料MlNAC2基因差异表达与不同生理响应的相关性
从表3可得,NaCl胁迫的第10天,L6,L8,L9和G的净光合速率和气孔导度均与MlNAC2基因表达量相关,材料L6,L9和P1的叶绿素含量与MlNAC2基因表达量显著相关,材料L8和L9的丙二醛含量与MlNAC2基因表达量相关,材料L9和P1的脯氨酸含量与MlNAC2基因表达量极显著相关;其中L9的各生理响应中除了超氧化物歧化酶活性之外,其他生理响应均与其MlNAC2基因表达量显著或极显著相关。

表3 NaCl胁迫第10天时各试验材料MlNAC2基因与各生理响应之间的相关关系
3 讨论
3.1 盐胁迫下各试验材料MlNAC2基因的表达
转录因子的瞬时表达与胁迫时长、植株的瞬时的生理活动均有复杂的关系,且往往不会单一调控某个通路,而是与其他调控通路联合作用。吉璐[23]的研究表明,南荻叶片中MlNAC2基因可响应多种胁迫,并且受盐胁迫和MeJA的强烈诱导,该基因很可能在逆境胁迫中发挥重要作用,并参与了多种调控。本试验在4次测量中,不同基因型材料MlNAC2基因表达量变化程度不一,但多数较对照有明显增加。盐胁迫第10天时基因型L9在0.8%NaCl胁迫下MlNAC2基因表达量超过对照27倍,且在4次测量中一直处于上调状态,与此同时L9的各个生理响应指标都较积极;而基因型L8的MlNAC2基因的表达量在盐胁迫下没有显著上调,L8的各个生理指标相应也较稳定。本课题组前期研究结果表明,在盐胁迫下,L8对Ca2+,Mg2+的吸收能力明显高于其他材料[22]。由此推测,L8可能通过其他调控离子吸收能力的基因表达上调来响应盐胁迫。
3.2 盐胁迫下各试验材料的生理响应
光合作用是植物生长获取能量的重要方式,叶绿素是植物进行光合作用的重要物质[24]。因此,叶片中叶绿素含量及其变化一定程度上可以反映盐胁迫下植物维持光合作用的能力。本试验中,L4,L5在无胁迫的条件下本身的叶绿素含量与其他材料相比就比较低,其存活率在所有试验材料中也是最低的;并且随着盐胁迫浓度的增加,存活率较低的材料L2,L4叶绿素含量呈连续显著降低的趋势,这与张景云等[25]对马铃薯的耐盐性研究结论一致。在胁迫初期,植物会促进自身叶绿素的合成以适应盐胁迫环境[26]。本试验中在低盐胁迫下,存活率较高的材料L6,L8,L9,P1与对照相比均显著增加了叶绿素含量以提高盐胁迫能力;并且在高盐胁迫下,这几个材料的叶绿素含量仍然能够保持较高水平。
低盐胁迫下,试验材料净光合速率大都有所降低,表明低盐胁迫下南荻可通过降低光合效率以耐受盐胁迫;但材料L2,L4,L5低盐胁迫下净光合速率较对照有不同程度增加,并且这3个基因型对照植株的净光合速率较其它材料低,这可能是这3个基因型对照植株的叶绿素含量偏低,导致低盐胁迫下就开始提高光合效率以耐受盐胁迫。本试验中叶绿素含量与净光合速率出现不一致的情况,这可能是由于部分植株抵抗盐胁迫消耗了大量能量导致呼吸作用增加,净光合速率较对照降低。有研究表明[27],中国特有品种南荻的耐旱能力高于芒和五节芒,主要归因于其较高的光合速率与水分利用效率。在本试验中,南荻各试验材料在中高度盐胁迫下也同样能保持较高的净光合速率。在高盐胁迫下,各材料的净光合速率较对照大都会有不同程度的升高,并且与气孔导度的变化呈正相关,表明此时南荻净光合速率的胁迫效应很大程度上来源于气孔因素限制;并且在高盐胁迫下,南荻仍可以有效调节和维持自身气孔导度,维持其光合系统的活性以耐受高盐胁迫,这与宗俊勤等[28]的研究一致。
丙二醛含量作为衡量脂类物质过氧化水平的指标,可以反映生物膜脂过氧化强弱和细胞膜破坏程度,目前已被广泛用作胁迫条件下生物膜受活性氧(Reactive oxygen species,ROS)氧化损伤的标志物[29]。本试验中,多数试验材料在NaCl胁迫下丙二醛含量较对照组有不同程度的提高,丙二醛含量最高的三个材料L1,L4,L5均是在高浓度胁迫下丙二醛含量出现急剧增加,说明此时这些材料开始出现了生物膜的响应和损伤;而存活率较高的材料L7,L8等的丙二醛含量在各个浓度的NaCl胁迫下与对照相比无显著差异,说明此时试验材料细胞膜结构并未受到严重的损伤,这与宋倩云[29]的研究一致。
Kanawapee等[30]对106个水稻品种的耐盐性研究结果表明,在长期的盐胁迫条件下脯氨酸的积累量与水稻的耐盐性及存活率之间呈负相关。这些结果表明,脯氨酸积累仅仅是植物受到胁迫时的应答反应,而与耐逆性无关[31]。本试验中存活率最高的材料L8在各个浓度的盐胁迫下都能保持较稳定的脯氨酸含量,而存活率较低的材料L2在中高度盐胁迫下细胞内脯氨酸含量急剧增加,说明细胞受到的胁迫加重,这与前人研究一致。并且试验中0.8% NaCl胁迫下多数材料的脯氨酸含量有大幅升高,这可能是由于0.8% NaCl胁迫引起了南荻细胞的渗透胁迫,南荻通过将液泡中储存的脯氨酸运输到胞质中使细胞中脯氨酸急剧增加来抵抗高盐环境[32]。个别材料如L6的脯氨酸含量在0.5%NaCl胁迫时出现偏差,这可能是由于该浓度下L6的根部加强了离子吸收能力以抵抗盐胁迫,所以并未导致叶片中脯氨酸含量的急剧升高,这与段钧译等[22]的前期研究一致。
超氧化物歧化酶(Superoxide dismutase,SOD)是植物盐胁迫下主要的抗氧化物酶之一,在清除超氧离子、抵御膜脂的过氧化、减轻质膜受损等方面起着重要作用[33]。在本试验中,NaCl浓度为0.8%时,材料P1和L3的SOD活性达到最高,说明高盐胁迫下,这2个材料的抗氧化酶活性仍能保持较高水平,并且这2个材料的存活率也较高。这与李会云等[34]对高盐胁迫下葡萄砧木耐盐性的研究结果一致。植物细胞在盐胁迫下所能忍受的活性氧水平存在一个阈值,在阈值内,植物能够通过提高抗氧化酶活性来清除活性氧自由基,当超过这个阈值时,抗氧化酶活性便会受到抑制,活性氧过多积累,对植物组织造成伤害[35]。本试验中材料L5的SOD活性在0.2%和0.8%NaCl胁迫下发生了大幅降低,这可能是由于活性氧的积累超过阈值,抗氧化酶活性受到抑制。
3.3 盐胁迫下试验材料的MlNAC2基因表达量与生理响应的相关性
系统进化树分析表明:MlNAC2与SbNAC1,ZmNAC1和SNAC1的亲缘关系都较近[15]。过表达水稻胁迫响应基因SNAC1可以明显提高转基因水稻的抗旱性和耐盐性,与对照相比,转基因水稻对脱落酸更敏感,气孔闭合较多,失水较慢,但光合作用速率无显著差异[36]。过表达玉米ZmSNAC1基因的耐旱、耐盐性鉴定表明,转基因株系在干旱胁迫下较野生型存活率提高了50%~52%,叶绿素含量提高了36%~47%,脯氨酸含量提高了17%~23%;转基因株系在盐胁迫下较野生型存活率提高了36%~40%;过表达ZmSNAC1显著提高了转基因株系的耐旱和耐盐性[37]。将高梁抗旱基因SbNAC1转入玉米,在干旱处理下,转基因株系存活率和叶片相对含水量较对照显著提高,失水速率和气孔导度显著小于对照,并且转基因株系叶片中ABA和H2O2含量显著提高,气孔关闭率明显高于对照。正是这些生理指标的改变提高了转基因玉米的抗旱性[38]。在本试验测定的生理指标中,净光合速率、气孔导度和叶绿素含量这些与光合作用相关联的生理响应与MlNAC2基因的表达较为相关。并且存活率高的材料L8和L9的MlNAC2基因表达量变化与光合因子多呈显著或极显著相关;而存活率低的材料如L4和L5的MlNAC2基因的表达量变化与各生理指标多不相关。吉璐等[21]的前期研究表明:盐胁迫12 h后,南荻叶片中MlNAC2基因上调了约350倍;MeJA激素诱导12 h后,MlNAC2基因上调了136倍,其它激素处理均有不同程度的上调;在根中的表达量变化相对叶片中不明显;过表达MlNAC2基因的拟南芥抗旱性有所提高。大量研究证明,MeJA可通过影响气孔行为、调控蒸腾和叶绿素含量来调节植物对胁迫的反应[39]。由此推测,MlNAC2基因可能协同参与了植物激素的调控过程,间接通过调控植物的光合作用,气孔运动、叶绿素发生等来提高植物在盐和干旱胁迫下的生存能力。
4 结论
南荻不同基因型材料的MlNAC2基因对盐胁迫的响应程度差异较大;叶绿素含量高的材料较叶绿素含量低的材料有更强的耐盐性;净光合速率和气孔导度在中高度盐胁迫下大都有积极的响应;存活率较高,耐盐性强的材料叶片中丙二醛含量、脯氨酸含量及超氧化物歧化酶的含量更趋于保持稳定。所测生理指标中与MlNAC2基因表达量最相关的为叶绿素含量、气孔导度和净光合速率一系列光合作用相关因子。本研究结果丰富了南荻多倍体群体耐盐生理响应及其与分子机理层面的相互联系,为进一步研究南荻多倍体的耐盐性提供了借鉴。

