肠道菌群与人类健康研究进展
潘 杰 刘来浩 牟建伟
( 山东师范大学生命科学学院,250014,济南 )
1 引 言
人体与其肠道菌群之间构成一个复杂、互作和动态平衡的生态系统.肠道菌群受众多内外因素的影响,其多样化微生态对于人体消化吸收代谢营养物质以及神经、免疫等众多系统的生理功能不可或缺.肠道菌群失调与人类疾病的发生发展密切相关.明确肠道菌群微生态的建立、影响因素及其与人体健康的内在关联分子机制,从而维持健康的肠道菌群多样性,对于人类健康、长寿至关重要.近年来国内外学者开展了卓有成效、有针对性的基础和临床研究工作,肠道菌群与人宿主间更多的关联现象不断被发现.然而,肠道菌群之间、菌群与人类宿主之间复杂的分子互作机制依旧不甚明了,仍需要开展更多详细和深入的大规模基础与应用研究.温故才能知新,活学活用才能有利于相关工作的深入展开.
2 何为肠道菌群
顾名思义,肠道菌群是指寄居在宿主小肠和大肠中的微生物群.无论长期定植或短暂过路,健康人群的口、咽、食管、胃脏、小肠以及大肠这些与体外相连的消化道黏膜表面和管腔中,均栖居着数百上千种、数量巨大的微生物群.成人肠道表面积约为200~400 m2,是微生物进出、定植与共生的上佳栖息地.根据肠道菌群在肠道中分布的特点,将其分为肠道黏液(内外)层菌群和肠腔内(非黏液层)菌群两部分.肠道菌群主要由占比99%的细菌以及少量的古细菌/古生菌、真菌、病毒和原生生物组成;代表细菌有双歧杆菌、乳酸菌、厚壁菌、拟杆菌、放线菌和变形杆菌属等;成人肠道菌群总数约为30余万亿,略多于人体细胞总数[1],肠道菌群总重量约1~2 kg.基于肠道内环境特点,成人肠道菌群中严格厌氧菌的数量远多于兼性厌氧菌和需氧菌/好氧菌.菌群间、菌群与宿主间相互依存、相互作用,构成三者间动态平衡命运共同体.那么,体外微生物是如何跑到人肠道中定植并与宿主互作的呢?
3 肠道菌群的定植及其多样性形成
俗话说“病从口入”.人体肠道菌群也是主要经宿主口、鼻被“吃”进体内的[2].在新生命开始的最初数年里,其肠道菌群经历了从无到有,从定植、演替更换,到丰度和多样性增加,并最终建立相对恒定、各菌群有适当丰度和比例的α多样性菌群结构的演变过程.黏附是微生物定植于肠黏膜发挥生理作用的基础,包括特异性和非特异性黏附两种方式.研究显示,人体肠道菌群最早出现于孕中期的胎儿[3-5],丰度和多样性增加于新生儿期[6, 7],菌群的α和β多样性形成并稳定于幼儿期[8, 9].所谓肠道菌群α多样性是指同一宿主个体内肠道菌群的多样性;而β多样性是指个体之间菌群组成的特性.根据肠道菌群从出现到多样性增加、稳定建立和动态变化的发展特点,我们将该过程分为始现期(胎儿至出生后3月龄)、发育期(3~14月龄)、过渡期(15~30月龄)、稳定期(30月龄)以及动态变化期(幼儿至终年)五个阶段.
从母亲妊娠14~27周(孕中期)开始,胎儿通过哈欠、吞咽和吮吸动作吞咽羊水,同时将羊水中的低丰度和低多样性的微生物一同摄入体内.此外,细菌也可通过肛门进入肠道.通过上述两种方式摄入到体内的环境微生物构成胎儿肠道微生物组(以放线菌门双歧杆菌属和分叉双歧杆菌为主).有研究报道孕妇子宫内存在痤疮丙酸杆菌和葡萄球菌属皮肤细菌等的微生物DNA,以及短链脂肪酸(short-chain fatty acids,SCFAs,主要包括乙酸、丙酸和丁酸等,为菌群和宿主提供能量);它们可能对胎儿的中枢神经、免疫、消化等系统的早期发育以及新生儿肠道菌群的定植发挥正面影响[3,5,10].虽然目前对于人体肠道菌群是否始现于胎儿还存在争议[11],然而,基于将微生物转移到发育中的后代是动物界的普遍趋势之演化优势现象[12],人体肠道菌群始现于胎儿就不难理解了.针对始现期的肠道菌群如何影响后续四个阶段的肠道菌群多样性,这些微生物除了促进胎儿三大系统发育之外还有其它什么作用等问题,尚需更多精细研究.
基于婴幼儿肠道的生理特点,其更利于微生物的定植与繁衍.婴幼儿肠管长度是其身高的5~7倍,较成人之比例更大,且肠粘膜细嫩、肠壁较薄、通透性高、屏障功能差,因此肠道菌群代谢产物、肠内毒素等可经肠粘膜进体内.婴儿肠道菌群稳定性较差,在宿主成长过程中受多种因素影响,并与之互作,不断变化、演替更换.婴幼儿肠道黏膜结构特点对于其肠道菌群特异性的建立和宿主饮食习惯的养成发挥重要影响.每一个体均有其相对独立和稳定的肠道菌群多样性;一生中人体宿主在包括遗传、性别、居住地环境、饮食习惯和饮食结构、日常接触人群、个人身体状态等内外因素影响下,肠道菌群在一定范围内波动.成人肠道菌群最常见的为双歧杆菌、乳酸菌、拟杆菌、梭状芽孢杆菌、大肠杆菌、链球菌和瘤胃球菌等菌属[13].约2/3的肠道细菌属于拟杆菌门Bacteroidetes(如拟杆菌纲拟杆菌属、黄杆菌纲Flavobacterium、鞘脂杆菌纲Sphingobacterium)和厚壁菌门Firmicutes(如芽孢杆菌纲Bacilli:芽孢杆菌属Bacillus、李斯特氏菌属Listeria、葡萄球菌属Staphylococcus、肠球菌属Enterococcus、乳杆菌属Lactobacillus、乳球菌属Lactococcus和链球菌属Streptococcus等;梭菌纲Clostridium:醋杆菌属Acetobacterium、梭菌属Clostridium、优杆菌属Eubacterium、太阳杆菌属Heliobacterium、香蕉孢菌属Sporomusa;柔膜菌纲Mollicutes:支原体属Mycoplasma、螺原体属Spiroplasma、脲原体属Ureaplasma、丹毒丝菌属Erysipelothrix)[14],而变形菌门Proteobacteria和放线菌门Actinobacteria分别占肠道细菌总量的约10%和5%.近期英国学者从欧美人群中又发现近两千种肠道细菌[15],进一步增加了人们对固有肠道菌群多样性的认识.
在关于肠道菌群与人宿主生理病理关联方面,我们认为更值得思考和揭示的有趣现象是:人一生的生活习惯、饮食偏好,大脑发育、体质、心理特点、性情与个性倾向等等,恰好与肠道菌群稳定期同期基本成型.我国古语结论精辟:“三岁看大、七岁看老”.作者认为其不仅包括狭义的心理和个性倾向范围,还包括人的生理和体质等多方面的特质.意大利著名儿童教育学家蒙台梭利从心理学和教育学的角度也研究得出类似的结论.那么,肠道菌群成熟与人体组织器官发育成型的同步发展仅仅是巧合吗?随着科学技术的进步和对生命认知的增加,开展有关肠道菌群与宿主体质特征关联机制的更多精细、多学科交叉以及更多人群的长期跟踪研究很有必要.明确这些问题,对于丰富认识人类自身,拓展对生活环境与人类生活习性和健康等的内在关联机制的认知,以及更好地实施日常健康生活管理等等,均具有重要的现实意义.
4 肠道黏膜结构特点
肠道黏膜是人体一大免疫系统,在微生物定植于宿主肠道、保护宿主肠壁屏障完整性以及宿主健康等方面发挥重要作用.肠道内、外黏液层的主要成分是由水胶状的黏蛋白(由黏多糖组成的糖蛋白)形成聚合结构的多糖-蛋白质复合物组成,由肠黏膜上皮杯状细胞分泌[16].黏液层自小肠至大肠逐渐增厚,且大肠黏液层更加稳定.内黏液层厚度为50~200 μm,紧贴肠上皮一侧,有高浓度的抗菌肽防御素和分泌型免疫球蛋白IgA(sIgA)[17],几乎无菌.外黏液层,又称疏松黏液层,近肠腔侧,厚度为70~150 μm,该层是肠道菌群的主要定植部位.成人每日约有6~8 L的黏液分泌至胃肠道中.不断被分泌补充的内黏液层黏液向肠腔侧扩展移行为外黏液层,并与肠道菌群一起脱落为肠道内容物(包含大量非黏液层微生物)或被肠道菌群等代谢降解,由此维系着相对稳定的肠壁黏液层的动态屏障,发挥减少肠道炎症和肠源性感染的作用[18-20].在结肠中,部分肠道菌群以外黏液层中的黏蛋白聚糖为能量来源.大多数细菌更善于利用各种未消化的食物多糖,而食物成分的变化能够促进可利用黏蛋白聚糖细菌的繁殖;以高纤维类食物为主食的人群其肠道菌群更多依赖黏液聚糖作为能量来源[19, 20].图1为不同健康状态下人肠黏膜屏障和肠道菌群变化特点.
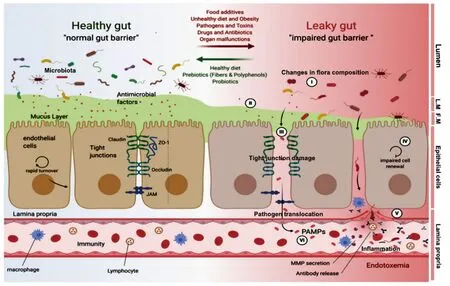
图1 人肠壁组织部分结构及肠壁屏障示意图自上而下分别表示肠腔(Lumen)、外黏液层(Loose Mucus, L.M.)、内黏液层(Firm Mucus, F.M.)、肠上皮细胞(Epithelial Cells)以及固有层(Lamina Propria).肠屏障的破坏(图右)与菌群组成的变化(I),黏膜层的厚度和稠度降低(II),紧密连接蛋白的破坏(III),细胞更新受损(IV),通透性增加(V), PAMPs(病原体相关分子模式)和病原体易位(内毒素血症)(VI)以及炎症反应(VII).ZO-1,闭锁韧带-1;JAM,接粘附分子;MMP,基质金属蛋白酶.改编自文献[20].
黏液对肠道菌群的功能也会产生影响.黏液可使细菌保持浮游运动态,防止其形成生物膜并黏附到黏液下层(图1).肠黏膜的稳定为这些微生物提供适宜的定植地,而微生物通过维持细胞间的连接以及促进肠上皮损伤修复,以维持肠上皮屏障功能的完整性[19-21],这也是其在与动物长期共演化过程中形成的互利共赢机制.肠道菌群组成和肠道黏液的变化首先出现在动物的小肠,然后是大肠,表明小肠在肠道对细菌的选择中起重要作用.黏液与细菌可通过几种方式结合,进而阻止其与上皮接触[19].首先,细菌可被限制在肠道黏液层中;其次,黏蛋白中的疏水基团以及膜-被结合结构使得黏液具有一定的疏水性,不利于菌群的游动此外,多态且可变的黏蛋白聚糖与带有聚糖特异性黏附素的细菌相结合[19].然而,致病菌也有规避黏液层的方法.如肠炎沙门氏菌血清型鼠伤寒沙门氏菌、灵芝氏菌和霍乱弧菌依赖鞭毛的驱动和蛋白水解渗透黏液层并达到上皮.
5 肠道菌群的分布与门类
基于人体肠道各区段环境差异和生理功能异质性,其肠道菌群的分布和种类也不尽相同.
5.1不同区段肠道菌群的分布从胃到大肠,消化道内的环境从酸性逐渐升高至中性.进食中吞咽的氧气也不断排出和消耗,结肠及其下游肠腔环境几乎为无氧状态;而包括抗菌肽、胆汁酸和IgA等抗菌活性物质的浓度从小肠到结肠逐渐降低,加之食物消化状态、消化道各区段功能的差异,菌群构成也不尽相同(表1).
在pH 1.5-2.0强烈的蠕动和稠厚黏液层的内环境中,从口鼻进入胃的细菌绝大多数被胃酸杀灭,幸存的微生物密度仅为101-103CFU(colony forming unit菌落形成单位)/mL,主要是革兰氏阳性需氧菌,如幽门螺杆菌Helicobacterpylori、链球菌Streptococcus、普雷沃氏菌(普氏菌,Prevotella)、罗斯氏菌属Rothia、韦荣球菌属Veillonella和嗜血杆菌Haemophilus等.目前还未明确这些细菌是长久定植在胃部,或仅是路过.小肠菌群的构成特点介于胃和大肠菌群之间.从十二指肠到空肠,菌群密度增加至102-103CFU/mL,到回肠末端进一步上升至108CFU/mL[22].近端小肠菌群与胃内相近,但也有少量大肠杆菌和厌氧菌.末段回肠中厌氧菌的数量开始超过需氧菌.其中,链球菌属、大肠杆菌、梭状芽胞杆菌属Clostridiumsp.、韦荣球菌属、肠球菌属Enterococcus、肠杆菌属Enterobacteriaceae、拟杆菌属Bacteroides、瘤胃球菌属Ruminococcus、多毛孢菌属Dorea、粪球菌属Coprococcus、魏斯氏属Weissella和乳杆菌属Lactobacillus是健康成人小肠的优势菌[23],另外还有部分双歧杆菌属细菌.大肠肠道内pH值介于弱酸至中性之间,胆汁酸浓度低,营养物停留时间长.另外,大肠免疫系统对细菌耐受度高,更适合其生长,丰度达到1012CFU/mL[22];大肠内氧含量极低,故99%以上菌群为严格厌氧菌.在回盲瓣远侧,细菌丰度明显增加.大肠细菌总量几乎占粪干重的1/3,主要菌种为粪杆菌属、双岐杆菌属和真杆菌属.表1总结了人不同消化道区段生理特征及菌群分布和构成特点.

表1 人体消化道菌群分布和特征
除细菌外,在肠道中还栖息着少量的非细菌类(古细菌/古生菌、真菌和病毒)微生物[24-26].这些低丰度的微生物对肠道细菌以及宿主健康的作用还有待深入研究.肠道菌群的组成、相对丰度以及多样性在不同个体间存在差异,但其功能基因的类型及丰度大同小异[26].
5.2肠道菌群的门类目前已知的人体肠道细菌按生物结构归属于10个门类,其中以拟杆菌门、放线菌门(双歧杆菌Bifidobacterium为主)、变形菌门(肠杆菌为主)以及厚壁菌门(乳杆菌、肠球菌、梭菌为主)为主[22-26].结肠外黏液层定植着106CFU/mL以上的细菌,主要由厚壁菌属Firmicutes、拟杆菌属Bacteroidetes、放线菌属Actinobacteria、变形菌属Proteobacteria、梭杆菌属Fusobacteria和疣孢微生物属Verrucomicrobia等6个菌属的细菌组成,占肠道菌群总量的90%以上,其次是疣微菌门3%~5%,它们在种或菌株水平具有更高的多样性.在成百上千种肠道菌群中,30~40种细菌占据总数的99%,其中以表2中列出的几种细菌占优,且随年龄不同发生变化[22,27].

表2 不同年龄组人群粪便(肠道)菌群丰度及占比
6 肠道细菌的功能分类和主要作用
目前存在按照种类和功能对肠道细菌分类的两种方法.前者已在前文中做了介绍.
6.1肠道细菌的功能分类依据对人体的作用,将肠道菌群分为益生菌、中性菌和致病菌三大功能类别.在健康个体中,它们之间相互竞争、制约,维持着一种正常的动态平衡状态[21-25].
6.1.1 益生菌 也被称为共生菌或有益菌,对人体有益,约占肠菌菌群总数的20%,主要有乳酸杆菌、双歧杆菌、酪酸菌(丁酸梭菌,梭菌中的一种)、丙酸菌、艾克曼菌、优杆菌、拟杆菌等.可合成多种维生素,参与食物(如碳水化合物)的消化、产生乳酸,促进肠道蠕动,抑制致病菌群的生长,分解有害物质,激活免疫系统等,对人体健康不可缺少.
6.1.2 中性菌 也被称为条件性致病菌,具有双重作用,约占肠菌菌群总数的70%,如大肠杆菌、大肠埃希菌、乳杆菌、链球菌(屎球菌)及韦荣球菌等.在正常情况下其对人无害.但受内外因的影响使中性菌增殖失控,或从肠道转移到身体其他部位,则可能发挥其侵袭性和致病作用.
6.1.3 致病菌 也被称为有害菌,约占肠菌菌群总数的10%.由于大量共生菌的存在,制约着这些致病菌的繁殖.其数量一旦大量增加,就可能引发人体多种疾病,产生致癌物等有害代谢物或影响免疫系统功能.主要代表性菌种如金黄色葡萄球菌、溶血性链球菌,以及外源有害菌种,如沙门氏菌、变形杆菌、韦氏梭菌、假单胞菌和产气荚膜梭菌等,它们是食源性肠道疾病和食物中毒的致病源.此外,因可分解蛋白质、产生硫化氢或外毒素,有人将腐败菌也归为有害菌,包括大多数梭状芽孢杆菌、肠杆菌、肠球菌、硫酸盐还原菌等.尽管这些菌种大多平时并无致病性,但其代谢物对人体有害.
6.2有益菌的作用肠道菌群对婴幼儿发育成长以及成人组织器官生理机能的发挥不可或缺[3, 10].它们的主要功能包括:①正常肠道菌群在某一特定位粘附、定植和繁殖,形成一层菌膜屏障.通过拮抗作用,抑制并排斥过路菌群的入侵和群集,调整肠道菌群间及其与人体生理机能的平衡状态;②免疫作用.正常菌群能刺激宿主产生免疫及清除功能,促进婴幼儿免疫系统的发育和成熟;③排毒作用.如双岐杆菌能使肠道过多的革兰氏阴性杆菌维持在正常水平,减少内毒素的吸收;④抗肿瘤作用.降解、清除体内的致癌因子,激活体内的抗肿瘤细胞因子等;⑤抗衰老作用;⑥合成分泌多种对人体有益的代谢产物.如双歧杆菌和比菲德氏菌等合成B族维生素(B1、B2和B6)、维生素K和非必需氨基酸对人体毛发发育具有重要的作用.以下简述主要有益菌的作用.
6.2.1 双歧杆菌 双歧杆菌是法国巴斯德研究院的Tissier于1899年首次从母乳喂养的健康婴儿粪便中分离出来的严格厌氧革兰氏阳性菌,属于细菌界放线菌门/纲双歧杆菌目/科/属Bifidobacterium,是婴幼儿肠道菌群中的优势菌属之一,也是人体肠道菌群中最重要的益生菌,主要利用低分子量碳水化合物食物;其占婴儿肠道菌群的99%以上,但遗憾的是随宿主年龄的增长双歧杆菌快速减少,老年人的丰度更低(表2).双歧杆菌属有46个种和亚种,与人体密切相关的有十二种,代表菌种为两歧双歧杆菌.主要分布在大肠,少量栖居于小肠末端、口腔和阴道中.双歧杆菌对杆菌肽、青霉素G、红霉素、万古霉素、克林霉素和氨苄西林高度敏感,对氨基糖苷类抗生素、多黏菌素B、萘啶酸和甲硝唑等不敏感.双歧杆菌的主要作用包括:①抑制非益生菌定植.双歧杆菌可产生菌体外多糖和胞外糖苷酶,增强肠黏膜的吸附作用,降解肠黏膜上皮细胞多糖,使致病菌、条件致病菌和细菌毒素无法粘附肠壁.此外多种双歧杆菌能产生广谱抗菌素,抑制致病菌的生长;②参与多种蛋白质及维生素(B1、B2、B6、B12、K,泛酸、烟酸、叶酸和生物酸)的合成,协助机体对营养的消化吸收,抵御致病菌侵袭、提高机体免疫功能,参与肠道中物质的新陈代谢[27];③预防和治疗新生儿典型病症[28].发酵多种糖类产生有机酸(乳酸和醋酸等),不仅可以使肠道pH值下降,从而抑制腐败菌的生长.此外这些有机酸还能减少吲哚、亚硝酸胺等致癌物质,并可以提高钙磷铁等元素的利用率,促进肠道对铁镁锌和维生素D的吸收;④促进免疫发育,改善高脂喂养小鼠代谢和免疫功能障碍,增强NK细胞的活性,使浆细胞合成sIgA增加[9, 29];⑤发酵产生半乳糖,作为神经系统中重要分子脑苷脂的成分,促进婴儿大脑发育[4, 10].此外,拟杆菌属是肠道内主要的降解细菌,含有多种多聚糖酶和糖苷酶,可利用多糖.
6.2.2 乳酸菌 可发酵糖类产生乳酸的无芽孢、革兰氏阳性乳酸菌,统称为乳酸菌,由18个属组成,共200多种.乳酸菌多数为同型发酵,产生85%以上的乳酸,少数为专性异型发酵(产生等摩尔比例的乳酸、二氧化碳、乙醇/乙酸),另外为兼性异型发酵(产生酒精和乳酸).同型乳酸发酵的乳杆菌主要有:嗜酸乳杆菌、唾液乳酸菌、德氏保加利亚乳杆菌和瑞士乳杆菌等.兼性异型发酵的乳酸菌有干酪乳酸菌、米酒乳杆菌、胚芽乳杆菌等.异型发酵的乳酸菌主要有短乳杆菌和布氏乳杆菌等.乳酸菌与人体多种生理功能关系密切.在健康成人肠道内普遍存在,但随年龄增长或健康状况下降而减少[10, 14, 22, 27].对人体的主要作用主要包括:①增强蛋白质、单糖及钙、镁等的吸收;②抑制胆固醇吸收,结合致突变物质(如黄曲霉素);③抑制有害菌繁殖.产生乳酸、过氧化氢、抗生素类或细菌素类物质;④乳酸菌的代谢产物降低肠道pH值,促进胃肠蠕动,从而抑制硝酸盐还原菌的生长和繁殖,降低腐败菌的致突变作用,减少亚硝酸胺的形成,对致癌物质亚硝基胍等有拮抗作用;⑤激活机体的免疫系统,特别是巨噬细胞、NK细胞和B淋巴细胞;⑥控制人体内毒素水平,保护肝脏并增强肝脏的解毒、排毒功能;⑦乳酸菌细胞壁的主要成分是胞壁粘肽多糖(PG),能激活淋巴细胞产生多种淋巴因子.
6.2.3 艾克曼菌 大肠外黏液层中定植的微生物主要是疣微菌门的细菌.艾克曼菌Akkermansiamuciniphila, 为革兰氏阳性菌,是2004年由荷兰瓦赫宁根大学Derrien等从人粪便中分离出的黏液降解细菌,属艾克曼菌属,是疣微菌门中的优势菌群,约占80%.在人肠道中有超过8种不同的艾克曼菌,其中以嗜粘蛋白-艾克曼菌为主,约占肠道菌群总量的1%~4%.在婴儿1岁左右时其即定植稳定下来,是肠道外黏液层细菌中的优势菌种,对人婴幼儿的发育等具有积极意义[4, 8, 10].其主要作用包括:①降低胰岛素耐受性,其丰度与体质指数以及循环中的瘦素浓度以及2型糖尿病、肥胖可能呈负相关.然而这一结果与对我国受试者的研究结果不一致[30];②艾克曼菌膜上的一种耐高温的细菌蛋白,除了抑制肥胖发生以外,还可以促进肠道屏障功能[31].该菌可分泌60多种与黏蛋白降解相关的蛋白,如糖苷酶、硫酸酯酶以及唾液酸苷酶等,其中糖苷酶可显著增加癌症患者的免疫治疗效果[32];③以黏蛋白为碳源和氮源,产生SCFAs,为肠细胞提供能量来源;④调节基因表达、细胞分化以及抵抗抗炎药物;⑤降解海藻糖化的人乳低聚糖,产生丙酸,在促进自身定植的同时也有益于宿主;⑥促进宿主天然和获得性免疫系统的发育,诱导肠道免疫调控、限制肠道上皮细胞NKG2D配体的表达;还可产生胞外小泡,缓解葡聚糖硫酸钠诱导的结肠炎[33, 34];⑦纠正肠道菌群失调,增加次级胆汁酸,延缓早衰症人和小鼠的衰老现象[35].
6.2.4 丁酸梭菌 丁酸梭菌Clostridiumbutyricum,又称酪酸菌,于1933 年由日本千叶医科大学宫入近治首先发现,又名宫入菌,属于芽孢杆菌科梭菌属,为革兰氏阳性厌氧杆菌,是球形梭菌和柔嫩梭菌中的一种,耐热耐酸,对青霉素、氨苄西林、链霉素、庆大霉素、妥布霉素、氯霉素等有一定的抗性.丁酸梭菌可将乙酸、乳酸等次级代谢产物转化为丁酸,后者是肠上皮细胞70%的能量来源,是其再生和修复的主要营养物质,可抑制肠道内的病原菌和腐败菌的生长,促进益生菌(如双歧杆菌、乳酸菌和拟杆菌)增殖.丁酸梭菌的主要作用有:①抑制结肠癌等癌细胞的增殖,被认为是一种抗癌剂.转运氨基酸,促进对脂肪和蛋白质的吸收;②分解多糖产生丁酸,产生益生元,为其他益生菌提供营养物质;③产生B 族维生素、维生素K、淀粉酶、蛋白酶、糖苷酶、纤维素酶、果胶裂解酶等,对结肠上皮细胞的能量代谢和发育起到了重要作用;还具有促进维生素E的吸收,降解胆酸和提高抗氧的能力;④抑制引起疾病的葡萄球菌、念珠菌、克雷伯菌、弯曲杆菌、绿脓杆菌、大肠杆菌、痢疾杆菌和伤寒沙门菌以及腐败菌的繁殖,从而减少了胺类、吲哚类和硫化氢等有害物质;⑤调节基因表达,下调IL-23和TNFα,抑制NF-κB信号通路从而抑制炎症[36],而其产生的丁酸可下调结肠上皮细胞TLR4的表达[37]. 此外,部分梭菌具有致病性,可产生有害因子(肠毒素、肉毒素,神经氨酸酶等),故不将此类梭菌归为益生菌.
6.2.5 普拉梭菌 普拉梭菌Faecalibacteriumprausnitzii(F.prausnitzii)是一种棒状杆菌,属于厚壁菌门Firmicutes柔嫩梭菌属Clostridiumleptum.于1922年由Prausnit从胸腔脓肿患者中分离.是人体肠道中数量最多的共生厌氧有益菌之一,约占人粪便细菌总数的5%~15%[38],在婴儿断奶期间定植[39].普拉梭菌也是产丁酸的细菌,作用于免疫系统,具有抗癌作用.改善肠道屏障、产生食物满足感、改善胰岛素敏感、改善氧化压力、降低内脏敏感性.可分泌15 kDa大小的蛋白,抑制NF-κB通路介导的炎症反应[40].竞争性抑制大肠杆菌、梭状芽孢杆菌、志贺氏杆菌等致病菌在肠内的增加[41].通过抑制维甲酸相关孤儿受体 (ROR-γt) 的 mRNA表达,提高螺旋转录因子Foxp3的表达,调节Treg/Th17的平衡、调控T细胞亚群[42].普拉梭菌可能具有降低肝脏甘油三酯、磷脂和胆固醇酯等脂肪含量,降低天冬氨酸氨基转移酶和丙氨酸氨基转移酶含量,增加肝脏中的脂肪酸氧化和脂联素信号传导的作用[43].
6.2.6 其他有益菌 其他有益菌还包括革兰氏阳性球菌(粪链球菌、乳球菌、中介链球菌)、保加利亚乳杆菌、嗜热链球菌、干酪乳杆菌、芽孢乳杆菌、酵母菌(产阮假丝酵母、啤酒酵母)以及芽孢杆菌(枯草芽孢杆菌、地衣芽孢杆菌)等.此外,梭状芽孢杆菌属成员的第四类(粪肠杆菌)和第十四类(丁酸厌氧杆菌)具有消化碳水化合物,产生SCFAs的能力.
6.3致病菌的种类及作用肠道菌群中致病菌主要包括:金黄色葡萄球菌、溶血性链球菌、沙门氏菌、变形杆菌、假单胞菌、产气荚膜梭菌梭状芽孢杆菌、肠杆菌、肠球菌以及硫酸盐还原菌等.它们的主要作用包括:①可竞争性抑制乳酸菌等有益菌的繁殖;②产生有害物质,如氨、硫化水素及粪臭素.它们既是恶臭肠道气体的来源,也会加速肠壁的老化、降低肠道免疫功能,产生致癌物,成为大肠癌的发病根源. 除此之外,包括链球菌和维朗氏菌等口腔细菌在脂代谢相关疾病(2型糖尿病、冠状动脉疾病)以及炎症性肠病患者肠道中的异位定植增多[44, 45],异位至肠道后,它们可促进大肠杆菌、变形杆菌、鼠伤寒沙门氏菌和沙雷氏菌属等细菌繁殖,促进合成炎症因子,增加肠道壁通透性[46],损害肠道健康.
6.4中性菌及其作用有些暂时寄居于肠道的菌群,被称为过路菌群或外籍菌群或条件致病菌,是由非致病性或潜在致病性细菌所组成,来自周围环境或宿主其它生境,在宿主身体存留数小时至数周.如果正常菌群生态发生紊乱,这些中性菌群可在短时间内大量繁殖,引起疾病[47, 48].它们主要包括大肠埃希菌、乳杆菌、链球菌(屎球菌)及韦荣球菌、大肠杆菌及白色念珠菌等细菌,此外还有真菌.总之,关于人体肠道微生物菌群的种类和功能,还需进一步采用传统方法结合新技术进行更加细致和大量的研究以明确之.
7 影响肠道菌群的因素
从胎儿期、出生中以及人的一生中,肠道菌群均受到内在和外界环境等众多因素的影响[22,49,50].
7.1生活环境对肠道菌群定植和建立的影响人体肠道菌群的定植和形成受到自身遗传、性别、年龄,孕妇身体状态及分娩方式,婴儿喂养方式,接触到的人和物,以及母亲与婴儿是否使用抗生素等多方面因素的影响[51-54].胎儿出生后通过与外界环境、人(亲朋好友和医护人员)和物(婴儿包裹物、玩具、宠物)的接触(亲吻拥抱、吮吸和舔舐),进一步摄入更多的环境微生物[8],并逐步建立起与其生理特质[51,52]和生活方式及饮食环境相应的多样化肠道菌群[7,53].顺产儿通过接触母亲产道以及外界环境,进一步摄入微生物,其体内微生物环境与母亲产道微生物种群类似,即高丰度的双歧杆菌属.而剖宫产儿肠道菌群与母亲体表微生物种类(金黄葡萄球菌和丙酸杆菌等)相似,且其体内免疫细胞更多[8, 54].新生儿肠道菌群的丰度和多样性变化较快,随年龄而增加,随不同生活地域、饮食结构、食用固体食物以及使用抗生素等状况发生变化.研究显示,出生后2周至3个月内肠道菌群处于较活跃的动态变化中,而健康成人1年内95%的肠道菌群在门水平上相对稳定[7],以拟杆菌门和厚壁菌门为主,而变形杆菌门和放线菌门(双歧杆菌为主)的丰度相对较低,仅为2%~14%.
母乳和人造代乳食品可促进婴儿肠道菌群转变为更加适宜食物消化、利用乳酸的菌群.母乳喂养的婴儿肠道菌群构成简单,以双歧杆菌为主.而人工喂养的婴儿肠道菌群种类较多,但双歧杆菌低于前者,而拟杆菌、肠杆菌、肠球菌、梭菌、硬毛菌Firmicutesphyla等多于前者[8],说明其在食用这些代乳食品时也随之摄入更多种类的外源微生物,但这也限制了双歧杆菌的繁殖.奇妙的是,在进食固体食物前,婴儿已基本具备了消化植物性多糖的能力[8],这种接受由母乳转向人工固体食物的转变现象说明宿主遗传因素在其肠道菌群定植和多样性形成时期的影响作用.1岁左右婴儿的肠道菌群多样性已开始向成人肠道菌群转化[54].2.5至3岁时,幼儿与成人体内肠道菌群的构成已趋于一致,且在日后相对稳定的生活环境下保持相对恒定的动态变化中[53].
7.2遗传、年龄和性别对肠道菌群的影响遗传、年龄、性别、健康状况、膳食结构、饮食习惯等,均会影响人体肠道菌群丰度和多样性.健康人群随年龄的增长其肠道菌群中双歧杆菌从绝对优势降低到极低水平,肠杆菌和拟杆菌从低水平上升至占绝对优势.遗传因素是个体间肠道菌群差异的原因之一[50, 55].前文提到婴儿消化系统已经具备可消化不同模式饮食的能力[8],即多由其自身遗传主导.也有研究显示,异卵和同卵双生双胞胎具有相同的微生物群[56],提示生活环境可能是造成同一家庭成员肠道菌群相似性的主要原因.此外,无论是我国还是外国居民,在不同地域生活的个体间,其肠道菌群也有差异[50].2018年以色列学者针对该国1046具有不同祖先起源的健康个体的基因型和微生物组数据的研究发现,遗传因素和肠道菌群并无明显相关性.而同一家庭无亲缘关系的个体,其肠道微生物组有明显相似性,超过20% 的人际微生物组变异与饮食、药物等因素有关[57].
此外,宿主年龄和性别也会影响其肠道菌群多样性[50, 58,59].宿主肠道微生物组的特征与健康或不健康的衰老过程有关.相比年轻男性而言,年轻女性具有更高的肠道菌群生物多样性,可能与女性激素有关.女性较男性更早进入青春期,在性激素水平和时间上,性别差异可能是男性肠道菌群成熟延后的原因[50, 58,60,61].这将造成宿主免疫力的性别差异以及对感染和慢性疾病的易感性,与恶性肿瘤、自身免疫性疾病和传染病的患病率、发病率等方面的性别差异有关,即所谓的“菌群性别组学(Microgenderome, 又称“性二型”)”概念[62, 63].此外,女性结肠传输时间较男性长[64],使细菌有更多时间在大肠内获取营养,并大量繁殖,这可能是女性肠道菌群多样性增加的原因之一.而且,肠道菌群中史密斯分枝杆菌的丰度与年龄有关,甲烷产生基因和微生物多样性可能与结肠中粪便的运输时间延长正相关[50]. 此外,厚壁菌和拟杆菌门受性别和体型的影响,而双歧杆菌属受性别的影响则较小[65].
我国学者马占山等分析了2012年美国“人类菌群宏基因组项目”数据,发现不同性别人群由于选择效应(微生物物种或物种之间或与宿主间互作的决定性适应性差异)导致肠道菌群中拟杆菌门和厚壁菌门存在明显的性别差异,其又受宿主生理(免疫力、激素、肠-脑交互作用等)机制的调控,且对宿主疾病易感性具有显著影响[66].根据人体微生物的多样性和丰度,有人将不同人群按“肠型”(Enterotypes)进行划分,以代表宿主-微生物共生稳态时的人体微生态结构特征.目前将其分为拟杆菌型、普氏菌型、瘤胃球菌型和厚壁菌型四种肠型.肠型的形成与个人长期饮食习惯和生活环境密切相关,且随饮食变化保持相对动态稳定.研究显示,男性D型菌群(高丰度的普氏菌和低丰度的拟杆菌属)比女性高三倍;女性则倾向于C型菌群,即含有较高丰度的瘤胃球菌Ruminococcaceae、普拉梭菌和另枝菌属Alistipes,而较低丰度的普氏菌和拟杆菌,或者说女性肠道菌群α多样性更高[51, 52].
研究发现,女性患多发性硬化症、类风湿性关节炎和红斑狼疮等自身免疫性疾病的风险更高.将雄性肠道细菌转移并定制于具有高遗传风险的雌性体内,可预防其发生自身免疫性疾病[62].此外,年轻雌鼠接受成年雄鼠肠道菌群后,其卵巢和肾上腺增加了睾酮的分泌.另有研究发现睾丸激素水平与男性肠道菌群α多样性和丰度呈正相关[50].性别决定了它们的肠道微生物组成,且这些微生物影响了性激素水平,而激素转而调控了一种免疫介导性疾病.近期日本学者发现健康日本人粪便粘稠度与肠道功能的年龄和性别差异以及肠道菌群多样性有关联[67].然而我国学者的研究显示,大多数与年龄相关的肠道菌群与性别、生活方式或宿主代谢情况无显著相关性,推测与年龄相关的内在生理变化对肠道菌群的影响更加明显[50].基于在性成熟前幼年宿主两性间肠道菌群无明显差异,而老龄动物其固有肠道菌群多态性变化明显[68, 69],说明性激素水平差异可能是导致不同性别人和动物以及不同年龄其肠道菌群组成及多样性差异变化的原因之一.
导致在不同性别宿主之间肠道菌群差异的可能有以下几种原因:①性类固醇通过上调紧密连接蛋白的表达,改善肠上皮细胞的增殖和上皮屏障功能,调节肠屏障的完整性和通透性,进而影响肠道菌群[70];②性类固醇通过激活宿主的性激素受体,间接调节肠道菌群.如,雌激素受体β敲除小鼠肠道菌群中变形杆菌、拟杆菌、厚壁菌以及乳杆菌的发生改变,与雌激素受体β信号传导调节肠上皮屏障功能有关[71].而雄激素的变化可通过作用于肠壁雄激素受体,导致肠道功能改变,从而影响肠道菌群的组成[72];③胆汁酸在微生物组和脂代谢的性别特异性调节之间起作用[73].而性类固醇通过影响胆汁酸水平,调节胆汁酸微生物代谢的功能及其繁殖[74];④性类固醇通过改变β葡萄糖醛酸苷酶活性和能量产生,直接影响肠道菌群的组成[75];⑤多数免疫细胞表达性激素受体,如雌激素受体α信号对树突状细胞的发育和功能很重要[76],作为抗原呈递细胞,树突状细胞对促进共生细菌的免疫耐受性发挥作用[77],从而调节宿主全身或肠道免疫功能来影响肠道菌群的组成.此外,在肥胖、糖尿病、肝病、慢性腹泻等人群中,其肠道菌群的分布以及种类均有不同.
综上,肠道菌群可产生激素,通过抑制基因转录调节宿主激素的内环境平衡.反过来,宿主激素也可影响细菌的基因表达、生长和毒力,最终影响宿主生理机能.遗传因素在肠道菌群定植中的作用机制是什么?不同的肠道微环境导致肠菌定植有何选择性?针对不同社会的人群互换其日常膳食进行深入研究,用以探究遗传、生活环境等对肠道菌群多样性以及可能对健康的影响,是有趣的课题之一.
7.3膳食和饮食方式对肠道菌群的影响古语言:“民以食为天”,精辟地道出了生物的本性及对“吃”的欲望程度.然而,“病从口入”,也时刻提醒我们:人类众多疾病的发生发展与不良饮食习惯和不合理的膳食结构密不可分.研究证明饮食能够改变肠道菌群结构,不同周期内的饮食变化在影响某些菌群比例时其结果也不同.近期研究表明,肠道菌群种群的组成在很大程度上是由宿主饮食以及消耗的营养物质选择的.近期出现了“微生物组营养学”的概念[78].长期的饮食习惯和膳食模式是塑造宿主肠道菌群的重要影响因素[79].微生物的生存依赖于食物和宿主来源的化合物以及微生物自身的代谢产物.肠道中未消化的食物大分子和宿主肠黏膜分泌产物(如黏蛋白)可被肠道菌群(如拟杆菌门和厚壁菌门等)进一步分解代谢[33].东西方饮食结构的不同,导致肠道菌群的差异.饮食对肠道菌群的影响可能超过遗传因素,可导致饮食成分偏好菌群的大量繁殖[80, 81].
此外,膳食也关系到以噬菌体为主的人体肠道病毒种群的变化[82]. 肥胖或非肥胖同卵双生和异卵双生儿肠道菌群构成相似,且与其对应体质指数的双亲肠道菌群也无显著差异[56],这说明家庭饮食生活环境和习惯对肠道菌群构成的影响更加显著.针对不同饮食文化人群肠道菌群的比较研究表明,改变饮食习惯可能会在更长的时间内导致其肠道菌群的变化[80].针对移居美国的中国和泰国移民的研究发现[83],到达美国之后,他(她)们固有的肠道菌群构成很快发生变化,获得在欧美人中更常见的外来微生物,且其不足以完全弥补固有微生物的损失,导致其肠道菌群整体丰度和多样性减少.在移民后的6~9个月里,西方菌株(如拟杆菌)逐步取代非西方菌株(如普氏菌),且消化植物纤维的相关酶也逐渐消失.该西化现象在他们移民美国后的较长时间里持续存在,在美国停留的时间越长,其肠道菌群多样性越低,说明西方饮食和新的生活环境在影响其肠道菌群方面发挥了重要作用.这些变化在第一代移民后代身上更加明显,且这些变化与其肥胖发生率正相关.
目前的研究均提示,生活环境和饮食结构是影响肠道菌群构成的主要因素,与宿主健康状态等显著相关.这是否能部分解释“一方水土养一方人”呢?除肠道菌群多样性之外,移居别地的人群其心理和饮食习惯是否也发生显著变化呢?与肠道菌群改变有何内在关联机制呢?为什么亚洲移民反而较西方常住居民更容易患肥胖病和糖尿病等代谢性疾病呢?饮食与肠道菌群内在关联机制仍需进一步深入研究.
7.3.1 碳水化合物饮食对肠道菌群的影响 碳水化合物是人和动物食物的主要组成部分,分为可消化和不可消化两种.前者主要包括单糖、低聚糖和淀粉,而后者包括抗性淀粉、不可消化多糖和非淀粉多糖.不可消化碳水化合物和木质素组成膳食纤维.研究显示,短杆菌和白色念珠菌与高碳水化合物饮食呈正相关,与高蛋白质和高脂肪饮食呈负相关[63].白色念珠菌的丰度与近期饮食中碳水化合物含量密切相关,而甲氧布氏杆菌Methobrevibacter的丰度与碳水化合物摄入有关.
研究发现,对吃低碳水化合物食物的小鼠,肠道菌群的多样性明显降低,而且该效应会转移给后代并叠加,低丰度的细菌经代际传递逐渐减少,尤其是能够有效消耗食物纤维的“拟杆菌目”的细菌明显减少[84].我国学者张和平等对26名蒙古族志愿者分别以小麦、大米和燕麦作为唯一碳水化合物主食,连续食用一周后改变了以乳制品、红肉为主食的其固有肠道菌群结构及代谢通路.表现为小麦和燕麦有利于链状双歧杆菌、双歧杆菌、青春双歧杆菌,而大米抑制青春双歧杆菌,小麦抑制乳酸杆菌、反刍球菌和拟杆菌[85].然而,高碳水化合物饮食可影响肠道菌群稳定性和多样性,导致营养不良,也是肥胖症中常见的变化.目前仍需更多针对不同比例的碳水化合物饮食与肠道菌群以及重要脏器信号轴间互作及其机制的研究.
7.3.2 西方饮食对肠道菌群的影响 研究发现,西方饮食与食物多样性的减少,可扰乱人体肠道菌群多样性,可能导致宿主易患代谢性疾病[86],且亲代肠道菌群的变化可遗传至后代[83].食用高纤维、低脂饮食的非洲儿童的粪便菌群与食用西方饮食的欧洲儿童粪便菌群的比较发现,前者的拟杆菌较多,且普氏菌属细菌和木聚糖杆菌Xylanibacter丰富,而厚壁菌门细菌较少[86].这表明肠道菌群与食用富含膳食纤维的宿主共同演化,使前者能够最大程度地消化之,从而尽可能多地从中获得能量,并保护其对抗炎症和结肠疾病.然而,另有研究显示,连续低脂、高碳水化合物饮食10 d,并不会导致拟杆菌属肠型转向普氏杆菌肠型[80].这说明固有肠道菌群具有一定的竞争优势稳定性,或者在受到环境等外界因素影响时,其具有一定的自主调节复原或修复机制,或者说短期外界干预尚不足以明显改变固有菌群结构.表明这种在长期演化中形成的生命体自我保护机制,作为保护自身对突然变化的外部生境具有一定的抗性.
近期我国学者的研究显示,高脂肪低碳水化合物饮食对健康成人肠道菌群、粪便代谢物及血浆炎症因子均可产生影响[87].他们连续6个月分别给予18~35岁非肥胖者以等热量但脂肪含量(20%、30%和40%)不同的饮食,发现低脂饮食与菌群α多样性、布劳特氏菌Blautia、共生厌氧菌普拉梭菌(一种益生菌)和粪便杆菌属增加相关,其中与代谢疾病有关的共代谢产物(对甲酚和吲哚)水平降低.而高脂饮食与革兰氏阴性另枝菌属和拟杆菌属增加、普拉梭菌、粪便杆菌属减少相关,其粪便SCFAs含量显著降低,高脂饮食与粪便中花生四烯酸和脂多糖以及血浆促炎因子增加相关.
摄入现代西方饮食和传统高纤维食物的儿童肠道菌群拥有各自独特且不同的属性,并可能影响其一生的生理机能、身体特质和饮食习惯[80, 83, 86].此外,研究显示,孕期超重和肥胖的孕妇其肠道类杆菌和葡萄球菌明显增加,子代儿童肥胖率明显升高[88].我国与国外学者的近期研究均表明,高脂饮食性肥胖小鼠精子中转运RNA衍生的小RNA(tsRNA)片段会引发子代代谢紊乱,显示饮食可改变亲代精子的某些生物性状,其肥胖以及代谢障碍特性可遗传至后代[89, 90].这些小鼠肠道菌群中的多尔菌属、颤螺旋菌属和瘤胃球菌属等生成SCFAs的菌属增多,抗炎的苏黎士杆菌属减少,促炎的乳球菌属增加.而SCFAs给动物提供更多的能量,在能量消耗未能相应增加的情况下,导致体脂增加[91],且双亲饮食性肥胖后生育的后代,均表现出肥胖易感的特质,且可连续遗传数代.
然而,近期另有研究发现,合成SCFAs的菌群以及SCFAs的减少与心血管疾病风险增加呈正相关[92],提示可产生SCFAs的菌群以及SCFAs对人类健康的多重作用.近数十年来我国居民,尤其是青少年摄入类似现代西方模式的高脂肪、高热量饮食快速增加,超重以及肥胖发生率显著增多,这与高脂饮食导致的肠道菌群紊乱不无关系.然而针对不同生境、不同饮食结构和饮食习惯人群生理功能与肠道菌群相关性的机制,还需更大规模、更多样品展开深入研究.
7.3.3 高膳食纤维对肠道菌群的影响 不同饮食的人群中包括普氏菌和肠杆菌在内的主要肠道菌属的丰度不同.如前文所述,多食用高纤维食物的非洲农村居民和多食用植物性多糖(玉米、木薯)的南美居民,其普氏菌丰度较高.而食用更多动物性蛋白质、氨基酸以及饱和脂肪的居民,其肠杆菌丰度更高[86,93].食用高纤维食物的非洲儿童肠道菌群拟杆菌明显占优,而厚壁菌门(包括普氏菌和木聚糖杆菌)、大肠杆菌和志贺菌Shigella丰度较低[93],但这些可分解膳食纤维和木聚糖的普氏菌和聚集拟杆菌门理研菌属的木聚糖杆菌,产生SCFAs.高纤维饮食降低艾克曼菌的定植.菊粉和阿糖基木聚糖可降低盲肠中艾克曼菌的定植,但在结肠中却有促进作用.然而,近期也有研究显示,连续16周食用全谷物食物的50名丹麦成年男女(含正常体重及肥胖者)均出现体重减轻和炎症因子(如IL-6和CRP)降低,但其肠道菌群多样性、肠道菌群功能和胰岛素敏感性并无显著变化[94].因此,针对类似食物与肠道菌群多样性的关系和作用机制,还需考虑其他多方面因素.
7.3.4 地中海饮食对肠道菌群的影响 世界卫生组织2019年公布的统计数据显示,同为亚洲的日本,其国民平均寿命全球最高,超过83岁,欧洲的西班牙名列第二,达82岁.除适宜的自然环境和较完善的医疗保健、社会福利等因素外,他们的饮食结构可能发挥重要作用.早在半个世纪前就有人介绍了地中海饮食(多果蔬类、不饱和脂肪酸类,少碳水化合物)对抵抗心血管疾病等的益处.西班牙人推崇地中海饮食,使用有益心脑血管健康的橄榄油,同时大量新鲜果蔬的摄入也对健康有很大裨益.近期爱尔兰研究人员针对西欧五国65岁以上的612名老年人的研究发现,食用1年地中海饮食者可增加肠道菌群多样性,改善运动和神经系统的衰老症状,缓解胰岛素抵抗、减少炎症因子[95].其他研究也证实了地中海饮食改善肠道菌群以及对人类健康的益处[96, 97].
日本人经常摄入的海产品、豆制品、生鲜果蔬和低盐饮食以及日常工作生活中的被动运动等均与他们的肥胖率低和长寿关系密切.海产品中含有丰富的不饱和脂肪酸DHA、DPA和EPA,这对减少心脑血管疾病及其急性事件的发生大有裨益.此外,琉球群岛中的冲绳是目前世界上超过100岁人口比例最高以及低肥胖、低糖尿病、低心血管疾病和低癌症死亡率的“蓝色区域”.这与当地居民日常低热量的长寿饮食之“冲绳饮食”有很大关系.它们主要为植物性饮食(如各色果蔬,包括姜、姜黄、艾蒿、甜土豆、红薯、海藻、大豆食品、绿茶等),其中碳水化合物、蛋白质和脂肪分别占总热量的85%、9% 和6%[98, 99].那么,同为亚洲人,中日两国居民的肠道菌群有何异同呢?相关领域的深入研究是有益的.
7.3.5 高盐饮食对肠道菌群的影响 研究发现,食盐是宿主肠道菌群构成的调节因子.长期高盐膳食也可导致肠道菌群失衡,影响宿主健康,与肥胖、代谢综合征等慢性炎性疾病的发生发展相关[100-102].高盐饮食可导致人肠道乳杆菌等有益菌明显减少,使肠壁促炎T辅助17(Th17)细胞及其活性增加,导致Treg/Th17失调,诱发结肠炎,并促发动脉炎症,诱发高盐性高血压[102,103].高盐饮食导致的肠道菌群的变化与食盐摄入量呈正比.停止摄入高盐饮食后,肠道固有菌群生态平衡得以恢复[102].动物实验发现乳酸杆菌KU4可增加小鼠血中乳酸水平,通过增加PPARγ-PGC-1α转录复合物活性,促进小鼠白色脂肪细胞棕色化,从而发挥抑制饮食性肥胖的作用[104].新近研究发现,人粪便盐度与宿主固有肠道嗜盐细菌的丰度和宿主肥胖有关,可能与艾克曼菌、双歧杆菌属(长和青春双歧杆菌等)以及菌群多样性减少有关[105].
我国居民尤其是北方居民,从日常饮食中摄取的盐总量(含“隐形盐”)成人日均达12 g左右,儿童也超过WHO建议的健康成人日均5 g盐摄入量的水平[106].目前针对高盐饮食危害人体健康的结论还存在争议,从目前国内外研究结果来看,不超过每日2 g的钠摄入量(相当于5g食盐),对肠道菌群多样性微生态的维持和宿主健康无疑是有益的.
7.3.6 限食对肠道菌群的影响 饮食显著影响肠道微生物群的多样性,饮食过度或极端节食这两种极端的饮食方式,均会对肠道菌群产生重大影响.研究表明,限食和其他益生菌可增加艾克曼菌的定植,适当限食与体重降低和寿命延长呈正相关.然而,有研究显示当限食后减重,其肠道菌群中合成丁酸的厚壁菌、乳酸杆菌和双歧杆菌明显减少[107].但这种变化是作为减重的原因,还是由于减重、热量限制或营养比率变化的结果,还需深入研究.同时,肠道菌群也可影响宿主进食.法国鲁昂大学Norris等发现,胃肠道细菌通过合成神经内分泌激素,与动物体内支配胃肠道组织的“肠道神经系统”互作,进而发挥控制宿主食欲的作用[81].在我国,高血糖、高胆固醇、高体重指数、环境污染、低果蔬摄入量以及不健康的饮食结构,是影响健康和寿命的重要因素.上述这些危险因素都与“吃”有着密切关联.包括我国学者在内的国内外研究均显示,热量限制可促进动物肠道有益菌的生长,并有延寿作用[108].总之,适当减少食物摄入量对人体健康和延寿是有益的,其中肠道菌群的作用到底占有多大比重以及作用机制,还需进一步研究.
总之,饮食、肠道菌群和人类健康之间的互作和相关性,受到多方面复杂因素的影响.儿时的饮食模式以及已建立的肠道菌群多样性、人的体质等因素可能决定上述三者间互作的程度和最终结果,从而影响人类健康.某些菌群对某些特定食物或食物成分具有偏好性,且菌群代谢产物以及肠道局部环境更有利于相关菌群大量繁殖生长.人体肠道菌群利用碳水化合物的特异性和偏好性及其与主要营养元素-主食之间的线性相关性的分子机制,还有待今后更多的科研工作予以阐明.
7.4药物对肠道菌群的影响有关药物对宿主肠道菌群构成的影响,目前主要集中在抗生素和抗癌药物与肠道菌群间互作的研究方面.使用抗生素虽然有助于清除体内细菌感染病灶,但同时也会在一定程度上扰乱肠道菌群,降低宿主对抗生素耐药微生物的抵抗力[109].研究显示,使用抗生素调节饮食性肥胖小鼠肠道菌群,可通过降低血循环中内毒素的水平和炎症信号,提高胰岛素信号敏感性[110].高脂喂养可改变小鼠肠道菌群多样性,使厚壁菌明显减少,而拟杆菌和疣微菌科细菌轻度增加.给予小鼠连续口服氨苄青霉素、新霉素以及甲硝唑8周后,其肠道菌群丰度降低,厚壁菌进一步减少,拟杆菌和疣微菌科细菌则基本消失,但变形杆菌丰度显著增加.此外,抗糖尿病药二甲双胍可促进肠上皮杯状细胞分泌黏蛋白,有利于肠道艾克曼菌的定植.
另一方面,抗生素治疗肠道感染影响肠道菌群多样性和丰度,可能引起条件致病菌过度生长.在治疗沙门氏菌引起的肠道疾病中,反复使用(口服或非口服)抗生素,如氨基糖苷类和β-内酰胺类,可以对病原体进行局部肠道靶向治疗.然而,这些抗生素会改变肠道菌群的平衡,导致某些条件致病菌过度生长[109].抗生素可使宿主尿液和粪便中结合雌激素和解偶联雌激素的量发生变化[70],而后两者影响肠道功能改变,从而影响肠道菌群结构.另外,妊娠晚期使用抗生素的孕妇其肠道普氏杆菌降低,子代易患食物过敏[111].基于肠道菌群从孕中期胎儿即开始出现,上述研究结果提示孕产妇控制使用抗生素以及采用维持最佳母亲肠道菌群的饮食,对后代健康的肠道菌群多样性建立的重要性.
此外,婴幼儿肠道菌群丰度下降等变化与其使用大环内酯类抗生素有关.在放线菌属、双歧杆菌和柯林氏菌属减少和胆盐水解酶的减少,而埃克瑟氏菌属、拟杆菌和变形杆菌增加,对大环内酯类药物的耐药性增加.而在停止治疗后两年仍可观察到与使用大环内酯类药物相关的微生物群落组成差异[112].针对人和动物的研究均表明,生命早期接受大环内酯类药物治疗的婴幼儿更容易出现哮喘和抗生素相关的超重,这与其肠道菌群微生态紊乱有关[113].表明使用大环内酯等抗生素导致肠道菌群变化,进而破坏宿主免疫系统发育,致使其对某些疾病易感,且这种生理紊乱可持续较长时间.前文提到人体肠道菌群最早定植于胎儿和婴幼儿阶段,且是否足月以及婴儿出生方式,显著影响其肠道菌群的构成.研究显示,早产儿几乎普遍接受抗生素治疗,而且经常采用延长抗生素治疗的方法预防婴儿感染,而抗生素导致肠道菌群丰度显著下降[114].我国儿童不合理使用抗生素现状较为突出[115],而包括抗生素在内的药物以及影响性激素水平的药物可影响肠道菌群多样性[52],与儿童肥胖有关[116].
7.5新冠病毒与肠道菌群相关性以及肠-肺轴自2019年末至今,波及全球的新型冠状病毒(SARS-CoV-2)大流行给各国经济和民生造成了极大地伤害和损失.新近研究显示,高达20%的COVID-19患者合并有胃肠道症状,而在50%的COVID-19病人粪便样本中可检测出了SARS-CoV-2[117,118].因此,目前除了常规的咽/鼻拭子应用于快速检测和诊断是否有可能被SARS-CoV-2感染之外,肛门拭子检测也被引入到规模化检测和筛选SARS-CoV-2感染检测中来,这说明SARS-CoV-2不仅可通过呼吸道传播和感染,还可被感染者“吃”入消化道中,并以活病毒或以其他形式排出体外.那么肠道中的SARS-CoV-2对人体健康和COVID-19发病有何影响?其对固有肠道菌群多样性有影响吗?
近期研究发现,SARS-CoV-2通过刺突(spike)蛋白与人血管紧张素转化酶2(hACE2)结合,而后者是SARS-CoV-2入侵人体细胞的关键受体,也是肠道菌群构成和肠道炎症的重要调节因子,其在大肠黏膜的表达量高于在肺组织中的表达量[119].因此,表达ACE2蛋白的细胞,均可成为病毒侵染的靶标,如肺和肠上皮等[120].中老年人存在一定程度的肠道菌群紊乱,柔嫩梭菌属、乳酸杆菌属细菌等有益菌比例下降,而产气荚膜梭菌属等有害菌增加,使肠道免疫系统的功能下降,无法有效遏制入侵病毒的繁殖,导致病情发展.中/重度COVID-19患者肠道菌群中条件致病菌增多,益生菌减少.疾病程度与厚壁菌门梭菌属的粪芽孢菌Coprobacillus属、多枝梭菌Clostridiumramosum、哈氏梭菌Clostridiumhathewayi丰度正相关,与普氏菌负相关.其中粪芽孢菌可显著上调ACE2在小鼠结肠中的表达[121].与此相反,两种最常见的益生抗炎菌-另枝菌Alistipesonderdonkii和普氏栖粪便杆菌Faecalibacteriumprausnitzii与COVID-19的严重程度呈负相关.此外,拟杆菌物种可能通过阻碍新冠病毒通过ACE2进入宿主,在抗击其感染方面具有潜在的保护作用.另有研究显示,肠道微生物组结构可能会影响宿主对SARS-CoV-2感染的敏感性和反应,肠道韦荣球菌科Erysipelotrichaceae细菌可能在增强宿主肠道感染SARS-CoV-2方面发挥作用[117,118,122].且这种菌群失调即便在病毒被清除之后依旧持续存在.随着COVID-19患者使用抗生素,半数病人肠道微生物群构成与健康对照组差异进一步扩大.图2总结了人体肠道菌群与SARS-CoV-2之间的关联[122].
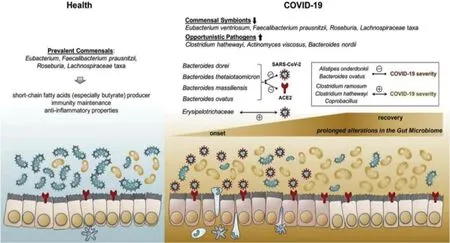
图2人体肠道菌群、宿主、SARS-CoV-2三者间的关联.在健康个体中,其肠道菌群中的有益菌(如真杆菌、粪便杆菌、紫罗兰和螺旋藻),产生SCFAs,发挥抵抗外源致病菌感染宿主的作用(左图).COVID-19患者的肠道菌群生态紊乱,条件致病菌增加,固有菌群减少(右图);其粪便中的粪芽孢菌Coprobacillus,多枝梭菌Clostridium ramosum和哈氏梭菌Clostridium hathewayi的数量与COVID-19的严重程度呈显著正相关,而抗炎细菌普氏栖粪便杆菌Faecalibacterium prausnitzii则呈负相关,并持续较长时间甚至在SARS-CoV-2感染恢复之后也是如此.SARS-CoV-2与人ACE2结合,使其出现感染该病毒之症状[122].
细菌在肠内产生的内毒素和代谢产物可以通过血液传播并影响肺部,同样,肺部的炎症会影响肠道内的细菌.在COVID-19重症患者急性呼吸窘迫综合征与肠道菌群之间存在联系[117,118,122].除此之外,小鼠研究发现,通过抗生素去除某些肠道细菌会导致肺部对流感病毒感染的敏感性增加.肠道细菌有助于调节免疫细胞的促炎和消炎反应,从而影响其对各种疾病的敏感性,平衡肠道菌群的组成对肺部免疫的有效性有重大影响,无肠道微生物群的小鼠已被证明肺部的病原体清除能力受损.当微生物代谢膳食纤维时,血液中SCFAs的含量增加,对肺过敏性炎症具有保护作用.因此,发酵的膳食纤维和SCFAs可以塑造肺部的免疫环境,并影响过敏性炎症的严重程度.
随着疫情的长期化和包括我国在内的一些国家取得阶段性抗疫之成果,SARS-CoV-2与人类“新宿主”之间的共生互作机制研究正在深入展开.遭遇了多次的疫情大流行,我们应该真正深刻反思、尊重地球上所有生命之间的共生共存、辅车相将之大自然的生命规则,以生命为本,为应对今后出现的新的高危害性病原体侵袭人类,提供有益的防治借鉴,方有可能避免重蹈此次SARS-CoV-2全球大流行灾难之覆辙.
7.6其他因素对肠道菌群的影响心理压力会增加儿茶酚胺类荷尔蒙(去甲肾上腺素和肾上腺素)的循环水平,它们通过清除铁或诱导产生自身诱导物来影响细菌的生长.去甲肾上腺素、肾上腺素和多巴胺使共生大肠杆菌显著增加[22].应激源暴露明显降低盲肠中拟杆菌的比例,增加梭菌属细菌的比例,改变盲肠菌群结构.应激源还可增加IL-6和单核细胞趋化蛋白1(MCP-1)的血中浓度,这与粪球菌、假丁弧菌和多利亚菌的比例变化有关[123].此外,运动也可对肠道菌群的多样性产生有益影响[22].与非运动组以及高BMI组相比,运动组的肠道菌群多样性和丰度增加,艾克曼菌丰度增加[124]. 总之,体内外多种因素均会对人体肠道菌群产生直接或间接的影响,同时肠道菌群又显著影响着人体生理功能的发挥,两者间形成互惠互利的命运共同体.
8 肠道菌群对人体的影响
肠道菌群本身、菌群多样性差异以及菌群代谢产物也直接或间接影响宿主的多种生理机能、心理特质以及疾病的发生发展[9,125].如植物中的纤维素和半纤维素类多糖无法被人体直接消化,而肠道菌群中的拟杆菌等细菌则具有一系列多糖消化酶,分解这些多糖,从而为人体提供能量.
8.1肠道菌群对肠道免疫的影响微生物组可作为宿主免疫系统的辅助器官,也可作为其自身免疫的增强器.在宿主免疫系统早期发育中受到肠道菌群的调节,并在一生中通过免疫系统不断塑造其肠道菌群[126].此外,免疫(尤其是自身免疫)的两性异形同样受肠道菌群的影响[77].肠道黏膜是人体一大免疫系统,在环境微生物在体内的定植、保护宿主肠道壁屏障的完整性等方面发挥重要作用.定植的厌氧菌、兼性厌氧菌可诱导肠道黏膜引起免疫反应,以抵御病原微生物的入侵,增强宿主的抗病能力,避免肠道受损害[18-21].正常人肠黏膜层在保护肠道壁完整性、微生物定植以及肠道免疫等多方面发挥重要作用.肠道菌群是sIgA的主要刺激源无论是共生菌还是外源致病菌均会刺激肠上皮浆细胞分泌sIgA.细菌定植在无菌动物肠道后,宿主即分泌防御素和sIgA,使肠道菌群的组成发生显著变化,梭菌属细菌的丰度降低,拟杆菌属和杆菌属增加,而肠内节丝状细菌则几乎消失,此时的黏液层结构转变为内外两层,菌群多样性等也趋于与正常个体基本一致[19],表明稳定的黏液分泌参与维持肠道微生态.
肠道黏液层环境改变可能会引发肠道疾病的发生.杯状细胞受多种因素影响,可导致黏液屏障完整性发生变化,如肠道菌群、微生物毒素、细胞因子、寡聚体黏蛋白2(Muc2)缺陷、肠道局部缺血都会刺激或抑制杯状细胞合成分泌黏液,改变黏液的化学组成或致使黏液层降解从而影响黏液屏障功能[126],导致细菌频繁渗透侵袭至肠上皮或隐窝,触发肠黏膜免疫反应,甚至肿瘤发生[127].Muc2缺陷小鼠肠黏液层变薄且通透性变大、肠道菌群数量增加,进而可导致小鼠肠道炎症和肿瘤发生[19].新近研究发现,人体肠道菌群可分泌胞外囊泡.肠道黏膜的物理屏障可限制200 nm以上大小的粒子通过,细菌不能通过.然而细菌胞外囊泡可以较自由地通过黏膜并被人体吸收,并与其他细胞交换基因、蛋白质等信息,促进骨骼形成、抗炎以及缓解抗药性等作用[128-131].
肠黏膜中存在大量的微生物,它们是病原体相关的分子模式(PAMPs)和代谢物的来源.PAMPs通过诱发膜结合模式识别受体(PRRs),如Toll样受体(TLRs)或胞质PRRs(如NOD-like 受体或 RIG-I-like受体)与宿主互作[132].TLRs是微生物与宿主间的关键调节因子,其在促进黏液形成方面发挥重要作用.细菌壁成分肽聚糖可通过TLRs信号通路维持紧密连接并减少细胞凋亡,从而促进肠上皮的完整性.其他的一些微生物成分也可通过肠黏膜TLRs通路,维持肠上皮内稳态和肠黏膜损伤后修复细菌代谢物,如SCFAs也会影响肠上皮屏障功能.丁酸盐为杯状细胞提供能量来源(图1),从而维持其分泌Muc2产物.丁酸盐吸收下降与肠道炎症和致癌作用相关[133].
此外,肠道菌群可通过促进肠免疫系统发育、诱导T细胞分化等多种途径调节机体免疫功能,维持其平衡状态,从而避免或减少免疫相关疾病的发生[111].过敏性疾病的发生与机体自身免疫系统发育不全、免疫调控失衡有关,而肠道菌群可影响机体免疫系统且过敏患儿体内菌群分布较健康儿童有差异,提示肠道菌群与儿童过敏性疾病的发生相关.有研究报道益生菌对过敏性疾病的防治有积极意义[3].
孕期母亲肠道菌群对刺激胎儿免疫系统发育具有重要作用.近期澳大利亚学者对该国1064名孕妇及其0~1周岁婴儿的研究发现,携带普氏菌孕妇的后代发生食物过敏的可能性较低,且该保护性作用在摄入高脂高纤维膳食的孕妇后代中更加明显[114].特定的肠道菌群可通过特定的分子模式诱导产生多种炎性细胞及炎性因子从而调节肠粘膜屏障的完整性,影响粘膜免疫功能,引起免疫性炎症.研究显示肠道内多种菌群可通过特定的分子机制发挥对机体的保护作用[134].例如脆弱类杆菌是肠道内带着荚膜的革兰阴性短杆菌,可通过其菌体成分荚膜多糖A活化并诱导IL-10产生Tregs,发挥抗炎作用.动物的适应性免疫系统与肠道菌群为相互共生和共演化的复杂关系.胎儿体中的抗体可从母亲转移而来,并影响胎儿免疫系统的发育和肠道菌群的定植.健康人肠道黏膜层上皮和固有层的固有免疫和适应性免疫细胞对肠道菌群和病原体具有高度敏感性,在不发生过度炎症的情况下,维持着肠道-肠道菌群间的微生态平衡.
在胎儿发育期,由淋巴诱导细胞演化而来的二级淋巴组织(淋巴集结和肠系膜淋巴结)和淋巴隐斑(Cryptopatches)细胞聚集体是肠道发育的相关位点,并支持神经血管的构建,这又促进树突状细胞、T和B细胞对微生物的免疫反应.婴儿出生后,更多细菌定植于新生儿肠道中,对其黏膜成熟和肠道淋巴组织的演化和功能产生影响.肠上皮中的构型识别受体识别 PAMPs和与肠淋巴隐斑相邻的树突状细胞刺激B、T细胞进一步分化,形成成熟的淋巴细胞,其释放可通过T细胞依赖和间接互作产生IgA的浆细胞到黏膜固有层.微生物也可通过M细胞穿过上皮进入淋巴集结,被位于圆顶区的树突状细胞吞噬.负载抗原的树突状细胞在Peyer氏斑与淋巴细胞互作,诱导T细胞分化和依赖T细胞的B细胞成熟后产生IgA的浆细胞,在固有层中释放二聚体IgA,并运输进入肠腔.树突状细胞介导的管腔微生物代谢物或跨上皮细胞的细菌的胞吞转运,使固有层树突状细胞负载抗原,通过传入淋巴管中的肠系膜淋巴结,诱导T细胞分化和转运.PAMPs刺激肠上皮细胞隐窝的增殖,导致小肠隐窝底部分化出的潘氏细胞(Paneth cells)密度增加,诱导抗菌肽AMPs的分泌[135].
宿主抗体的产生受肠道菌群的调节.SCFAs作为肠道菌群发酵膳食纤维的产物有助于宿主抗体反应.在B细胞中,SCFAs可以增加乙酰辅酶A并调节代谢传感器,从而增加氧化磷酸化,糖酵解和脂肪酸合成,从而产生能量和支持抗体生产的基础.同时,SCFAs控制基因表达以表达血浆B细胞分化所必需的分子.由于膳食纤维消耗减少或微粉蛋白缺乏症而导致SCFAs产生量较低的小鼠在稳态和帕氏原特异性抗体反应中存在缺陷,导致病原体易感性增加.然而,SCFAs的原纤维摄入可以恢复这种免疫缺陷.这些在人类和小鼠B细胞中均高度保守[136].
8.2肠道菌群对宿主营养吸收的影响大肠菌群以拟杆菌、双歧杆菌、梭菌和大肠杆菌等为优势菌种,合成各种复杂的消化酵解酶,通过糖酵解、磷酸戊糖以及厌氧分解等途径代谢糖类.复杂的碳水化合物经小肠消化吸收,成为简单的糖类.后者在大肠内被肠道菌群进一步发酵,产生SCFAs,以进一步消化或降解从胃和小肠转运来的未被消化的食物和食物残渣(复杂多糖、低聚果糖和蛋白质等)等剩余营养物质以及失去活力的菌群.它们可以一次或二次酵解,合成单糖、SCFAs、二氧化碳、氢气、甲烷等.大肠会吸收细菌代谢产物,主要为SCFAs以及氨基酸,通常可达整体膳食摄入能量的10%,一些菌群可以为宿主摄取更多能量.此外,通过多种途径,肠道菌群参与能量及脂类代谢,可促进肝脏脂肪酸和甘油三脂储存[137].而营养不良与肠道菌群多样性降低及其成熟延迟有关.如肠道菌群可直接调节宿主体内胰岛素样生长因子(IGF1)的水平,或其可不通过生长激素/IGF1轴,与人乳寡糖相互作用直接刺激生长[138].
8.3肠道菌群与肠-脑轴肠道菌群可通过迷走神经、内分泌、代谢和免疫系统参与肠道和这些系统的双向调节,在成长期影响婴幼儿大脑发育(图3)[139,140],并持续影响宿主的脑功能、心理和行为[140,141].肠道菌群失调可能引发肠-脑疾病(如肠易激综合征、炎性肠道疾病和肝性脑病)以及多发性硬化症、阿尔兹海默症和自闭症等中枢神经系统疾病.
肠道嗜铬细胞合成90%人体需要的抑制性神经递质5-羟色胺(5-HT),肠道中的特殊细菌参与了该合成过程.而5-HT的水平可影响睡眠障碍和情感障碍等自闭症谱系障碍(Autistic Spectrum Disorder, ASD)症状.我国学者新近研究显示,肠道菌群可以在抑郁症的病理生理中发挥重要作用.抑郁小鼠肠道菌群改变与下丘脑中神经递质和SCFAs变化的关系,应激使小鼠肠道菌群失调,主要表现为异杆菌属Genusallobaculum增加和瘤胃球菌科减少,之后通过调节肠道内SCFAs的水平导致下丘脑中去甲肾上腺素、5-羟吲哚乙酸(5-HIAA,单胺类中枢神经递质)和5-HT等神经递质水平的显著降低[141].

图3肠道菌群-肠-脑轴之间的相互作用,改编自文献[139,141].肠道菌群与人体多个关键生理功能轴有关.微生物-肠-脑轴的主要交互途径是迷走神经、免疫系统、下丘脑-垂体-肾上腺轴(HPA轴)、细菌代谢产物和肠内分泌细胞.肠道微生物能够产生各种代谢物,如神经递质或神经活性化合物、SCFAs、模拟肽序列和毒素等.这些代谢产物作用于肠内分泌细胞、迷走神经或通过肠上皮移位进入体循环.由肠道微生物群产生或改变的神经递质和神经活性肽可以释放至体循环,并可能影响宿主生理机能.通过 SCFAs 刺激肠内分泌细胞释放胆囊收缩素(CCK)、胰高血糖素样肽-1(GLP-1)和肽YY(PYY)等肠道激素,可增加脑奖赏系统不同区域的生长素(Ghrelin)、瘦素(Leptin)和胰岛素(Insulin)等激素的浓度.这些外周激素可能受到自身抗体与微生物模拟肽(如伴随蛋白ClpB,肠道细菌蛋白)相互作用的影响.在肠道微生物毒素如脂多糖存在的情况下,肠道上皮细胞的改变(如“漏泄肠道”)会产生影响.这种分子激活免疫反应,使炎症因子穿过血脑屏障,或激活迷走神经,改变大脑奖赏功能.PFC:脑前额叶皮层;NAC:伏隔纳克核;VTA:中脑腹侧被盖区.
此外,肠道菌群还可通过肠-脑-肝轴在碳水化合物代谢、神经内分泌调节以及免疫调节中发挥作用[142].肠道和肝脏通过门静脉、胆道和体循环相互沟通.肠道微生物和宿主代谢饮食中的碳水化合物、脂类、氨基酸和胆汁酸,所有代谢产物通过门静脉进入肝脏,影响其功能.迷走神经系统是中枢神经系统与神经系统之间的关键通道,迷走传入神经元表达肠肽(如CCK、Ghrelin、Leptin、PYY、GLP-1、5-HT等)受体.肠道菌群可通过调节这些受体来影响营养物质的代谢.与菌群-肠-肝脏轴有关的胆汁酸、SCFAs、氧化三甲胺TMAO和IgA被称为代谢调节因子.在无促炎因子水平升高时,口服空肠弯曲杆菌可激活小鼠迷走神经,神经元细胞中c-Fos的表达升高,高水平的吲哚(由肠道微生物群从色氨酸中产生的代谢物)可激活大鼠迷走神经.有些肝脏疾病与SCFAs水平的改变有关.如酒精性肝损伤小鼠的SCFAs浓度下降.此外,非酒精性脂肪肝(NAFLD)患者产SCFAs的肠道菌群丰度较高,粪便中乙酸盐和丙酸盐含量增加.此外,肝迷走感觉传入神经负责间接感受肠道微环境,将感觉输入传递到脑干孤束核,最终传递到迷走副交感神经和肠神经元.肠神经系统可以通过迷走神经与大脑连接,脑肠轴可以向大脑传递五羟色胺和多巴胺等物质.血清素主要由肠道菌群产生,通过血液循环影响宿主的中枢神经系统,其水平过低可能容易导致抑郁、冲动、自杀、攻击及暴利行为[143].
8.4肠道菌群与人体代谢轴
8.4.1 肠道菌群与血压 研究发现,SCFAs通过嗅觉受体78(Olfr78)和特异性短链脂肪酸受体(GPR41,G蛋白偶联受体),肠道微生物群合成的SCFAs可能在调控血压方面起到作用.SCFAs,尤其是丙酸盐可刺激肾脏表达Olfr78,介导肾素分泌.当给健康小鼠喂养丙酸盐后,其血压出现明显剂量依赖性下降,而Olfr78 敲除小鼠对这种效应更加敏感,提示Olfr78的正常功能具有提高血压和对抗SCFAs低血压的效应.而GPR41缺失小鼠对丙酸盐无反应.通过抗生素减少Olfr78敲除小鼠肠道菌群后,可导致小鼠血压增加,提示肠道菌群合成的丙酸盐通过Olfr78和GPR41调控血压[144].此外,如前文提到的高盐饮食通过改变肠道菌群生态平衡参与高血压的形成[107, 110].
8.4.2 肠道菌群与肥胖和糖尿病 肠道菌群与肥胖[143,145-147]以及代谢性疾病[148]等关系密切.如图4所示,肠道微生物与肠-脑轴的互作在肥胖及其相关疾病中发挥作用[143].由于不健康饮食等生活方式和日常压力等引起的肠道菌群改变与肥胖及其对情绪和认知的不良影响有关.食用富含纤维与蔬菜之健康饮食习惯可以增加肠道菌群的多样性,从而通过肠-脑轴促进肠道上皮完整性、免疫稳态和正常的中枢神经系统功能.相反,富含单糖和饱和脂肪的西方饮食模式可减少菌群多样性,促进炎症,并导致肠道渗漏综合征.这促进了革兰氏阴性菌的易位,从而增加了周围组织的炎症反应,并在中枢神经系统中产生神经炎症.而利用食用合理膳食(如益生菌、富含纤维素、益生元等),可通过恢复健康的微生物群及其在肠-脑轴中的调节作用,对肥胖和精神并发症产生正面影响.
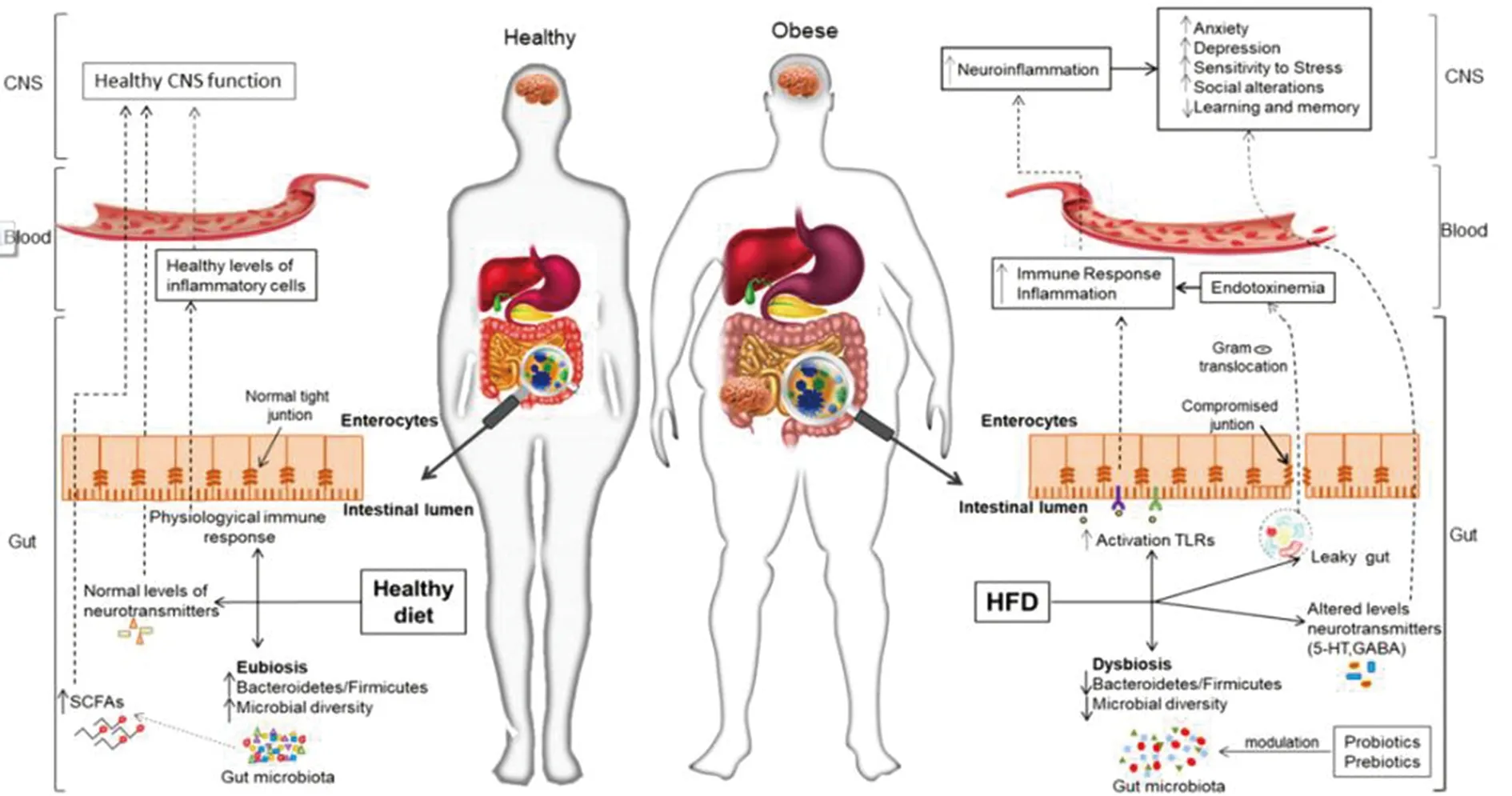
图4 肠-脑轴互作在肥胖及其相关疾病中的作用[143]
肠道菌群释放多种分子信号,并与宿主的多种组织器官互作.如图5所示,与肥胖相关的肠道菌群具有从饮食中获取能量、刺激结肠中的基因重编程、改变肠上皮内分泌细胞(肠嗜铬细胞,表达多种电压门控离子通道和多种受体蛋白)释放5-HT等多肽激素和其他生物活性分子、降低肠道屏障和扰乱免疫平衡的能力[146](图5右图).肠道微生物群也与宿主的脂肪组织、肝脏和大脑有联系.微生物群脂肪信号轴(图5左图).肠道菌群通过不同的机制参与脂肪生成的调节.LPS 引发免疫反应,伴随着炎症和免疫细胞浸润.SCFAs 还通过激活受体GPR43和 GPR41参与胰岛素介导的脂肪在脂肪细胞中的积累,这些受体抑制脂肪分解,促进脂肪细胞分化.肠-肝轴(图5中图).微生物菌群失调导致肠道对细菌性病原体的渗透性增加,包括LPS和乙醇.在肝脏,脂多糖通过刺激免疫细胞引起炎症.一些菌群代谢物,如胆汁酸、SCFAs 和TMAO,(多种慢性疾病的潜在风险因子)在NAFLD的发病中也发挥作用.
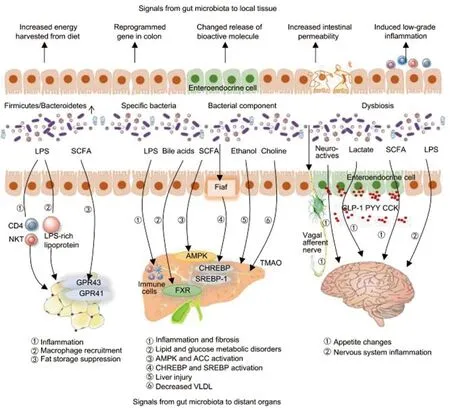
图5 肠道菌群与宿主组织器官互作、释放分子信号[152]
研究显示,正常体重儿童其婴儿期肠道双歧杆菌和柯林斯菌占比较多,而超重儿童则金黄色葡萄球菌较多[149].肥胖人群肠道菌群多样性明显少于体重正常人群[148].特定门类及功能基因也有较大差异.日本肥胖人群肠道菌群中拟杆菌显著减少[150].肠道菌群及代谢产物影响宿主饮食的消化吸收、体脂增加、胰岛素敏感性和食欲等[13, 151].另有研究显示,肥胖可能由细菌感染引发,而非过度饮食、锻炼少或遗传因素所致[108].胃肠道细菌具有通过影响多巴胺和神经肽控制寄主食欲的作用[152].此外,来源于肠道菌群的低水平LPS能通过炎症依赖通路引起肥胖和胰岛素抵抗,这一现象被称为代谢性内毒素血症.其中一种叫做阴沟肠杆菌(B29,又称为“肥胖细菌”)的肠道细菌是造成肥胖的直接原因之一.B29在肥胖者肠道中过度生长.肥胖的发展需要高脂饮食和B29的共同参与[108,153].
此外,肠道菌群与糖尿病也有关联[30,108,154].我国学者等针对国人的研究表明,T2DM患者肠道菌群失调,糖尿病前期患者有5个菌属及36个分类单元的丰度差异明显,如分泌丁酸的细菌丰度减少,而粪拟杆菌Bacteroidescaccae、哈氏梭菌、多枝梭菌、共生梭菌Clostridiumsymbiosum、蛋黄杆菌Eggerthellalenta和大肠杆菌等条件致病菌增加[153, 154].此外,硫酸盐还原型脱硫弧菌等增加,使肠道菌群对硫酸盐还原性和抗氧化应激作用增强.肠道微生物可能通过调控能量吸收和脂肪代谢、胆汁酸代谢、影响SCFAs产生、调节某些激素的分泌等多个机制影响着糖代谢.糖尿病人群肠道菌群中硬壁菌门、梭菌纲(Clostridia)的丰度明显下降,而β变形杆菌β-proteobacteria的比例增加,并且拟杆菌门/硬壁菌门、β变形杆菌的比例均随着血糖浓度升高而增大[30,113],这表明T2DM能够引起肠道微生物群落组成的显著变化,两者存在一定的关联性.然而,肠道菌群与糖尿病的关联机制依旧是今后的研究重点.
8.4.3 肠道菌群与血脂代谢 肠道菌群通过调控在脂质代谢中起重要作用的酶类和调控因子从而为机体提供能量、影响脂肪吸收.部分肠道菌群可产生胆固醇氧化酶、SFCAs,抑制肝脏脂肪合成酶,并且对血液和肝脏中的胆固醇进行重分布,促进肝脏利用胆固醇合成胆汁酸,转化或降解胆固醇,从而降低其水平.总体看来,肠道菌群对血脂的调节作用主要通过其对胆固醇代谢的影响来实现,主要方式是抑制胆固醇的合成与促进胆固醇的降解和转化.当肠道环境改变时,双歧杆菌、乳酸杆菌、产酪酸菌等正常菌群的生长受到抑制,而肠杆菌增多,造成肠道菌群失调,这种失调能导致血脂代谢的异常,而反过来血脂代谢的异常进一步加重肠道菌群失调,形成一个恶性循环.此外,肠道菌群可直接调节肠上皮细胞,导致机体三酰甘油蓄积,从而影响机体内的脂代谢.肠道菌群失调还可导致胆汁酸的合成和转化失衡,从而影响机体对脂质的消化吸收[148,154].
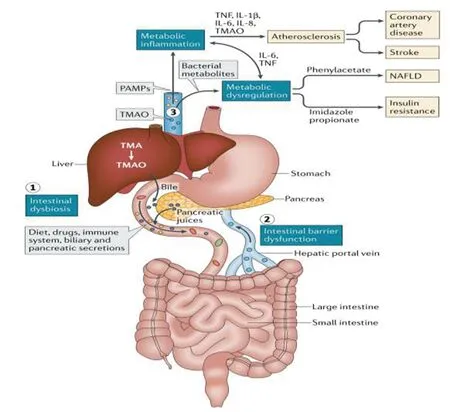
图6胃肠道损伤导致代谢性疾病.肠道菌群受宿主因素(如肠道免疫系统、胰腺和胆汁分泌物)以及环境因素(如饮食和药物)调节.西方饮食可改变肠道微生物的组成和功能.代谢异常可能是代谢性疾病的早期表现(①).肠道菌群失调和饮食因素可能引发肠道屏障功能障碍(②),进一步影响肠道功能.这些变化导致菌群代谢物的移位,如苯乙酸盐、三甲胺(TMA)、丙酸咪唑或代谢失调介质,以及病原体相关的分子模式(PAMPs),这些物质通过诱导IL-1等促炎因子导致机体慢性低度炎症,并使病变肝脏清除门静脉中细菌及其代谢物的能力受损(③)[148].
8.4.4 肠道菌群与肝脏 肠道菌群失调在人类肝病发病中起着重要作用(图5, 6),尤其是NAFLD及其相关的代谢紊乱.肠道菌群与肝脏的共生关系是由一个相互作用的网络来调控的,该网络包括代谢、免疫和神经内分泌之间的相互作用.肠道菌群紊乱造成肠道黏膜受损,肠道中产生的一系列细菌、细菌代谢物和环境毒素可能进入血液,通过门静脉到达肝脏,致使肝脏成为肠道细菌及其衍生物最易接触的器官之一,肠道细菌移位及其代谢物LPS通过门静脉系统进入血液和肝脏,刺激肝脏释放炎性因子,促进非酒精性脂肪肝与脂肪肝炎的发生[146,148].肠道及其肠道菌群是代谢性炎症及其调节失衡的驱动因素,是肥胖、2型糖尿病、非酒精性脂肪肝和动脉粥样硬化等代谢性疾病的关键特征[2,13,21,30,43],而代谢性炎症(IL-6和TNF增加)会导致脂代谢紊乱及相关疾病[155].近期华裔学者贾伟团队的研究发现,发现高脂饮食导致小鼠肠道中胆汁酸浓度上升、种类变化,从而快速改变肠道菌群结构.而宿主胆汁酸代谢水平的升高是形成肥胖型肠道菌群结构特征的主要因素之一[156].该研究揭示了胆汁酸代谢可能是宿主改变肠道菌群结构的一个重要机制,对胆汁酸的代谢进行干预和调整很可能成为预防和治疗肥胖和糖尿病的方法.
8.5肠道菌群对肿瘤的影响体魄强健人群的肠道有益菌比例达70%,普通人为 25%,便秘人群为15%,而癌症患者肠道内的有益菌的比例仅占10%.肠道生态系统影响抗癌免疫,肠道细菌参与T细胞免疫应答的形成,肠道菌群能控制人体对癌症治疗药物的反应.微生物抗原可能与肿瘤细胞相关的抗原发生交叉反应.肠球菌含有可调节免疫反应的噬菌体,在化疗或免疫抑制因子程序性死亡受体1(Programmed cell death protein 1,PD-1)阻断治疗后促进T细胞反应[32].噬菌体的存在与 PD-1免疫治疗后的存活率提高有关.该噬菌体肠球菌基因组中存在一种前噬菌体的尾长带测量蛋白(TPM)含有主要组织相容性复合体(MHC)I类结合抗原决定簇[157].携带这种前噬菌体的小鼠在用环磷酰胺或抗 PD-1抗体进行免疫治疗时,具有TMP 特异性 H-2kb 限制的 CD8+T淋巴细胞反应.在肾癌和肺癌患者中,粪便中存在肠球菌性前噬菌体和肿瘤表达TMP 交叉反应抗原与 PD-1阻断治疗的长期效益相关.在黑色素瘤患者中,T细胞识别与微生物肽交叉反应的癌抗原[158-160].PD-1免疫疗法应答者与不应答者的肠道菌群多样性和组成有显着差异,且两组患者肠道细菌的功能不同.应答者具有更高的α多样性和相对丰度的瘤胃球菌科细菌,其体内的合成代谢通路更为丰富,系统与抗肿瘤免疫力也更强[159].
针对转移性黑色素瘤患者免疫疗法的研究发现,治疗有效的患者体内长双歧杆菌Bifidobacteriumlongum、产气柯林斯菌Collinsellaaerofaciens、以及粪肠球菌Enterococcusfaecium丰度增加[158, 159].肿瘤患者对免疫检查点抑制剂(ICI)的抵抗可能是由于肠道菌群异常所致,而抗生素可抑制晚期癌症患者ICI的临床症状.那些无法从免疫疗法中受益的肺癌和肾癌患者,体内缺乏艾克曼菌[32].若将“有反应”和“无反应”的患者的肠道菌群移植入抗生素处理的小鼠肠道后,移植前者的小鼠对免疫疗法产生应答,而后者则无.而令后者再口服艾克曼菌则能重现免疫疗法的疗效.这些研究均发现在应答患者的肠道中有更多的有益菌.而无反应者肠道菌群紊乱,与免疫细胞活性受损有关[32,126].肠道菌群对免疫疗法的效果起到了关键作用.
研究显示,小肠上皮细胞炎症信号通路可促进大肠癌的发生.该通路中的钙调神经磷酸酶CaN及其下游转录因子NFAT在肠道菌群之肿瘤相关微生物和Toll样受体(TLR)互作后被激活,表现出活化T细胞核因子(NFAT)依赖性地维持肿瘤干细胞的增殖和存活,进而促进小鼠直肠癌的发生发展[160].此外,肠道拟杆菌属细菌可增强抗黑色素瘤药物伊匹单抗(Ipilimumab)与细胞毒性T淋巴细胞(CTLA-4)的结合,阻断后者与配体的互作,抑制T细胞活化、增殖,增强抗癌药的效果[160].近期研究还发现,从健康人群中分离出的11种低丰度的肠道细菌通过依赖于CD103+树突状细胞和主要组织相容性(MHC)la类分子的方式[157],稳定诱导产生干扰素IFN-γ的CD-8 T细胞,增强小鼠对单核细胞增生李斯特氏菌感染的抗性和免疫检查点抑制剂治疗肿瘤的效果[161].另外,艾克曼菌产生的SCFAs抑制小鼠结肠调节性T细胞中组蛋白去乙酰化酶(HDAC)的表达,激活哺乳动物雷帕霉素靶蛋白(mTOR)-核糖体蛋白S6激酶(S6K)和信号传导与转录激活因子(STAT3)通路.乳酸杆菌及双歧杆菌显著抑制核因子κB(NF-κB)的活化,并上调IL-10,抑制癌细胞增殖,双歧杆菌对T细胞介导的免疫反应有辅助增强作用,其细胞壁肽聚糖可增加TNF和IL-6的产生[163].此外,双歧杆菌DNA能激活树突状细胞,进而活化T细胞,提高机体免疫功能,抑制肿瘤细胞的生长[163].
8.6肠道菌群与骨代谢研究发现肠道菌群不仅调控肠道活动,并且能通过调节免疫系统影响骨代谢,其通过释放代谢产物与免疫细胞(如T细胞、B细胞等),刺激肠黏膜免疫系统,释放促炎或抗炎介质以及细胞因子,调节骨代谢.此外,肠道菌群还可通过调节内分泌影响骨代谢.人体与无菌小鼠实验研究发现,肠道菌群对骨代谢具有重要影响,利用抗生素、益生菌、益生元干预肠道菌群进一步证实了肠道菌群对骨量具有很好的调节作用[164].这些作用主要表现在迅速生长期以及骨量丢失较明显的妇女更年期.另有研究显示,肠菌代谢产物有 SCFAs、吲哚衍生物如血清素(5-HT) 、多聚胺、ATP 等.肠菌间接调节宿主产生的激素,如酪酪肽、GLP-1、IGF-1、瘦素和胃饥饿素,同时影响下丘脑-垂体-肾上腺轴[165].SCFAs 作用于宿主肝脏和脂肪组织,或通过脑垂体提高 IGF-1 水平,可能参与促进骨骼发育和代谢[166].此外,植物雌激素及膳食植物多酚对骨代谢的调节作用可能也是通过肠菌代谢活性产物实现的.
8.7肠道菌群与干细胞肠道菌群及其代谢产物与肠道干细胞、肠上皮增殖等也有密切关联.例如,可合成乳酸的肠道菌群(双歧杆菌和乳酸杆菌)通过分泌乳酸,经乳酸GPR81、Wnt/β-catenin信号促进小鼠肠道干细胞、潘氏细胞和杯状细胞的增殖[167].我国学者近期研究发现,紫绀型先天性心脏病患者(慢性缺氧),由于缺氧导致肠道微生物群落多样性改变,即乳酸杆菌丰度显著减少、D-半乳糖异常积累以及骨髓间充质干细胞早衰现象[168].而乳酸杆菌可纠正这些异常.提示慢性缺氧使骨髓间充质干细胞易于早衰,这可能是由于肠道菌群生态紊乱,从而使D-半乳糖积累所致.1型糖尿病导致的肠道菌群紊乱,抑制了脂肪间充质干细胞(Adipose-derived stem cells,ADSCs)改善胰岛功能的效果.
近期,北京大学一团队的研究显示,使用脂ADSCs同时令1型糖尿病小鼠自由摄取含氨苄西林(1 mg/mL)、甲硝唑(1 mg/mL)、新霉素(1 mg/mL)和万古霉素(0.5 mg/mL)的四联抗生素饮用水1周后,ADSCs的治疗糖尿病的效果得到增强[169].抗生素可减少患病小鼠糖尿病相关肠道菌群,但增加双歧杆菌属丰度、肠道内Muc2表达以及粘液层的厚度,而降低肠道通透性,并使菌群在胰腺的异位定植减少,胰岛素分泌增加.但何种菌群的异位定植导致这种作用尚不明确.然而,该研究结果似乎与目前认知的广谱抗生素破坏肠道菌群生态平衡,导致包括双歧杆菌在内的肠道菌群紊乱以及抗生素相关性肠源性疾病发生的研究结果相悖.精细的重复和大样本实验以及在人群中是否也能重现类似现象呢?这些都是需要进一步研究的.总之,肠道菌群与宿主的组织干细胞功能有关.肠道菌群对胚胎干细胞及其它类型干细胞的应先及作用机制,仍是今后研究的主要科学问题之一.
9 如何维持健康的肠道菌群多样性
综上所述,正常的肠道菌群多样性以及菌群代谢产物与人体健康以及治疗药物息息相关[170],而且肠道菌群的组成和结构在很大程度上取决于人们的日常饮食.因此,目前已知的通过维持健康的肠道菌群生态来减少人类疾病的策略主要包括以下几个方面:①坚持长期健康生活方式,多吃蔬菜、全谷物,适量增加膳食纤维.如红薯、笋、各类绿叶蔬菜、茄子、菌类食物、粗粮、豆类、藕类、山药、胡萝卜、番茄、黄瓜、冬瓜等瓜类、各类坚果、水果以及海带等,并保持饮食的一致性,维持健康的肠道内环境,促进益生菌的生长,抑制致病菌繁殖;②禁止滥用抗生素,减少食用抗生素喂养的肉类;③如果缺乏某些益生菌,可以针对性地适量补充,日常可多食用酸奶及益生元等;④适当的低强度运动,改善肠道蠕动与血液供应;⑤放松心态,减少日常工作、生活、心理压力;⑥保持良好、卫生的生活环境,多与健康、卫生的人待在一起.此外,一旦出现有些肠道菌群相关疑难疾病时,使用类似中国祖先发明的“黄金汤”(即食用健康人肠道菌群)也是一个选项.
10 肠道菌群的研究策略、问题与发展趋势
自21世纪开始,全球针对肠道微生物与人体健康相关性的研究才得到蓬勃发展.针对人体微生物、肠道菌群与人体健康相关性的研究取得明显有益的成果.肠道菌群分析是进行复杂微生态系统分析的基础,理解肠道菌群与宿主互作的分子机制的关键是结合人体组织样本、肠道菌群样品,结合体外培养、动物模型,采用生物化学、系统生物学和临床实验等手段开展综合深入的研究.其中,研究分离代谢物、纯培养物、体外培养物和模型动物的影响是理解微生物-宿主互作机制的必要途径[171].如何对肠道菌群丰度与数量及其代谢产物和宿主代谢产物(宿主-肠道菌群共代谢产物)变化特点,进行全面分析是开展肠道微生态与人体健康研究的关键问题.目前主要的研究方法包括以下几种.
一是基于分离、培养的常规方法,该方法较为成熟,依然被研究者采用.然而其仅能对部分菌群进行分析,且耗时、无法全面的分析对于种类和数量巨大的肠道微生态系统,分析的结果有局限性.二是基于高通量测序技术的发展,研究者可以通过对16S/18S/5.8S rRNA和28S rRNA基因间隔(ITS)序列的扩增,以及Metagenome分析技术,以获得庞大的数据信息,通过生物信息学手段,对其进行主成分分析(PCA)和主坐标分析(PCoA),得出不同样本间肠道菌群主要组成成分是否存在差异,并进一步通过冗余分析(RDA),找到与环境因子相关的微生物群落组成;三是质谱技术/组学技术.基于对细菌蛋白质分析的质谱技术具有在复杂体系中同时区分不同蛋白质和菌群以及宿主代谢产物等组分的特点,为肠道菌群的快速、准确、高通量的鉴别以及菌群代谢产物与宿主代谢等功能间的相关性研究提供方法[171,172].
肠道菌群与宿主相关性研究的大体思路如下:①明确个体肠道菌群的特征:采集健康与非健康个体之粪便样本分别代表两组肠道微生物研究材料,而肠粘膜样本代表肠粘膜定植微生物,通过比对物种数据库,得到物种丰度表,简单描述门、纲、目、科、属、种各个水平上物种丰度组成,以优势菌群组成情况为主;②研究菌群是否是引发疾病的因素:可使用动物(多为啮齿类动物)模型进行菌群移植,分为同笼饲养和无菌动物灌胃、灌肠等菌群移植方式;③找出疾病可能相关的生物标志分子:利用差异分析方法,找到疾病和健康对照组间显著差异的微生物,使用差异微生物构建疾病监测模型,或验证该微生物是否为引起疾病的主要因子.可通过分离该菌株,使用菌群移植的方式在动物模型中进行验证;④基于宏基因组基因组装,组装菌株.如使用操作简单、费用较低的16S rRNA测序比较健康对照与疾病组间的显著差异的操作分类单元(OTUs),进行初步筛选,为进一步深入研究提供依据.然后可使用宏基因组测序和数据组装其基因组.可获得肠道微生物基因、物种和功能信息,此方法广泛应用于肠道菌群功能挖掘以及菌群相关疾病发生机制或药物作用机制的研究等,但费用较高,覆盖更复杂生命集合体的部分不多.
我们推荐使用微生物学、系统生物学和多组学联合的方式分别针对菌群的种类、多样性变化规律、菌群代谢产物以及宿主代谢产物等多种指标精心比较分析,方可对肠道微生物与宿主生理和病理相关性以及作用机制方面,有一个较为全面的研究和认识.研究调节人体微生物组,尤其是肠道菌群与宿主间相互作用的关键菌株,了解其作用分子机制,对于合理调节和利用微生物群对提高人类健康品质是有益的.传统的基于分类学的分析方法忽略了菌株的特殊功能及它们之间的差异.通过饮食干预的纵向样品的宏基因组测序,组装出高质量的草图基因组,从而可对人类肠道微生物群的主要成员进行菌株水平的分析.为探究改变饮食的肠道生态系统,并确定特定菌株,多种互补的方法很有必要.通过对宿主和肠道菌群中的关键基因进行遗传操作,以阐明细菌-宿主互作中的分子机制,是菌群-宿主功能相关性研究的重要思路之一.
尽管目前国内外研究肠道菌群与人体健康的论文达数万篇,然而两者之间内在关联分子机制尚有待更深入展开.将菌群和宿主的共生互利关系看作为一种互惠共赢的命运共同体关系更为合理.肠道菌群结构和微生态紊乱如何引发疾病,疾病又反过来引起肠道菌群的变化的特征和机制尚不完全明晰.这就要求我们今后应该通过更加精细地、采集大样本人群、更广的年龄范围以及基于大数据分析技术等,开展分子机制的纵向和横向基础和应用研究,阐明相关分子机制,最终才能找到适合个性化干预和调控的对策,以求达到人与肠道菌群作为“命运共同体”之和谐共处、共存共荣的目的.通过了合理的饮食调控,加之适当的益生菌和益生元的使用,维持健康的肠道菌群生态平衡,才是今后个性化维持健康、防治疾病的有效手段.
此外,我们需要考虑的另一个问题是,为什么有些肠道微生物在数以万亿计的同类中能够成为主导,并对宿主产生重大影响?是什么让一些微生物一起工作,形成一个大的互惠共赢的生态系统?它们之间的关系是什么?更多了解肠道生态系统的动态变化和确定菌群生态学的关键驱动因素,对于制定针对肠道微生物的干预策略至关重要.
饮食是影响肠道微生物的基础,可有效改变微生物的结构和长期稳定性.明确“一方水土养一方人”与肠道菌群相关性之科学机制,很有意义.另外,也应该揭示肠道菌群性别差异与免疫系统、内分泌系统、肠-脑轴等重要系统相互作用的分子机制.这些研究的应用领域包括对于男女在对肥胖、糖尿病、老年痴呆症、自闭症、抑郁症以及诸多自身免疫性疾病等疾病易感性方面差异做出机制性解释,并基于这些差异优化诊治和预防措施.值得重视的是,菌群与人体这些调节系统是双向互作的关系,构成了复杂的网络.肠道菌群更是影响了肠-人体重要器官轴的功能互作.进一步的深入研究可望明确哪些菌群及其与宿主共代谢物和它们如何与宿主各生理系统功能间的互作分子机制.

