全固态锂离子电池固态电解质的研究进展
王丰玥,陆佳豪,迟浩然,魏 涛
(江苏科技大学能源与动力学院,江苏 镇江 212000)
传统的锂离子电池很难以高能量密度的金属锂作为负极材料,在充放电过程中,负极侧不均匀的锂沉积与固体电解质相界面(SEI)膜破裂等因素形成的锂枝晶,会刺穿隔膜,造成电池短路,引发安全问题。全固态锂离子电池被认为是电池技术取得突破的关键技术之一[1]。这是因为全固态锂离子电池采用的固态电解质(SSE)拥有足够的机械强度,可以防止锂枝晶的刺穿,且通常具有高于5 V的电化学稳定窗口,使得锂金属负极、高电压正极材料的使用成为可能,可获得更高的能量密度[2]。
与传统电池相比,大部分全固态锂离子电池在实际应用中会表现出更低的容量、功率密度及更差的循环性能。这些劣势与电极/电解质的界面问题存在密切关系,如松弛的物理接触、晶界的存在和副反应等因素,都会导致正负极两侧界面阻抗的增加。由于SSE与正负极材料之间固有的化学势不平衡,会自发地引发化学反应。这种反应将在负极侧形成一层电阻性的SEI膜,在正极侧形成一层正极电解质界面(CEI)膜,从而阻碍Li+在全固态锂离子电池内部的扩散与电荷转移。
1 固态电解质概述
SSE材料要有较高的离子电导率(σLi+>0.1 mS/cm,被称为“超离子导体”)、较差的电子电导率(σe<10-7mS/cm)以及良好的热/电化学稳定性。SSE通常可分为3类:无机陶瓷电解质(含硫化物和氧化物基等)、聚合物电解质和复合型电解质(陶瓷-聚合物复合型电解质)。硫化物基电解质有 Li10Ge P2S12(LGPS)、Li2S-P2S5系和Li7P3S11电解质等;氧化物基电解质有LiPON、钙钛矿型、NASICON型和石榴石型电解质等;聚合物电解质有聚氧乙烯(PEO)、聚偏氟乙烯(PVDF)、聚甲基丙烯酸甲酯(PMMA)和聚丙烯(PAN)电解质等[3-10]。
无机SSE具有较高的离子电导率σ和Li+迁移数(tLi+≈1),但由于存在硬脆性、制备难度大、与电极界面兼容性差等缺陷,难以得到应用。目前的应用方法主要有:借助于改进的电解质结构(3D微孔结构及三明治结构等)[11-12],作为添加剂用于聚合物电解质。
1.1 硫化物固态电解质
硫化物类材料由于离子电导率在室温下高达10-3S/cm以上而引起广泛关注,是SSE发展的一个热点方向。该类材料的高形变能力,使薄板型全固态锂离子电池可以借鉴使用黏合剂和有机溶剂的传统浆料铸造工艺制备。这些特点,加速了薄板型全固态锂离子电池的研发和应用。硫基电解质具有类似骨架离子为体心立方(BCC)结构的阴离子框架,离子导电性高于氧化物和聚合物基电解质,更有利于Li+的传输。与石榴石型电解质相比,硫基电解质正极侧的界面兼容性更好,离子电导率接近甚至高于常规液态电解质[13]。
在实际生产应用中,仍有很多亟待解决的难题。因为硫化物基SSE对空气过于敏感,且工业化生产成本过高,存在很多不稳定因素,如P或Ge的还原及S的氧化等。实际应用中,硫化物即使短时间暴露在空气中,也会迅速发生水解反应,生成H2S气体,导致离子电导率大幅下降。有研究发现[14],许多因素可以造成硫化物类材料产生不可逆的化学反应,使结构发生变化,导致离子电导率降低。硫化物类SSE材料的合成过程及相应电池的组装,均需在惰性气氛环境下进行,造成硫化物类电解质的研发及制造成本高昂。
针对上述问题,可以通过添加纳米氧化物颗粒如P2O5、ZnO或Bi2O3,来提高硫化物类电解质在空气中的稳定性,利用它们对H2S独特的吸附性,抑制副产物的生成,并从硫化物(如Li3.833Sn0.833As0.166S4)[15]中去除P。由于O的电负性高于S,研究表明[3,16],用O取代S可增强与阳离子的键合,提高电化学稳定性。将O引入Li2S-P2S5和一种具有Li+三维扩散通道的硫化物晶态电解质LGPS中,可提高SSE的电化学稳定性和全固态锂离子电池的低倍率循环性能[4,17]。
O取代S后,与Li+形成了更强的化学键,限制了Li+的移动,使电化学稳定性提高,但离子电导率明显下降,因此,在硫化物基SSE中引入O取代S,很难做到电化学稳定性与离子电导率兼得。常见的硫化物基SSE材料及离子电导率列于表1。
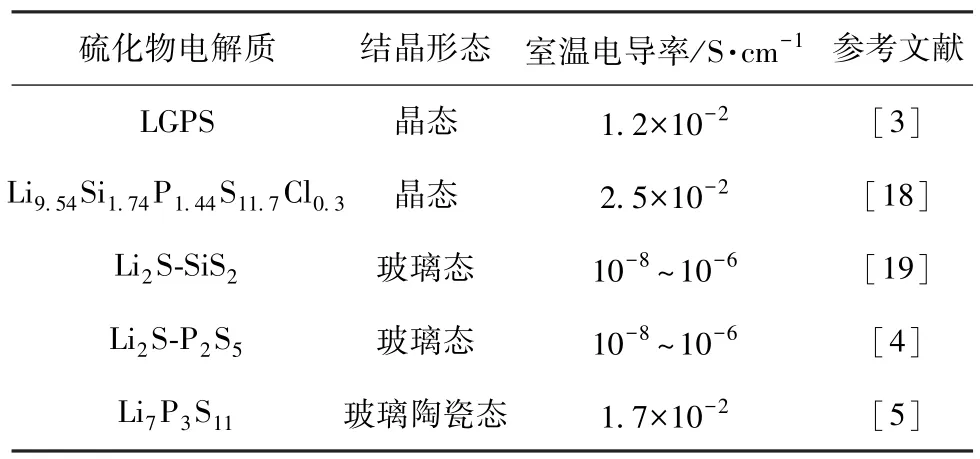
表1 硫化物电解质的离子电导率Table 1 Ionic conductivity of sulfide electrolytes
在部分研究中,未能从硫化物基SSE的循环伏安曲线中观察到氧化还原反应,因此,起初人们认为硫化物基SSE具有大于10 V的电化学窗口。近年来对硫化物基SSE的电化学性能研究和相关计算表明,硫化物基SSE在高于2.5 V(vs.Li/Li+)的电压时,容易被氧化分解。
1.2 氧化物固态电解质
氧化物SSE按物质结构可分为两类:晶态电解质和玻璃态(非晶态)电解质。晶态电解质包括石榴石型、钙钛矿型Li3xLa2/3-xTiO3、NASICON 型 Li1+xAlxTi2-x(PO4)3和 Li1+xAlxGe2-x(PO4)3等。玻璃态(非晶态)电解质包括反钙钛矿型Li3-2x氧化物SSE的优缺点如表2所示[20]。MxHalO(其中M为Ca2+、Mg2+等高价阳离子,Hal为Cl或I)和LiPON型等。

表2 氧化物固态电解质(SSE)的优缺点[20]Table 2 Advantages and disadvantages of oxide-based solid-state electrolytes(SSE)[20]
石榴石型SSE是研究较好的氧化物SSE之一。对比不同氧化物SSE(见表2)可知,石榴石型SSE具有两个独特的性质:对锂金属具有良好的电化学稳定性;电化学稳定窗口较宽。该材料可通过元素取代、添加烧结助剂、表面包覆和高温烧结优化等方法,提高离子电导率。分子动力学模拟计算可知,掺杂Ga的Li7La3Zr2O12(LLZO)的最大理论离子电导率可达6.08×10-3S/cm[20];在实验中,Li6.55Ga0.15La3Zr2O12的离子电导率在室温下可达2.06×10-3S/cm[22]。
其次,路线调整方面的隐患。由于道路与桥梁工程建设通常在露天环境下开展,因此会受到多方面外部因素的影响,在一些特殊情况下则需要对路线进行调整,而这恰恰带来了许多问题。例如,在进行路线调整时对工程项目现场情况掌握不全面,导致调整后的路线依据存在不合理之处,这样不仅会影响到路线的安全,同时也会是工程施工的成本出现增加。
NASICON型电解质在实际使用中表现出许多类似于石榴石型电解质的特性,如高离子电导率和较好的界面兼容性。NASICON型电解质材料在含有水分和CO2的空气环境中更稳定,但由于Ti容易被还原,导致对金属Li的电化学稳定性较差。用Ge代替Ti得到Li1+xAlyGe2-y(PO4)3(LAGP),可在一定程度上解决此问题,但会增加生产成本[23]。 为防止NASICON型电解质在负极侧被还原,可在Li金属和电解质之间构建一个缓冲层,或在LAGP中添加过量的Li2O等。
1.3 聚合物固态电解质
聚合物SSE是由高分子量的聚合物和锂盐组成的体系,如由聚氧化乙烯(PEO)或聚丙烯腈(PAN)和锂盐(LiClO4、LiC2F6NO4S2或LiTFSI)组成。
人们在发现PEO中Li+的输运机理后,将SSE材料的范围从无机盐材料扩展到有机聚合物基材料。与固体陶瓷电解质不同,聚合物电解质因较好的柔韧性和低廉的成本,成为SSE的热门选择。大规模应用的聚合物电解质需要具备的特点有离子电导率高和离子迁移数大、热和电化学性能优良、低成本和低毒性。大多数聚合物电解质都具有较低的离子电导率(见表3)、较小的离子迁移数及小于4.0 V的电化学稳定窗口。聚合物电解质在室温下易结晶,导致Li+电导率变差(室温下离子电导率仅10-6~10-8S/cm)的问题,阻碍了聚合物SSE的广泛使用。常见的改善方法以降低结晶度和增强锂盐的解离程度等为主。
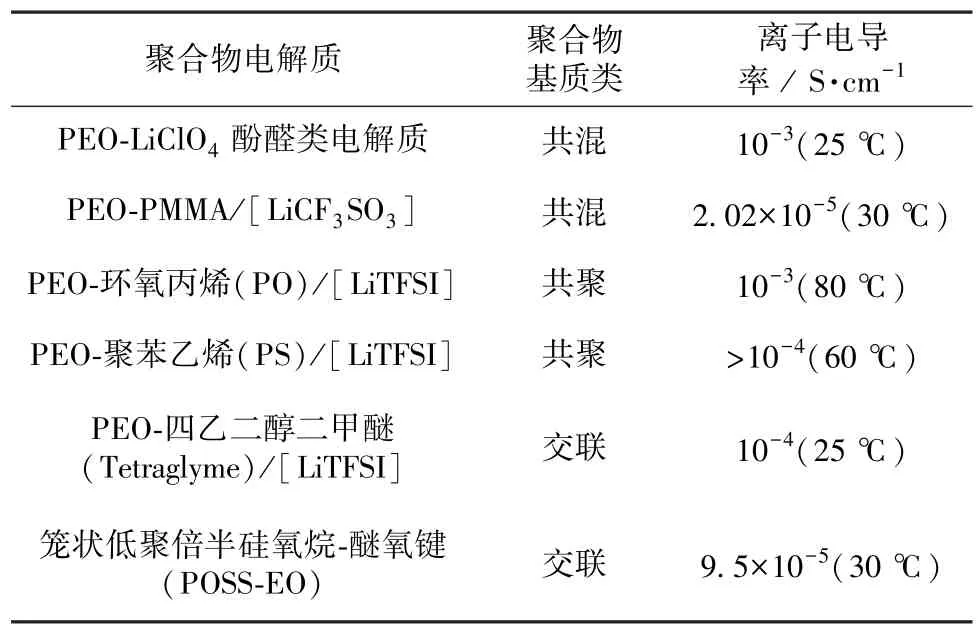
表3 聚合物电解质的离子电导率[24]Table 3 Ionic conductivity of polymer electrolytes[24]
虽然聚合物电解质并不完全是易燃的,但也存在安全隐患。常用的PEO易燃,且在电化学镀锂、剥离过程中,形成的锂枝晶易刺穿隔膜,导致电池短路,存在火灾危险。Y.Cui等[24]设计了一种防火、超轻的聚合物SSE。该聚合物SSE以多孔聚酰亚胺(PI)作为机械增强框架材料,添加阻燃剂十溴二苯乙烷(DBDPE)和离子导电聚合物电解质聚环氧乙烷/双三氟甲烷磺酰基锂(PEO/LiTFSI),以提高安全性。
1.4 复合固态电解质
陶瓷型电解质的离子电导率一般较高(>10-4S/cm),机械性能突出。由于自身的硬脆特性,陶瓷型电解质与固体电极的界面相容性较差,阻碍了商业化发展,特别是在柔性电池领域的应用,也阻碍了基于陶瓷型电解质的全固态锂金属电池短期内的商业化发展。将陶瓷填料加入聚合物基质中制得的复合型SSE,结合了陶瓷和聚合物电解质的优点,具有轻质、不易燃和柔韧性优良等特性,有望解决陶瓷电解质和聚合物电解质的弊端,或将成为实用的固体电解质之一。
与纯聚合物SSE相比,复合SSE的熔融温度和玻璃化转变温度更低。填料不仅可提高电解质的离子电导率和机械性能,还能改善电解质与锂负极界面的稳定性,主要有无机惰性、无机活性和有机多孔等。在聚合物电解质基体中,Li+的运动主要依赖于聚合物链段的运动,且游离的Li+浓度与Li+迁移数成正比,因此,在聚合物基质中加入陶瓷粉末,可降低聚合物结晶化,促进聚合物链段的运动。这些陶瓷粉体可改善在界面处Li+迁移的运输路径,进一步提高离子电导率[26]。J.Lu等[27]制备了基于PVDF-HFP聚合物和石榴石Li6.5La3Zr1.5Ta0.5O12的复合固体电解质。将 Li6.5La3Zr1.5Ta0.5O12粒子组装在松弛的聚合物链上,可提高局部链段的动态性能,室温下离子电导率为8.80×10-5S/cm。
常见复合SSE的组成及特点见表4[24]。
2 全固态锂离子电池内的多种界面
与液态电解质不同,SSE无法流动或渗透到电极材料的空隙中,导致粒子之间的物理接触性能较差。由于全固态锂离子电池中的所有组件都是固态,正极、电解质和负极之间的纯物理叠加会产生很多界面,包括正极/电解质、电解质/负极、正极/负极界面和集流体等。这些界面又可进一步分为空隙、通过化学反应或电化学反应形成的界面及晶界等。
有关以氧化物为基础的SSE的研究[28-29]很多,但硫化物SSE的全固态锂离子电池表现出更好的性能,并且不需要添加液态电解质。为此,主要关注全固态锂离子电池中硫化物电解质带来的界面问题。
2.1 空隙
在电池制造过程中,可以使用高压(≥370 MPa)来避免空隙的存在,但是距理想状态仍有很大的差距。在高压下,电极和电解质中仍然存在相当多的孔隙。通常,这种孔隙度的范围为10%~40%,具体取决于电解质和电极材料所受的压力及机械性能。在电池充放电过程中,由于锂枝晶的形成,导致电极粉化,也会形成孔洞。孔洞的存在,会导致以下问题:①阻碍Li+的扩散和电荷转移,产生高的接触电阻;②诱发锂枝晶的生长;③增大电池体积,降低全固态锂离子电池的能量密度[30]。
2.2 化学反应界面
当电极与SSE的化学电位不匹配时,两种材料一旦接触就会自发地发生化学反应,因此,SEI和CEI膜将分别在负极和正极侧形成。SEI/CEI膜是一个有益的钝化层,对Li+导电具有促进作用,同时可拓宽电化学窗口;但如果SEI/CEI是混合离子和电子导体(MIEC),膜的厚度将会持续增长,使全固态锂离子电池的库仑效率下降。目前的研究发现,用相对惰性的材料保护正极/负极,是一种可减缓电极与电解质之间自发化学反应的方法。
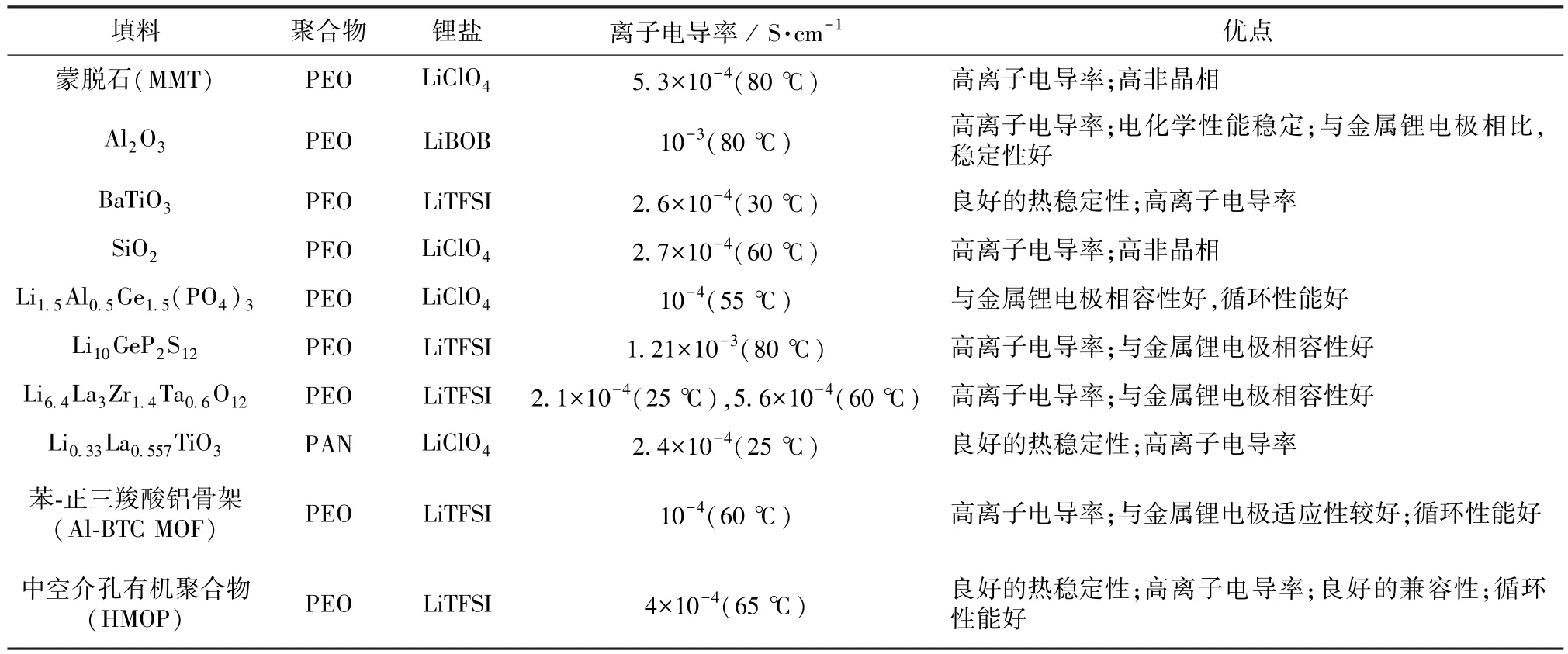
表4 复合固态电解质的电化学性能[24]Table 4 Electrochemical performance of composite solid electrolyte[24]
2.3 电化学反应界面
大多数SSE的电化学稳定窗口较窄,不能在正极和负极材料的全电压范围内工作。如果与电子导电材料(包括正极/负极材料、集流体和导电添加剂等)充分接触,则能在高压下氧化(或在低压下还原)。发生电化学分解的电解质会促进SEI/CEI膜的形成,增加界面电荷转移电阻。氧化物和氯化物比硫化物具有更宽的电化学稳定窗口。采用与之相匹配的窗口电压和具备减缓反应能力的耦合电极材料,均能降低SSE的电化学反应活性[30]。
2.4 晶界
当两个粒子接触时,如果具备不同的电化学电位,就会出现晶界。此时,Li+从一个粒子转移到另一个粒子,在转移前,界面上会留下一个Li空位的空间,极大地抑制界面上的离子传导[30]。
2.5 固态电解质的电活性界面
除了大的离子迁移数、高的离子电导率和合适的力学性能以外,SSE的另一个理想关键指标是:最高占据分子轨道(HOMO)应低于正极的电化学势;最低未占据分子轨道(LUMO)应高于负极的电化学势。如果正极的电化学势低于SSE的HOMO,则SSE在正极界面发生氧化,形成CEI膜;如果负极的电化学势高于SSE的LUMO,那么SSE的还原反应发生在负极界面,形成SEI膜。CEI膜或SEI膜的存在,将增大Li+扩散和电荷转移的阻力。
由于电池性能与界面电荷转移性能密切相关,调控SEI膜和CEI膜的电子电导率、离子电导率及力学性能,是构建更好性能电池的关键。这些性质,取决于材料自身的化学性质和空间分布。尽管SEI/CEI膜的形成增加了界面电荷转移电阻,但也可以通过多种方式钝化界面,如减少副反应的发生、减少离子溶解和调节电极体积变化引起的应力突变等,起到延长全固态锂离子电池循环寿命的作用[31]。与液态电解质不同,如果存在气孔和裂缝,SSE不能通过CEI/SEI膜渗透,因此SEI/CEI膜的力学性能在全固态锂离子电池中成为更重要的考虑因素。由于大多数全固态锂离子电池在使用过程中需要一个恒定的堆叠压力,SEI/CEI膜很可能会因电极体积的变化而产生额外的压力,导致破裂。这都是需要不断探索改进的研究要点。
3 结论与展望
本文作者通过对比分析各类型SSE的优缺点,介绍不同组分电解质的实际应用情况,并对全固态电池中存在的界面问题进行综述。综合来看,现阶段聚合物基的复合电解质和部分准SSE的开发,更接近商用水平,但仍存在阻碍全固态锂离子电池实际应用和商业化的问题。
①电解质的离子导电性较低。如陶瓷电解质材料的离子电导率一般为10-5~10-3S/cm,低于有机液体电解质的离子电导率(约10-2S/cm)。目前主要的改进方法有:使用硫化物电解质,对材料进行过掺杂、包覆等手段,以及利用应变效应和曲率效应等。
②电极与电解质界面的相容性较差。在初始充放电后,电极在嵌脱锂过程中的体积变化较大,导致界面处产生高的应力应变,因此固-固界面会产生高的阻抗。此外,在固态电池中,由于粉末压缩,金属锂与固体电解质之间的界面往往存在边界和空隙,难以形成良好的界面。为优化电解质的结构和组成,目前大多数研究仍在尝试阶段,例如,将密度泛函理论(DFT)计算与高通量材料筛选技术相结合,材料组合设计能高效地优化电解质结构和成分,也可通过构筑三维(3D)微孔结构来增加接触面积。
③系统设计和性能优化不足。在循环过程中,粗糙的界面可能导致分层或在界面间产生大的应变。电极与电解质界面功能分层的合理设计和选用,以及优化电极材料,仍有待探讨。使用实验和理论计算探究材料、电池系统的性能,是发展的必要条件。一些先进仪器如原位透射电镜等,对结构优化和性能的分析,可以监测充放电过程中的界面变化。

