林下栽培多花黄精的形态及光合特性比较
贺安娜,郭圣军,刘湘韩,伍贤进*,李胜华,何述金
(1.怀化学院生物与食品工程学院,民族药用植物资源研究与利用湖南省重点实验室,湘西药用植物与民族植物学湖南省高校重点实验室,湖南 怀化 418008;2.湖南新汇制药股份有限公司,湖南 长沙 410200)
多花黄精(Polygonatum cyrtonemaHua)是黄精属(Polygonatum)多年生草本植物,也是《中华人民共和国药典》规定的药材黄精的一种基源植物,其肥厚的根状茎是主要食用和药用部位,有补气养阴、健脾、润肺、益肾等功效,在新药研制和保健品开发等方面具有广阔的发展前景[1]。
为满足市场对药材黄精的需求,众多学者基于光合作用对其高产高效栽培模式进行了探索。袁名安等[2]对多花黄精光合作用的日变化进行了测定,得出光量子密度是影响多花黄精净光合速率的主要环境因子;骆绪美等[3]对多花黄精、长梗黄精、黄精的光合生理生态特性进行了研究,发现多花黄精较其他两种植物耐阴,为需光中性的草本植物;李迎春等[4]研究了多花黄精生长及光合特性,认为多花黄精在弱光环境中利用蓝光的能力强,具很好的耐阴特征。朱波等[5]研究表明大田栽培黄精时拉网50%的遮阴有利于生长;透光率60%的阴网下多花黄精的光合效率最高,有利于多花黄精产量的提高和品质的形成[6-7]。适当遮阴对多花黄精生长有利,林下透光率降低,对栽培复合系统中的小气候有明显的改善作用,可提高黄精叶片的光合速率,促进其地下茎的生长[8]。通过毛竹林下栽培多花黄精的研究表明,林内的立竹密度、坡位及采收季节对多花黄精地下块茎活性成分含量均有一定的影响,同时毛竹的鞭根和叶水浸液对多花黄精的生长还有促进作用[9]。
众多栽培尝试发现,林下栽培是大面积推广多花黄精种植最生态、经济的模式,林下栽培中光因子对植物的影响非常大,以往对多花黄精的研究中,透光率的下限限于40%左右,但课题组对黄精属野生资源的调查发现,多花黄精对光的适应性很强,从林缘至透光率极低的密林中均能生长良好。多花黄精是否能在透光率更低的林中栽培?林下环境中多花黄精对光因子改变所作出的适应性调节有哪些?本文选用广泛遍布南方的透光率适中的杉木林及透光率极低的楠竹林下栽培多花黄精,以田间无遮阴为对照,比较了在这些栽培模式下多花黄精的农艺性状、叶表皮特征及光合特性,以期为多花黄精林下栽培模式的选择和优化提供理论依据。
1 材料和方法
1.1 实验材料及种植
种植地位于湖南省溆浦县沿溪乡,属亚热带季风气候,雨量充沛,四季分明,海拔900—1 100 m,具有风力小,湿度大的气候特点。用照度计(美国LI-COR,LI-250A)测定光照强度,选择田间(透光率100%)、杉木林下(透光率约40%±5%)及楠竹林下(透光率约10%±5%)三类光照环境,种植土壤为有机质含量高的黑色腐殖土,实验地的距离不超过1 km。以多花黄精(Polygonatum cyrtonemaHua)种茎为材料,2019年12月种植于实验地,天旱时给田间栽培的材料适时浇水,林下套种的多花黄精不浇水。材料种植两年后,于2020年7月进行实验。
1.2 方法
1.2.1 农艺性状比较
测定不同处理多花黄精的株高(茎基部到地上部分最高叶片处的垂直高度)、茎粗(游标卡尺测主茎基部离地面1 cm处的直径)、叶长(沿主脉方向测叶尖到基部的长度)、叶宽(垂直于主脉叶片最宽的距离)、叶面积(单个叶片的面积,用美国LI-COR公司的LI-3000C便携式叶面积仪测定,SR.NO.PAM-3033)。每种处理取10株。
1.2.2 叶片表皮结构观察
配置好FAA固定液(38%甲醛5 ml:冰醋酸5 ml:70%酒精90 ml),在种植地随机采取多花黄精的叶片,剪成0.5 cm宽、1 cm长的小块,快速放入固定液中固定。24 h后,徒手撕取叶表皮,制作临时装片观察,用日本Olympus CX51显微镜(SN:6B 20930)拍照,Adobe Photoshop CS6测量显微数据。每种处理取10株的叶片。
1.2.3 叶绿素含量测定
随机采摘无病虫害的叶片,剪碎称0.2 g左右,用95%的乙醇研磨提取叶片色素,分别测定波长665 nm,649 nm和470 nm下的吸光值,参照公式:

计算出色素浓度(mg/L),依据植物组织重量(鲜重)、稀释倍数及定容的体积,算出色素的含量(mg/g)。每种处理3次平行实验。
1.2.4 气体交换参数测定
选择风和日丽的天气,于上午8:00至10:00用美国LI-COR公司生产的LI-6400便携式光合仪(SR.NO.PSC-1971)进行测定。数值稳定后,记录瞬时净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等。每组处理随机挑选成熟健康的叶片10片,取平均值,并计算标准误。
光响应曲线测定选择在晴天的上午8:00至10:00,叶片在自然光下适应1~2 h,设定红蓝光源的光强(PPED)梯度为0、20、40、60、90、120、150、200、300、500、700、1 000、1 200、1 500、1 800、2 000μmol photons/(m2·s),仪器自动记录净光合速率(Pn)等参数。每组处理随机挑选成熟健康的叶片10片,通过光响应曲线拟合软件(Photosynthesis v1.0)拟合得到暗呼吸速率(Rd)、表观量子效率(AQY)等光响应曲线参数。
1.2.5 数据分析
所测定的结果取平均值和标准误差,光合仪导出的数据用SPSS及Excel统计软件进行分析与绘图,不同处理间的数据采用Duncan新复极差法进行比较,显著性水平设置为α=0.05。Photosynthesis(光响应曲线拟合软件)v1.0绿色版拟合光响应曲线参数。
2 结果与分析
2.1 农艺性状
多花黄精的光适应性很好,由田间100%的透光率到楠竹林下10%的透光率都能正常生长,并顺利完成开花、结实的过程,但在不同的栽培条件下,形态发生很大改变。表现为,随光照程度降低,株高显著增加(表1),楠竹林下栽培的株高可达95.4 cm,是田间栽培植株的2.2倍,杉木林下的株高为田间栽培的1.5倍;茎粗也显著增加,楠竹林下的茎粗为0.72 cm,是田间栽培的6.5倍,是杉木林下栽培的2.5倍;随透光率的降低,多花黄精叶长、叶宽及叶面积都有所增加,其中叶长和叶面积在三组处理中的差异达显著水平,杉木林下多花黄精的叶宽略高于田间栽培,但两者之间没有显著差异,楠竹林下的植株叶宽显著高于其他两组处理。

表1 林下栽培多花黄精的农艺性状Table 1 The agronomic traits of P.cyrtonema Hua under forest cultivation
2.2 叶片表皮显微特征
多花黄精叶的上表皮细胞呈长方形,上表皮未见气孔分布;下表皮细胞为不规则型,气孔均匀的分布在下表皮,无护卫细胞,保卫细胞呈哑铃状,长轴与叶脉平行(图1)。不同栽培模式下多花黄精叶表皮的显微结构有差异,表现为,杉木林下栽培的上表皮细胞最长,林下栽培的细胞宽度增加,尤其是楠竹林下栽培细胞的下表皮宽度显著高于其他两类(表2)。随透光率的降低,气孔密度也逐步降低,三者均达显著水平的差异,气孔指数以田间栽培的最高,为27.9%,杉木林下栽培的最低,仅20.7%;杉木林下栽培的气孔偏小,长、宽均显著低于其他两者。

表2 林下栽培多花黄精叶表皮细胞特征Table 2 The characters of leaf epidermis of P.cyrtonema Hua under forest cultivation
2.3 叶绿素含量
多花黄精叶片的叶绿素含量随透光率的降低而升高,田间栽培组的多花黄精叶绿素含量显著低于两个林下栽培组,楠竹林下栽培组的总叶绿素含量可达3.053 mg/g·FW,田间栽培组的仅1.264 mg/g·FW,但杉木林下和楠竹林下栽培组的含量没有显著差异(表3),叶绿素a/b也没有显著差异。对不良环境有抵御作用的类胡萝卜素含量在田间栽培组中最高,楠竹林下栽培组次之,杉木林下栽培组含量最低,三者差异达显著水平。
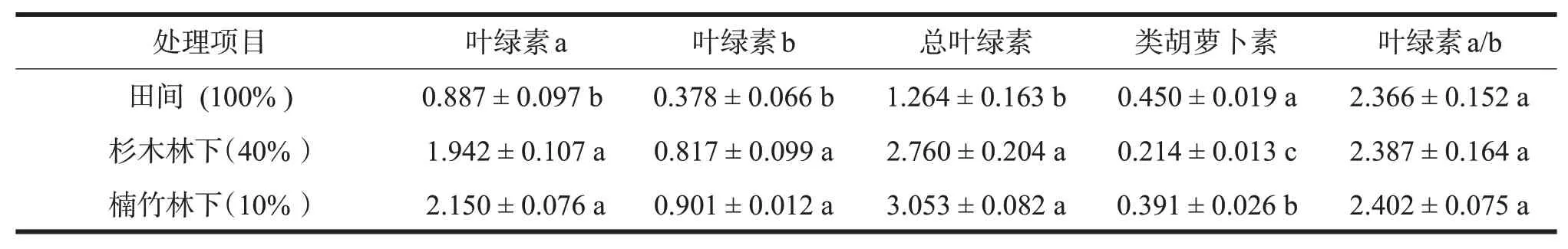
表3 林下栽培多花黄精的叶绿素含量(单位:mg/g·FW)Table 3 The chlorophyll content of P.cyrtonema Hua under forest cultivation(unit:mg/g·FW)
2.4 气体交换参数
田间栽培的多花黄精在高温强光的7月份长势较差,叶片出现发黄等逆境表现。气体交换测定数据显示田间栽培多花黄精叶片净光合速率Pn仅1.74μmol/(m2·s)(表4),显著低于林下栽培组,同时气孔导度也最低,胞间二氧化碳浓度最高,说明此时光合速率的降低不仅仅是气孔因子的限制,全日照下的高温和强光使光合作用的酶活性也降低了。为了避免高温给叶片带来的伤害,田间栽培的多花黄精叶片蒸腾速率有1.95 mmol/(m2·s),显著高于楠竹林下栽培组,导致水分利用率仅0.90 mol/(m2·s),植株极易发生水分亏缺。杉木林下栽培的多花黄精净光合速率、气孔导度及蒸腾速率均最高,楠竹林下由于透光率过低,净光合速率及气孔导度均不高,但胞间二氧化碳浓度也最低,说明此时净光合速率、蒸腾速率的降低是气孔因子限制,叶片生命活动正常,因此该条件下的水分利用率也高,为3.97 mol/(m2·s)。
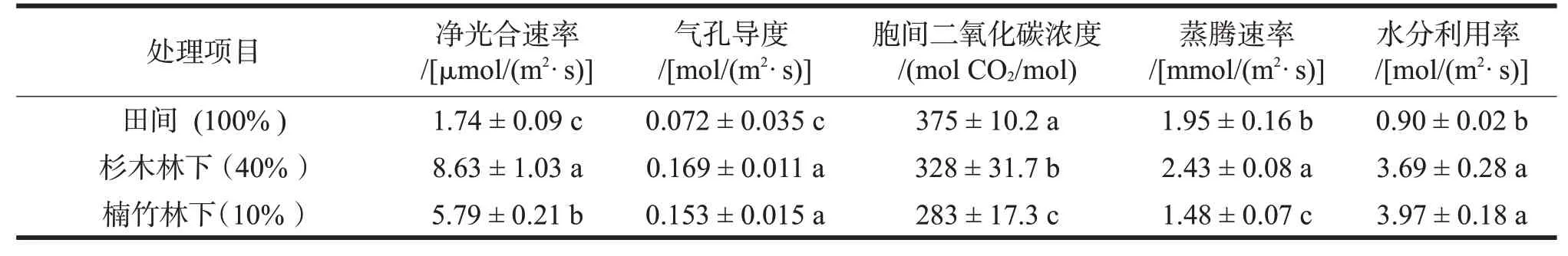
表4 林下栽培多花黄精叶片气体交换参数Table 4 The gas exchange parameters of P.cyrtonema Hua under forest cultivation
2.5 叶片光响应曲线比较
比较不同栽培模式下,多花黄精叶片光合-光量子密度响应曲线可知,光量子密度在200μmol/(m2·s)以下,净光合速率增加迅速,光量子密度在500μmol/(m2·s)以上时净光合速率增长趋缓,杉木林下栽培的多花黄精光响应曲线整体最高,田间栽培的整体最低(图2)。通过曲线拟合出的参数可知,田间栽培的多花黄精暗呼吸速率最高,表观量子效率、光补偿点也最高,说明多花黄精在该条件下利用弱光的能力最差;光饱和点也以田间栽培的最低,仅221.3μmol/(m2·s)(表5),最大净光合速率也最低,说明此时多花黄精对强光的利用能力也很差。透光率降低,多花黄精叶片的表观量子效率、光补偿点降低,即利用弱光的能力增强,光饱和点及最大净光合速率以杉木林下栽培的最高,分别为680.2μmol/(m2·s)和8.124μmol/(m2·s)。
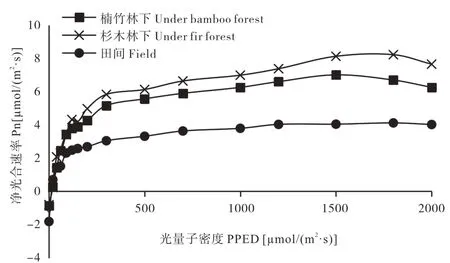
图2 林下栽培多花黄精叶片光合-光量子密度响应曲线Fig.2 The Pn(net photosynthetic rate)and light response curve of P.cyrtonema Hua under forest cultivation

表5 林下栽培多花黄精叶片光合-光量子密度响应曲线拟合参数[单位:μmol/(m2·s)]Table 5 Photosynthetic parameters fit by Pn and light response curve of P.cyrtonema Hua under forest cultivation[unit:μmol/(m2·s)]
3 讨论
植物的性状会表现出较大差异以适应变化的环境[10],在不同模式下栽培的多花黄精生长情况和根茎产量有明显差异,在郁闭度相同的林下套种,以山核桃和毛竹林下的多花黄精生长最好[11],本研究中选择的杉木林和楠竹林郁闭度有所不同,多花黄精的株高、叶面积在透光率低的环境中最高,这是对荫蔽环境的适应,长高和增大叶面积可吸收更多的光照。黄精属物种众多,有学者从形态上对这类植物进行了比较[12],其中叶表皮结构也是重要的区分依据[13],多花黄精在不同的栽培模式下叶表皮结构相似,上表皮细胞呈长方形,排列紧密,下表皮细胞形状不规则,气孔分布在下表皮,这些结构显示与龚力民等人的研究结果一致[14];李金花等人的研究发现,多花黄精叶表皮特征中的气孔大小、气孔器指数、气孔器密度受环境的影响较大[15],本研究的结果也表明,这些叶表皮特征在不同栽培模式下有显著差异,随林中光照减弱,多花黄精叶的上表皮细胞长度减少、宽度增加,下表皮的气孔密度降低,气孔减少可以降低叶片的蒸腾速率,提高水分利用率。
叶绿素是光能转化的关键,其含量的适当增加有利于捕捉光量子,但含量过高易产生过剩电子,破坏光系统导致光抑制[16],PS I的光抑制适应性在高光和弱光下也明显不同,总叶绿素含量的增加与PS I的易感性有关[17]。林下栽培对植物最明显的影响就是光量子密度改变,栽培在林下的多花黄精叶绿素含量都有所增加,尤其是倾向于吸收蓝紫光区的叶绿素b增加幅度更大,这样可有效捕获林中透过的较多蓝紫光,获得更多的光能;楠竹林下栽培的总叶绿素含量比杉木林下栽培的要高,但两者差异未达显著水平,而与逆境相关的类胡萝卜素含量此时显著升高,即过度郁蔽时,多花黄精可通过提高叶内类胡萝卜素的含量以抵御过度郁蔽环境。
光合作用是植物最重要的生理活动之一,对于作物而言,产量及药用植物的成分变化都与光合作用有关[18]。透光率100%的田间光照强、温度高,导致多花黄精叶片气孔导度降低,光合速率下降,为了缓解高温和强光对叶片的伤害,气孔密度增加,保持了一定强度的蒸腾速率,使得水分利用率极低,仅0.90 mol/(m2·s),光响应曲线也反应该环境下多花黄精叶片对弱光和强光的利用能力都较差。杉木林下透光率合适,该条件下栽培的多花黄精净光合速率最高,由于有较高的气孔导度,蒸腾速率也最高,由此降低了水分利用率;光响应曲线结果也表明,杉木林下栽培的多花黄精光合速率整体最高,拟合所得最大净光合速率最高。楠竹林下由于透光率过低,多花黄精的光合速率不能维持较高水平,但该条件下叶片气孔导度、水分利用率及拟合所得的最大净光合速率与杉木林下栽培的相比并没有显著差异,表明楠竹林下栽培的多花黄精光合作用能力并未受到破坏,当光强增加时,光合速率能很快提升,且光补偿点和表观量子效率降低,对弱光的利用能力还变强了。
由此可见,多花黄精在荫蔽的环境中可通过调节植株高度、叶片面积、增加叶绿素含量(尤其是叶绿素b含量)以捕获更多的光量子,降低气孔密度来减少蒸腾速率,提高了水分利用率。透光率极低的环境中,还可通过增加类胡萝卜素含量的合成来抵御不良光境,降低表观量子效率和光补偿点适应弱光环境,维持一定的光合作用,顺利完成开花、结果等生活史,说明多花黄精对弱光的适应性很强。但多花黄精的收获部位是地下茎,种植多花黄精要考虑地下茎的产量及药材的品质,不同林下的透光率对多花黄精块茎重量及药用成分含量的影响有待进一步研究。

