艾纳香不同提取物GC-MS分析及其抑菌活性
胡 璇,王 凯,于福来 ,王 丹,谢小丽,庞玉新 ,陈鸿发
(1. 中国热带农业科学院热带作物品种资源研究所/海南省艾纳香工程技术研究中心,海南 海口 571101;2. 广东药科大学中药资源学院,广东 云浮 527500;3. 海南艾纳香生物科技发展股份有限公司,海南 海口 570208)
0 引言
【研究意义】口腔的感染性疾病如龋齿、牙龈炎、牙周炎、牙龈脓肿、口臭等都与口腔厌氧菌致病密切相关,西药虽然能迅速缓解口腔不适症状,但长期使用易产生耐药性和不良作用。大量研究显示,许多中草药提取物具有较好的体外抑菌作用,又很少使病原菌产生抗药性,因此在控制细菌感染性疾病方面具有独特的优势[1-2],寻找天然、安全、对口腔细菌具有良好抑菌作用的中草药提取物是目前口腔疾病防治研究的重点。【前人研究进展】艾纳香为菊科(Asteraceae)艾纳香属(Blumea)植物艾纳香Blumea balsamifera(L.)DC.的新鲜或干燥地上部分,气味芳香,具有抗菌消炎、祛风除湿、清热解毒、清咽利喉的功效[3]。艾纳香作为我国传统中草药药品原料,主要分布于海南、贵州、广东、广西等省(区)。艾纳香油、艾粉和艾片均是艾纳香主要提取物,艾粉是艾纳香的叶和枝经水蒸气蒸馏提炼出来的粗加工品,作为原料前体物可进一步加工得到艾片,在精制艾片的过程中粗提物经压榨分离而得到的油即为艾纳香油[4],其中艾片是中华人民共和国药典收载品种,是常用药物天然冰片的来源之一,其含有的左旋龙脑成分为药典规定的唯一指标性成分[5]。查阅近年来艾纳香化学成分和抑菌相关文献,主要集中于黄酮类、艾纳香挥发油等提取部位的化学成分分析和大部分常见需氧菌的抑菌作用研究[6-7]。李安等[8]研究发现微波辅助提取的艾纳香油对5种受试细菌和真菌具有较强的抗菌能力,对真菌的抑制效果明显强于细菌,其中对黄曲霉的抑制效果最佳。Sakee等[9]采用圆盘扩散法和琼脂微稀释法评估艾纳香不同溶剂提取物的抑菌活性,发现艾纳香油抑菌效果最佳,对蜡样芽孢杆菌的MIC为150 μg·mL-1,对金黄色葡萄球菌和白色念珠菌的MIC为1.2 mg·mL-1。闻庆等[10]证实提取艾纳香油和艾片残留的艾渣不同萃取部位同样具有较好的体外抗菌活性,尤以三氯甲烷萃取部位对乙型溶血性链球菌和大肠埃希菌的抑制作用显著。【本研究切入点】目前,同时对艾纳香3种提取物进行综合GC-MS分析以及综合活性评价分析,并对其口腔常见厌氧菌的抑菌性的相关研究仍较少。【拟解决的关键问题】本研究对艾纳香叶的3种主要提取物艾纳香油、艾粉和艾片采用GC-MS技术分析其成分,并分别对4株口腔临床常见厌氧菌变形链球菌、具核梭杆菌、牙龈卟啉单胞菌、中间普氏菌进行体外抑菌活性研究,旨在为天然药用植物艾纳香的开发利用提供科学参考。
1 材料与方法
1.1 试验材料及仪器设备
艾纳香油、艾粉和艾片均源自贵州罗甸同批艾纳香药材提取物,经中国热带农业科学院热带作物品种资源研究所于福来副研究员鉴定均为菊科艾纳香属植物艾纳香Blumea balsamifera(L.)DC.的不同提取物。变形链球菌标准株(Streptococcus mutans,ATCC25175)、具核梭杆菌标准株(Fusobacterium nucleatum,ATCC10953)、牙龈卟啉单胞菌标准株(Porphyromonas gingivalis,ATCC33277)、中间普氏菌标准株(Prevotella intermedia,ATCC25611)均由成都里来生物科技有限公司分子生物检验室提供。兔血脑心浸出液肉汤(BHI)培养基(上海源叶生物科技有限公司),厌氧肉肝汤(北京索莱宝科技有限公司)。
7890A/5975C GC/MS联用仪(美国Agilent公司),XFS-280A手提式压力蒸汽灭菌锅(浙江新风医疗器械有限公司),SW-CJ-1F超净工作台(苏州广源净化科技有限公司),DNP-9052BS-Ⅲ电热恒温培养箱(上海申苗医疗器械制造有限公司),厌氧培养罐(日本三菱公司),Sartarius CPA225D电子分析天平[赛多利斯(北京)科学仪器有限公司],DU-800紫外-可见光分光光度计(美国贝克曼公司),SpectraMax Plus384酶标仪(美国Molecular Devices公司),氨苄青霉素(福州飞净生物科技有限公司,批号:181120),二甲基亚砜、95%乙醇均为分析纯(国药集团化学试剂有限公司),水为灭菌蒸馏水。
1.2 试验方法
1.2.1 艾纳香提取物化学成分分析 采用气相色谱-质谱联用技术(GC-MS)对艾纳香3种提取物艾纳香油、艾粉和艾片进行化学成分分析[11]。精密量取艾纳香油100 μL,精密称取艾粉和艾片50 mg,均用二氯甲烷溶解并定容至10 mL,过0.45 μm滤膜即得上机样品。GC条件:色谱柱为HP-5MS(30 m×0.25 mm×0.25 μm)弹性石英毛细管柱;载气为高纯氦气(99.99%),载气流量1.0 mL·min-1,不分流进样,进样口温度260 ℃,初始温度50 ℃保持1 min;以3 ℃·min-1升至200 ℃,保持5 min;以2 ℃·min-1,升至260 ℃,保持10 min。MS条件:离子源为EI源;离子源温度230 ℃,传输线温度260 ℃,MS四级杆温度150 ℃,溶剂延迟5 min,扫描范围20~450 amu,进样量1.0 μL。样品经气相色谱质谱分析,各分离组分采用NIST17谱库进行检索,并结合人工解析和参考文献分析确定各化学成分,相对含量采用色谱峰面积归一化法计算。
1.2.2 供试菌悬浮液的制备 将低温保存的标准菌株变形链球菌、具核梭杆菌、牙龈卟啉单胞菌和中间普氏菌各取50 μL接种至兔血BHI培养基中,划线使其能形成单个菌落,将接种平板放至厌氧箱中(80% N2,10% H2,10% CO2)培养3 d活化。然后挑取平板菌落接种至厌氧肉肝汤中培养72 h,紫外分光光度计测定菌液浓度OD600nm为0.5~1.0,检验纯度后用相应的培养液将菌液稀释成1×107CFU·mL-1的菌悬液备用。
1.2.3 药敏试验 将艾纳香油(油状药物)与95%乙醇进行溶解稀释,体积比为666.7 μL·mL-1,艾粉、艾片用95%乙醇分别配制成2 g·mL-1的基础药物溶液,试验前所有药液均用0.22 μm滤膜过滤除菌,采用管碟法进行测定[12-13]。按无菌操作法,吸取备好的4种厌氧菌菌液200 μL至BHI培养基表面,用无菌棉签涂布均匀,室温放置2~3 min,待平板表面菌液吸收后,将直径约为6 mm无菌牛津杯固定于培养基上,并标记好各药物的名称,每个培养基可放置3个牛津杯。再用移液枪在每个牛津杯中分别加各提取物药液50 μL,每个菌种重复3次,置37 ℃厌氧条件下培养3~5 d后,观察并记录抑菌圈的有无以及直径大小作为判断敏感度高低的标准,并用游标卡尺分别测量每个抑菌圈直径大小,取其平均值作为测定结果。结果判定按《药理实验方法学》标准[14]:抑菌圈直径<10 mm为抗药,10 mm为轻度敏感,11~15 mm为中度敏感,16~20 mm为高度敏感。
1.2.4 最低抑菌浓度(MIC)的测定 将“1.2.3”中艾纳香油基础药物溶液5倍稀释至133.34 μL·mL-1,艾粉和艾片5倍稀释至400 mg·mL-1。采用微量肉汤稀释法[15],取96孔微量板,在无菌操作下用移液枪向每排11孔各加入100 μL厌氧肉干汤培养基,再吸取100 μL稀释后的3种提取物药液至第一孔,以第一孔艾纳香油体积比为66.7 μL·mL-1、艾粉和艾片质量浓度为200 mg·mL-1作为起始浓度采用对倍稀释法稀释成相应浓度,第10孔中吸取100 μL弃去,此为试验组。吸取100 μL配置好的菌悬液依次加入第1~11孔中,充分混匀。第11孔不加试药,以便观察培养基是否适合菌株生长,为生长对照组,吸取200 μL厌氧肉干汤肉汤培养基加入到第12孔以便观察培养基否被污染。共4种口腔常见厌氧菌细菌(变形链球菌、具核梭杆菌、牙龈卟啉单胞菌、中间普氏菌),每种细菌3个重复。随后将96微孔板放置于37 ℃厌氧培养24 h。取出后采用酶标仪测定OD600nm,与阴性对照组比较,抑菌率达到80%的样品浓度就为该受试菌的MIC。氨苄青霉素(AMP)和95%乙醇作相同处理分别作为阳性药物对照和阴性溶剂对照。
1.2.5 最低杀菌浓度(MBC)的测定 采用琼脂培养基平板法[14],将MIC浓度及上下各一个浓度组的上述混合液各取出20 μL均匀涂布在的血平板相应区域内,厌氧培养48 h,观察有无细菌生长,以无菌生长对应相应孔中的最低浓度即为3种提取物对4种厌氧菌的MBC。
2 结果与分析
2.1 艾纳香提取物化学成分GC-MS分析
在“1.2.1”项条件下进样,得到艾纳香油、艾粉和艾片的总离子流图(图1)。所得3种提取物各组分的质谱数据经计算机检索标准谱库,采用峰面积归一化法测定了各组分的百分含量,将其进行分析比较,结果见表1~3。结果显示艾纳香油、艾粉和艾片经GC-MS分析分别鉴别出56、19和8种化合物(相对含量低于0.10%没有列出),已鉴定的成分分别占总峰面积的73.20%、92.25%和96.93%。3种提取物仅含有左旋龙脑1个共有成分,艾纳香油、艾粉和艾片中左旋龙脑相对含量分别为13.36%、81.40%和76.07%;艾纳香油和艾粉还同时含有成分silphiperfol-5-ene。艾纳香油的化学组分相对较为复杂,主要为萜类化合物,大部分为单萜和倍半萜类,少量二萜和三萜类,相对含量较高的有长叶烯-(V4)(13.45%)、左旋龙脑(13.36%)、合成樟脑(7.18%)以及缬草稀醛-4,7(11)二烯(7.66%)。艾粉和艾片中化学组分相对简单,大部分也以萜类化合物为主,左旋龙脑相对含量较高,分别为81.40%和76.07%,两种提取物中含量仅次于左旋龙脑的成分分别为左旋樟脑(8.27%)和右旋樟脑(20.53%)。

表1 艾纳香油中化学组成成分Table 1 Chemical composition of blumea oil
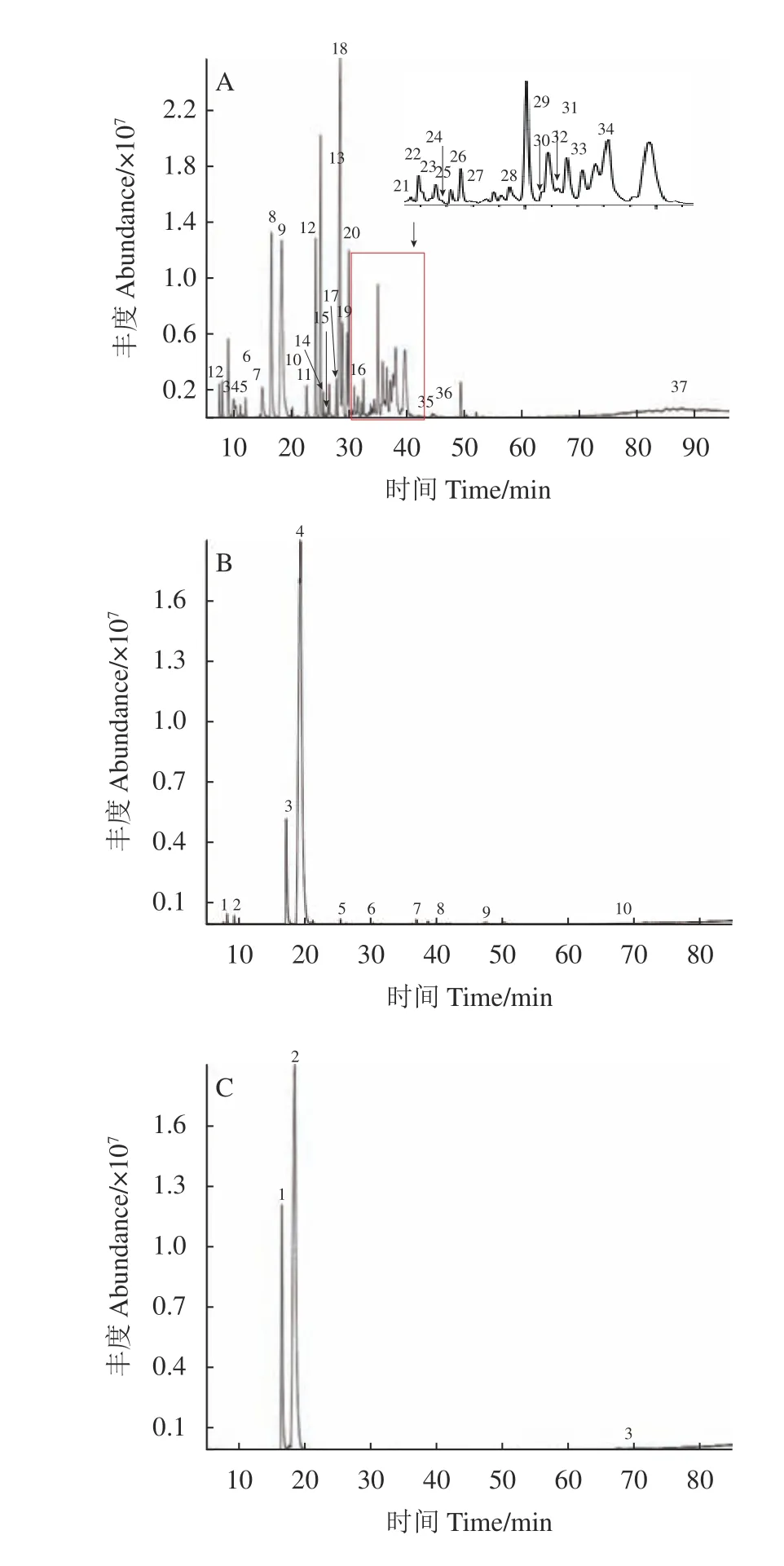
图1 艾纳香油(A)、艾粉(B)和艾片(C)的总离子流色谱图Fig. 1 GC-MS total ionic current chromatograms of blumea oil(A), blumea powder (B), and blumea camphor (C)
2.2 药敏试验
艾纳香油、艾粉和艾片对4种指示菌的抑菌圈直径见表4。由表4结果可知3种艾纳香提取物对变形链球菌、具核梭杆菌、中间普氏菌均有一定的抑菌活性,全部药敏牛津杯周围都出现了大小不等的边界清晰的抑菌圈,除牙龈卟啉单胞菌外,对其他菌株抑菌圈均大于10 mm,表现出一定的药敏性;3种提取物对牙龈卟啉单胞菌无明显的抑制作用,艾纳香油无抑菌圈出现,艾粉和艾片仅有一个重复出现了抑菌圈。由于艾纳香油是按照体积浓度进行试验,根据课题组前期试验结果和文献可知[4],艾纳香油与水的相对密度基本上接近1,按照密度进行换算可知其药敏试验质量浓度为666.7 mg·mL-1,相对于艾粉和艾片质量浓度(2 g·mL-1),其浓度相对较低,但表现出的药敏作用无明显差异,均属于中度敏感。由此可知,艾纳香油对中间普氏菌、变形链球菌、具核梭杆菌的抑菌敏感度强于艾粉和艾片。

表4 3种艾纳香提取物对4株厌氧菌的平均抑菌圈直径测定结果Table 4 Average antibacterial circle diameters of blumea products on 4 oral anaerobes
2.3 MIC值和MBC值测定
MIC和MBC结果中艾纳香油均按照水的密度进行换算,由表5结果可知艾纳香油、艾粉和艾片对4株口腔厌氧菌表现出不同程度的抑制作用,MIC在8.34~100 mg·mL-1,艾纳香油的抑菌和杀菌效果最强(MIC、MBC分 别 在8.34~16.68、33.35~133.4 mg·mL-1),艾粉和艾片的抑菌和杀菌效果并无明显差异。3种提取物对具核梭杆菌抑菌效果最佳,艾纳香油、艾粉和艾片的MIC值分别为16.68 mg·mL-1,50 mg·mL-1,50 mg·mL-1,MBC值 分 别 为33.35 mg·mL-1,50 mg·mL-1,50 mg·mL-1。艾粉和艾片对牙龈卟啉单胞菌、艾粉对变形链球菌、艾片对中间普氏菌的MBC值均大于200 mg·mL-1,杀菌效果均不理想。其中阳性对照药物氨苄青霉素(AMP)对4株厌氧菌表现出了强抑菌效果,阴性对照95%乙醇无抑菌作用。
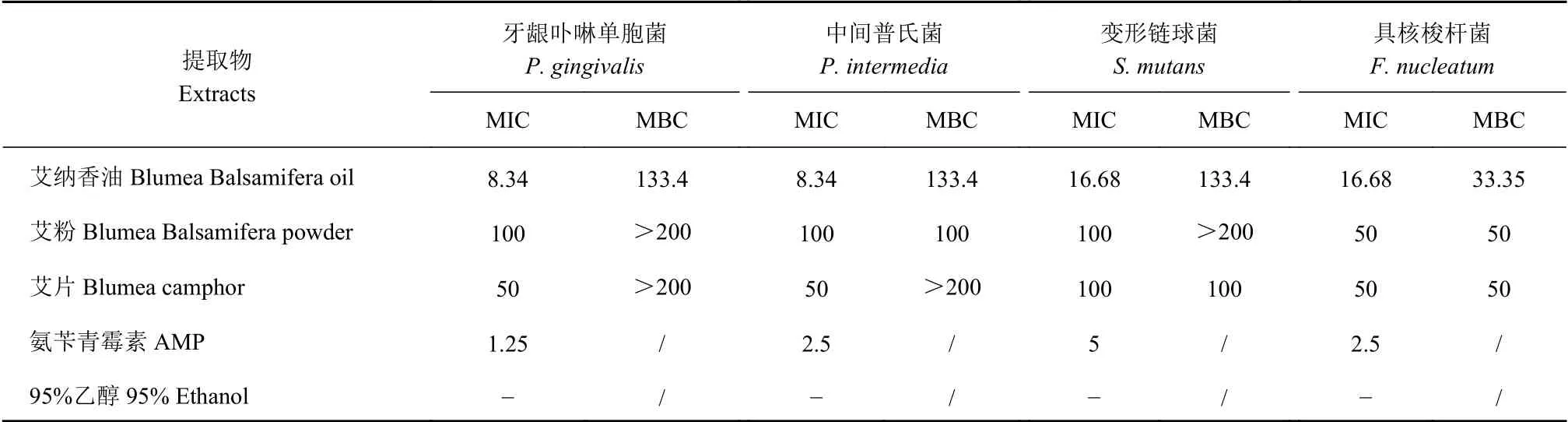
表5 3种艾纳香提取物对4株厌氧菌的MIC和MBC测定结果Table 5 MICs and MBCs of blumea products against 4 oral anaerobes (单位:mg·mL-1)
3 讨论与结论
由于口腔细菌耐药性问题使得中草药代替西药在口腔领域的研究越发迫切,近年来,在中草药抑制主要致龋菌、牙周致病菌等方面开展了大量的研究工作。研究表明,茶多酚[16]、黄芩[17]、五倍子[18]、厚朴[19]等中草药及其制剂具有良好抑制口腔细菌的活性,充分说明中草药来源的活性成分应用于口腔疾病的预防和治疗具有良好的开发利用潜力。艾纳香油、艾粉和艾片为中草药艾纳香中3种主要提取物,通常采用工业水蒸气蒸馏法可在同一工艺下获得。艾纳香油价格相对艾片较为便宜,鉴于其良好的生物活性,目前已被收录于国际化妆品目录中,艾纳油作为主要抑菌剂和抗氧剂广泛应用于日化用品中[20],而艾粉作为最初的粗提物,其应用相对较少。虽然艾纳香富含挥发油成分,但主要用途依然是精制天然冰片(艾片),在提取的过程中可得到艾纳香油和艾粉。目前艾片作为天然冰片的一种,价格极其昂贵,常用作“引药及佐药”,在心脑血管中成药中有较多与其配伍应用[21]。
表2 艾粉中各化学成分Table 2 Chemical composition of blumea powder (±s, n=3)

表2 艾粉中各化学成分Table 2 Chemical composition of blumea powder (±s, n=3)
序号No.化合物 Compounds 保留时间Retention time/min化学式Chemical formula分子质量Molecular mass相对含量Relative amount/%1 2-蒈烯 2-carene 8.05 C10H16 136.125 0.382 月桂烯 Beta.-myrcene 9.09 C10H16 136.125 0.323 左旋樟脑 l--camphor 16.47 C10H16O 152.12 8.274 左旋龙脑 l-borneol 18.49 C10H18O 154.136 81.405 Silphiperfol-5-ene 24.18 C15H24 204.188 0.226 1,1′-(4,6-二羟基苯)二乙酮 4,6-diacetyl-1,3-benzenediol 28.81 C10H10O4 194.058 0.137 silphiperfol-6-en-5-one 36.62 C15H22O 218.167 0.268 4′,6-二甲基-2-羟基苯乙酮 xanthoxylin 39.70 C10H12O4 196.074 0.189 (3S,3aS,6R,7R,9aS)-1,1,7-trimethyldecahydro-3a,7-methanocyclopenta[8]annulene-3,6-diol 47.39 C15H26O2 238.193 0.4110 2,2′-亚甲基双-(4-甲基-6-叔丁基苯酚)phenol,2,2′-methylenebis[6-(1,1-dimethylethyl)-4-methyl- 67.49 C23H32O2 340.24 0.14
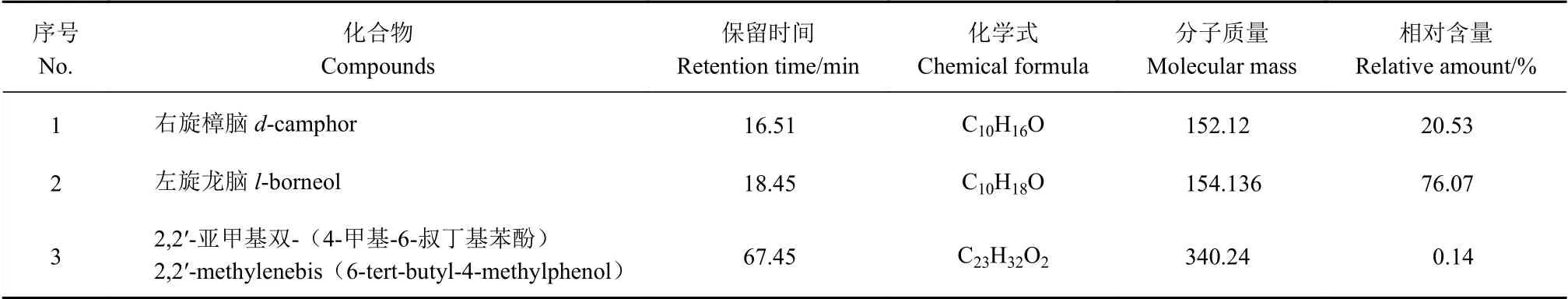
表3 艾片中各化学成分Table 3 Chemical composition of blumea camphor
艾纳香3种提取物应用不同,这与其提取工艺造成的化学成分差异具有密切的关系。艾纳香油虽然左旋龙脑含量最低,但是其化学组分相对较为丰富,其含有的β-蒎烯、樟脑、芳樟醇等活性成分,具有镇痛、消炎和抗菌等药理活性[4]。目前尚无相关文献对粗提物艾粉进行相关活性研究。本研究发现艾粉对口腔致病菌具有一定的抑制作用,后续加强对艾粉中多种成分的定性定量分析将有助于其生物活性的深入探讨。艾片中虽然化学成分相对较少,但是左旋龙脑含量最高,且纯度高。Yu等[22]研究发现左旋龙脑能增加皮肤透皮性吸收,提高血脑屏障及黏膜的通透性,故艾片对调节中枢神经系统和保护脑组织具有良好的效果。本研究中3种提取物对4株口腔厌氧菌均有不同程度的抑菌作用,艾纳香3种提取物中均含有大量的萜类化合物,萜类化合物往往具有较强的抑菌效果,据报道可知其中含量较高的左旋龙脑对多种致病菌都有抑制作用表现出良好的抑菌作用[23]。3种提取物中艾纳香油的抑菌效果最佳,充分说明各有效成分通过相同或不同的作用机制,或协同或拮抗最终产生的药效比单一成分产生的药效更为显著[24]。
本研究首次同时研究艾纳香中3种重要提取物对口腔厌氧菌的抑菌活性,3种提取物对具核梭杆菌抑菌效果最强,具核梭杆菌是牙周炎的主要致病厌氧菌之一,其产生的内毒素还能促发炎症微环境作用,同时与胃肠道肿瘤的发生有着密切的关系[25]。研究结果为后续艾纳香提取物在口腔领域的应用提供了一定的理论依据,但其对口腔致病厌氧菌的抑菌机制还有待于进一步研究。

