酒花内生菌Pseudomonas oryzihabitans F0-1转化柠檬烯生成α-萜品醇的研究
廉长盛,付冬梅,张俊鹏,张逸凡,薛兆茹,王 越
(大连工业大学生物催化技术国家与地方联合工程实验室,辽宁 大连 116034)
柠檬烯又名苧烯,是一种重要的功能性单萜,已被发现存在于300 多种植物中。柠檬烯是柑橘类水果加工的副产物,在橙皮精油中含量高达90%~95%。因其价廉易得,且化学性质活泼,被用作合成萜烯衍生物的前体,这些衍生物在食品、医药和精细化工行业中应用广泛[1-2]。
柠檬烯可以转化为含氧单萜化合物,相比于萜烯类化合物,含氧单萜具有更强的香气,且自然资源中含量少。如α-萜品醇,它是一种单萜类化合物,其在香料行业中的商业价值较高,消耗量约为每年9.2 t。α-萜品醇具有紫丁香的花香气味,在香水、化妆品和洗漱用品中通常用作香料[3-4]。由于其抗菌和抗氧化特性,在制药工业中也被用作抗真菌剂和消毒剂产品[3,5-6],并在食品工业中用作防腐剂,可用于调配柠檬、甜橙、桃子、柑橘等食用香精[7-9]。
研究发现,真菌和细菌能在有氧条件下对柠檬烯进行生物转化。Tai 等[10]利用Penicillium sp 转化柠檬烯,产物主要是α-萜品醇和少量的香芹酮和香芹醇;Rottava 等[11]从400 种微生物中筛选出能转化柠檬烯生成α-萜品醇的黑曲霉;Bicas 等[12]通过荧光假单胞菌Pseudomonas fluorescens 转化柠檬烯生成α-萜品醇。相比化学合成,微生物转化反应因操作简单、条件温和、高效率和高选择性、无毒、对环境友好,显示出广阔的基础理论研究和应用前景[13]。目前天然来源的化合物比化学合成的化合物具有更高的市场价值,因此,通过生物转化获得天然香料具有很高的市场研发价值[14-15]。
啤酒花是大麻科葎草属多年生攀援草本植物,是一种重要的香料和药用植物[16-18],其挥发成分酒花油中含有70%的萜烯化合物,包括单体萜烯如α-蒎烯和香叶烯,倍半萜烯如β-石竹烯和α-葎草烯等[19]。而酒花内生菌长期伴随植物生长,参与宿主的生长代谢,很可能会具备与宿主植株相似次生代谢的潜能[20-21]。因此,开发植物内生菌资源,将会为天然产物的合成提供新方案。本研究从酒花内生菌入手,筛选具有柠檬烯转化潜力的菌种,进行生理生化和分子鉴定,并优化生物转化条件,以提高酒花内生菌转化柠檬烯的转化率。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
野生新鲜酒花雌花果,摘自河北省秦皇岛;α-萜品醇标准品(>99%),内标物萜品烯-4-醇(>99%),阿拉丁试剂有限公司;柠檬烯(>95%),北京百灵威科技有限公司;次氯酸钠,乙酸乙酯(≥95%),乙醇(≥95%),甲醇(≥95%)和甘油(≥95%),科密欧化学试剂有限公司;琼脂粉、胰蛋白胨、大豆粉和植物蛋白胨,北京奥博星生物技术有限公司;NaCl、K2HPO4等分析纯,天津市大茂化学试剂厂;甘露醇,沈阳市试剂二厂。
1.1.2 培养基
1.1.2.1 分离培养基
水琼脂培养基(WA):琼脂粉18 g/L,pH 7.2±0.2。
酵母提取物琼脂培养基(TWYE):酵母提取物0.25 g/L,K2HPO40.5 g/L,琼脂粉18 g/L,pH 7.2±0.2。
甘露醇大豆琼脂培养基(MS):甘露醇20 g/L,大豆粉20 g/L,琼脂粉20 g/L,pH 7.2±0.2。
大豆酪蛋白琼脂培养基(TSA):胰蛋白胨15 g/L,植物蛋白胨5 g/L,NaCl 5 g/L,琼脂粉15 g/L,pH 7.3±0.2。
1.1.2.2 复筛培养基
甲醇0.1 g/L,(R)-(+)-柠檬烯4.5 g/L,NaNO33.0 g/L,KH2PO41.0 g/L,MgSO40.5 g/L,KCl 0.5 g/L,FeSO40.01 g/L和琼脂20 g/L。
1.1.2.3 LB 培养基
胰蛋白胨10 g/L,NaCl 10 g/L,酵母提取物5 g/L。
1.1.2.4 细菌基本培养基
葡萄糖5 g/L,(NH4)2SO42 g/L,柠檬酸钠1 g/L,MgSO4·7H2O 0.2 g/L,K2HPO44 g/L,KH2PO46 g/L。
1.1.2.5 营养培养基(NA)
牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L。
1.1.3 仪器与设备
GC9790Plus 气相色谱仪,浙江福立分析仪器股份有限公司;7890A/5975C 气相色谱-质谱联用仪,配EI 离子源,美国Agilent 公司;DB-FFAP 毛细管色谱柱,中科院大连化物所;SPME 专用磁力加热搅拌器,SPME-GC PK 1 固相微萃取手柄,北京康林科技有限责任公司;50/30 μm DVB/CAR/PDMS(二乙烯基苯/羧基/聚二甲基硅氧烷)萃取头,美国Supelco 公司;ZQZY78CNT 型振荡培养箱,上海知楚仪器有限公司。
1.2 方法
1.2.1 菌种的筛选及鉴定
1.2.1.1 菌种的筛选
先将新鲜酒花用流水冲洗,晾干,分别剪成根、茎、叶、花等部分。用75%酒精浸泡3 min,无菌水冲洗3次;用10%次氯酸钠浸泡5 min,无菌水冲洗3 次。在无菌条件下,分别将消毒处理的酒花花茎、花轴、苞叶和花朵(包含蛇麻腺)部位切成1 cm×1 cm 的小块,均匀置于分离培养基上,37 ℃培养。
将4 种分离培养基分离获得的菌株转接至LB琼脂培养基,培养24 h,划线纯化菌株。采用感官评定法对产香内生细菌进行闻香筛选。
将菌株经过液体LB 培养基活化,按照5%接种量接入到复筛培养基中(250 mL 具塞磨口瓶),30 ℃,200 r/min 条件下恒温振荡培养。转化72 h,利用固相微萃取-气相色谱-质谱连用(SPME-GC-MS)检测转化产物。
1.2.1.2 菌种的鉴定
形态学特征初步鉴定:对菌落形态特征、颜色、大小、革兰氏染色等进行观察。生理生化试验鉴定参照文献[22]。
分子生物学鉴定:提取筛选菌株的DNA 进行16S rDNA PCR 扩增。利用16S rDNA 的1492R 和27F通用引物进行PCR 扩增。测序由吉林省库美生物技术有限公司完成。测序结果在GenBank 数据库系统中进行基本局部比对,采用MEGA 7.0 软件构建系统发育树。
1.2.2 萜烯物质SPME-GC-MS 分析方法
固相萃取条件:将发酵液在4 ℃,8 000 r/min 条件下离心10 min,吸取5 mL 上清液移入固相萃取样品瓶中。加入2 g NaCl 促进样品挥发,将样品瓶放在固相萃取仪上,温度60 ℃,转速160 r/min。推出SPME 萃取头的纤维,吸附30 min 后,插入GC 进样口解析5 min。
气相色谱条件:色谱柱为DB-FFAP 毛细管色谱柱(30 m×0.25 mm×0.5 μm),载气为氮气;升温程序为:柱初温45 ℃,保持1 min,以5 ℃/min 升温至120 ℃,保持2 min,再以5 ℃/min 升温至250 ℃,保持10 min。分流比为5∶1。
质谱条件:离子源温度220 ℃,电离方式EI,电子能量70 eV,扫描范围(m/z)100~420。
定量分析:采用内标法进行定量,α-萜品醇标准曲线如下:
y=0.635 6x+0.201 2,R2=0.997 4
式中:x 为α-萜品醇与内标浓度比;y 为α-萜品醇与内标面积比。
1.2.3 生长时期及转化时间的筛选
为了考察细菌培养基对Pseudomonasoryzihabitans F0-1 菌株在不同生长期转化柠檬烯生成α-萜品醇的影响,将菌株分别接种到NA 培养基和细菌基本培养基中,定时测定菌液在波长为600 nm 下的光密度值,以OD 值为纵坐标,培养时间为横坐标,绘制菌株在NA 和细菌基本培养基中的生长曲线。
根据测得的生长曲线,在30 ℃,200 r/min 转化培养基中培养内生菌F0-1,分别在各生长时期加入柠檬烯,定时取样。按照“1.2.2”中的方法检测α-萜品醇浓度,考察不同生长时期及转化时间对内生菌F0-1转化柠檬烯生成α-萜品醇的影响。
1.2.4 共溶剂种类的筛选
为考察共溶剂对F0-1 菌生物转化的影响,分别配制20%的(R)-(+)-柠檬烯/共溶剂混合溶液。将混合溶液添加到在NA 培养基中培养38 h 的F0-1 菌液内,培养条件为30 ℃,200 r/min,共溶剂分别为乙酸乙酯、乙醇、甲醇、甘油。转化12 h,检测α-萜品醇浓度,对照为不加共溶剂。
1.2.5 底物浓度的筛选
为了考察F0-1 转化柠檬烯的最适浓度,将F0-1菌培养24 h 后,分别加入440、880、1 760、3 520 mg/L R-(+)-柠檬烯,生物转化12 h 后,测定α-萜品醇浓度,筛选适宜的底物浓度。
1.2.6 转化条件的筛选
1.2.6.1 转化温度
为考察温度对F0-1 转化的影响,采用不同转化温度(10、20、30、40 ℃),菌种在200 r/min 预培养38 h后,加入20%的(R)-(+)-柠檬烯/乙醇混合溶液,转化12 h 后,检测α-萜品醇浓度,筛选适宜的转化温度。
1.2.6.2 pH
为考察转化体系中pH 值对F0-1 转化柠檬烯生成α-萜品醇的影响,用0.05 mol/L 的柠檬酸磷酸缓冲液调节转化培养基pH 为3.0~8.0。菌种在30 ℃,200 r/min 预培养38 h 后,加入20%的(R)-(+)-柠檬烯/乙醇混合溶液,转化12 h 后,检测α-萜品醇浓度,筛选适宜的pH。
1.2.6.3 转速
为考察转速对生物转化的影响,将F0-1 菌种在30 ℃,200 r/min,pH 6.0 条件下预培养38 h 后,加入20%的(R)-(+)-柠檬烯/乙醇混合溶液。分别采用0、100、200、300 r/min 进行转化,转化12 h 后,检测α-萜品醇浓度,确定最佳的转速。
1.2.7 数据处理
使用Execl 软件处理数据,使用MEGA 7.0 构建系统发育树。
2 结果与分析
2.1 菌种的筛选及鉴定
2.1.1 酒花内生菌的筛选
将消毒处理过的酒花的花茎、花轴、苞叶和花朵(包含蛇麻腺)部位分别在4 种分离培养基(WA、TWYE、MS、TSA)中恒温培养,共分离出22 株产香内生细菌,其中通过WA 培养基分离出2 株细菌;通过TWYE 培养基分离出14 株细菌;通过MS 培养基分离出6 株细菌;通过TSA 培养基没有分离出微生物。
经过复筛培养基筛选和SPME-GC-MS 分析,F0-1和F0-2 两株菌均可以转化柠檬烯生成含氧单萜化合物。菌种F0-1 能转化柠檬烯生成香芹酮、香芹醇和α-萜品醇,生成的α-萜品醇浓度为(9.24±1.67)mg/L。菌种F0-2 能转化柠檬烯生成香芹酮和α-萜品醇,生成的α-萜品醇浓度为(2.04±1.11)mg/L。两种菌都能转化柠檬烯生成α-萜品醇,且F0-1 菌生成的α-萜品醇浓度是F0-2 菌的4.5 倍,因此选定F0-1 为转化柠檬烯合成α-萜品醇的菌株,并对F0-1 进行菌种鉴定。
2.1.2 内生菌F0-1 菌种的鉴定
细菌在LB 培养基37 ℃下培养24 h 后观察菌落的形态,可以看到菌落黄色,圆形,凸起,干燥皱起,边缘整齐。显微镜下观察革兰氏染色结果为阴性,F0-1菌生理生化结果见表1,系统发育树见图1。

表1 F0-1 菌生理生化试验结果Table 1 Results of physiological and biochemical experiments of F0-1 strain

图1 内生菌F0-1 的16S rDNA 系统发育树Fig.1 16S rDNA system development tree of F0-1 bacteria strain
F0-1 与NCBI 核酸数据库进行同源性菌的16S rRNA 基因序列比对,与Pseudomonas oryzihabitans 相似性达99.99%。结合菌株F0-1 的生理生化结果、菌落形态特征及16S rDNA 分析,鉴定菌株F0-1 为栖稻假单胞菌(Pseudomonas oryzihabitans)。
2.2 不同生长时期及转化时间对α-萜品醇产量的影响
培养基的营养成分和浓度对微生物生长和转化柠檬烯合成α-萜品醇有不同影响[23]。由图2 可知,F0-1 在细菌基本培养基中进入对数生长期、稳定期和衰亡期的时间分别是6 h、22 h 和46 h;在NA 培养基中F0-1 的生长周期更短一些,进入对数生长期、稳定期和衰亡期的时间分别是2 h、10 h 和38 h。
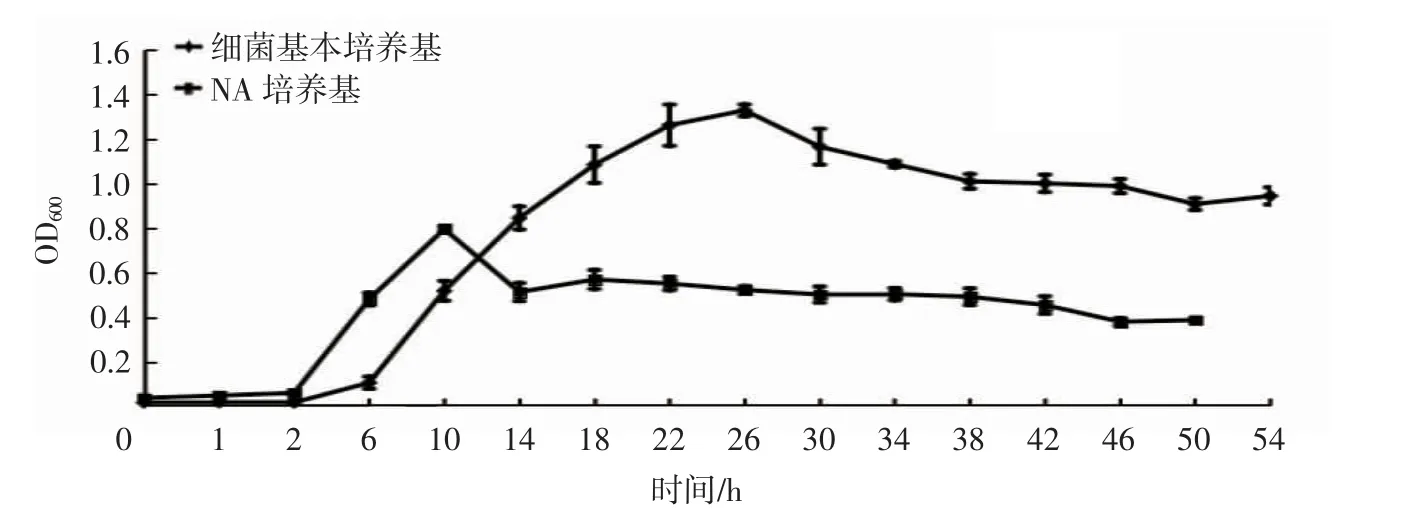
图2 F0-1 菌在两种培养基中的生长曲线Fig.2 Growth curves of F0-1 bacteria strain in two culture media
由图3 可见,两种培养基都是在衰亡期合成α-萜品醇浓度高于对数期和稳定期,且NA 培养基产量更高,在衰亡期转化12 h 合成α-萜品醇最高,为38.7 mg/L;细菌基本培养基中的最高产量在衰亡期转化24 h 处获得,为28.6 mg/L。台亚楠[24]在优化指状青霉DSM 62840 转化柠檬烯条件时,发现对数期添加柠檬烯能获得最大产量。菌种不同,最适底物添加时期也不同,细菌Pseudomonas gladioli 和指状青霉不同,其最适底物添加时期为对数晚期至稳定期,此时的菌量较高[25]。而F0-1 菌衰亡期α-萜品醇生成量高的原因可能是由于这时体系中碳源消耗过大,此时添加柠檬烯作为新的碳源,被菌种利用。也可能是细胞衰亡裂解,胞内的酶更容易和底物接触。对比两种培养基,NA 培养基的转化量较高,且最高转化量在添加底物后的12 h,转化时间短,效率高。因此,最优条件为将F0-1 菌接种到NA 培养基中,在衰亡期(培养38 h)添加柠檬烯,转化12 h。

图3 不同生长时期及转化时间对α-萜品醇产量的影响Fig.3 Effects of different growth stages and conversion time on the α-terpineol production
2.3 共溶剂种类对柠檬烯生物转化的影响
柠檬烯难溶于水相,溶解度仅为0.015 mmol/L,化学稳定性差,易发生自动氧化[26]。用共溶剂可以增加柠檬烯的溶解度,从而提高产物浓度[27]。由图4 可知,共溶剂促进作用从大到小依次为乙醇>甲醇>乙酸乙酯>甘油。添加乙醇为共溶剂,α-萜品醇浓度比对照组提高48.5%,极性有机溶剂可以提高柠檬烯等萜烯物质的溶解度,在生物转化中形成单向系统,加快反应速度,一般会促进产物生成[28]。因此甲醇和乙醇对生物转化均有促进作用;与空白对照相比,甘油使α-萜品醇浓度降低3.14 mg/L,在4 种共溶剂中,甘油对F0-1 的生物转化影响并不显著。非极性有机溶剂乙酸乙酯对生物转化也有一定的促进作用,α-萜品醇浓度提高了9.1%。考虑到乙醇价格低,可用于食品添加剂的萃取,且对柠檬烯生物转化的促进作用明显,因此选择乙醇作为生物转化的共溶剂。

图4 共溶剂对柠檬烯生物转化的影响Fig.4 Effects of cosolvent on biotransformation of limonene
2.4 底物浓度对萜品醇产量的影响
研究表明,高浓度的萜烯物质对微生物细胞有毒害作用[29],这也是微生物转化单萜生成含氧衍生物的难点之一,单萜浓度过高会影响微生物转化能力并抑制微生物的生长[28]。由图5 可知,柠檬烯转化的最适浓度为880 mg/L,当高于880 mg/L 时,产量下降。Gloria等[23]用指状青霉DSM62840 转化柠檬烯时,当柠檬烯浓度过高时会影响转化的选择性,生成其他含氧衍生物。因此,选择880 mg/L 的柠檬烯作为F0-1 转化的最适浓度。

图5 柠檬烯浓度对α-萜品醇产量的影响Fig.5 Effects of limonene concentrations on the α-terpineol production
2.5 转化条件对α-萜品醇合成的影响
2.5.1 温度对α-萜品醇产量的影响
柠檬烯生物转化效率与温度相关[25]。由图6 可知,培养温度对α-萜品醇产量有较大的影响,30 ℃时产量最高。从10~30 ℃,转化量逐渐上升,转化温度40 ℃时产量大幅下降,可能是高温影响了转化酶活力,并且高温也不适合微生物生长。
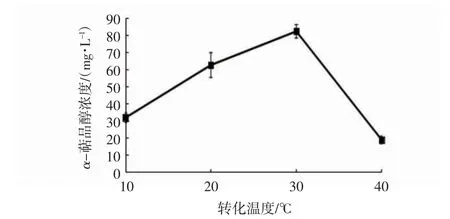
图6 培养温度对α-萜品醇产量的影响Fig.6 Effects of culture temperatures on the α-terpineol production
2.5.2 pH 对α-萜品醇产量的影响
由于在pH 为3.0 和4.0 时,F0-1 菌无法生长,故不在图7 中体现。由图7 可见,pH 为6.0 时α-萜品醇产量最高。当pH 大于7.0 时,α-萜品醇浓度下降。有研究报道,pH 大于3.5 时,柠檬烯产生分子内重排,通过不同碳原子的羟基化反应、异构化反应、氧化反应和断裂循环,促进了柠檬烯含氧化合物的形成[23]。pH 大于7.0 时,α-萜品醇浓度降低,原因可能是碱性条件下的α-萜品醇性质不稳定。Bicas 等[30]报道尖孢镰刀菌Fusarium oxysporum 152b 在pH 5.2~8.2 之间生物转化柠檬烯生成α-萜品醇;Gloria 等[23]报道指状青霉Penicillium digitatum DSM 62840 转化柠檬烯的最适pH 为3.5,此pH 下α-萜品醇产量最大。Tan 等[31]的研究也发现Penicillium digitatum NRRL 1202 在酸性环境下更利于生物转化,在pH 4.0 时产量最高。与这些真菌略有不同,P.oryzihabitans F0-1 在pH 小于5 时无法转化,在6.0~7.0 的微酸性反应体系中转化柠檬烯合成α-萜品醇的产量最高。
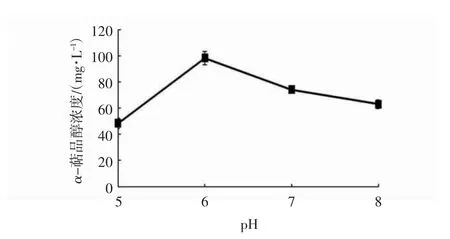
图7 体系pH 对α-萜品醇产量影响Fig.7 Effects of system pH values on the α-terpineol production
2.5.3 转速对α-萜品醇产量的影响
萜烯生物转化为含氧衍生物是需氧的[32],溶氧量对产物转化量影响较大,振荡培养可以提高体系的溶氧量[33]。在假丝酵母Candida maltosa 生物转化过程中,其关键酶NADPH-cytochrome P-450 和cytochrome P-450 单加氧酶在60 r/min 时的转化效率更高[34]。图8 显示在转速为200 r/min 时,α-萜品醇的产量最高,达到97.54 mg/L,当体系静止或处于过高转速时都不利于生成产物,因此选用中等转速200 r/min 作为生物转化培养条件。
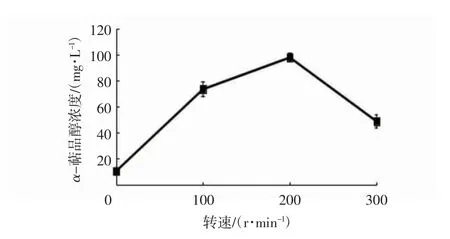
图8 转速对α-萜品醇合成的影响Fig.8 Effects of rotational speeds on the α-terpineol production
3 结论
从新鲜酒花中筛选出能转化(R)-(+)-柠檬烯合成α-萜品醇的内生菌F0-1。对该菌株进行生理生化和分子生物学鉴定,为栖稻假单胞菌Pseudomonas oryzihabitans。并对F0-1 菌生物转化的条件进行了优化,F0-1 菌在30 ℃,体系pH 为6.0,转速200 r/min的NA 培养基中预培养38 h,添加20%的柠檬烯/乙醇溶液,柠檬烯浓度为880 mg/L,转化12 h,得到的α-萜品醇浓度为(97.54±3.34)mg/L,是最初转化结果(9.24±1.67)mg/L 的10.6 倍。

