红甜菜酒发酵工艺优化及初生代谢物和挥发性代谢物分析(Ⅱ)
包永镇,代翠红,程大友,崔 杰
(1.哈尔滨工业大学化工与化学学院 哈尔滨 150001;2.黑龙江新和成生物科技有限公司,黑龙江 绥化 152000)
0 前言
初生代谢物是生物生长发育等生命活动中必不可少的基础物质和能量来源,包括糖类、氨基酸、脂质、核苷酸等物质。挥发性有机化合物(VOCs,Volatile organic compounds)为常压下,沸点范围在 50℃~260℃之间的各类有机化合物。VOCs 根据其化学结构,可以分为烷类、醛类、芳烃类、酯类和其他等。常见的有苯乙烯、苯、丁酸丙酯、甲苯、三氯甲烷、二甲苯、2-壬酮、苯乙醇、2-辛酮等。基于 UPLC-MS/MS 检测技术,利用构建的代谢数据库以及智能二级谱匹配方法对物质定性,采用 MRM 检测模式检测物质相对含量。通过单变量统计分析和多元统计分析,对定性定量到的代谢物进行分析。本章通过 LC-MS/MS,对甜菜汁与甜菜酒的初生代谢物质进行定性定量检测与差异分析,通过主成分分析(PCA)来判断样本的重复性与可靠性、正交偏最小二乘法判别分析(OPLS-DA)确定样品的可行性与检测结果的可靠性,然后通过 VIP 值来筛选差异代谢物、通过聚类热图对差异代谢物进行聚类分析、最后进行差异代谢物 KEGG 通路分析。本文通过 GC-MS/MS,对甜菜汁与甜菜酒的挥发性代谢物质进行定性定量检测与差异分析,通过主成分分析(PCA)来判断样本的重复性与可靠性、正交偏最小二乘法判别分析(OPLS-DA)确定样品的可行性,然后通过 VIP 值进行差异代谢物的筛选、通过聚类热图对差异代谢物进行聚类分析。
1 材料与方法
1.1 实验材料
本实验所使用食用红甜菜由哈尔滨工业大学糖业研究所提供。红甜菜果酒由本课题组制备。
1.2 仪器与试剂 实验仪器
质谱仪、气相色普/质谱联用仪(AGILENT,6890N/5973I);气质联用;电热恒温水浴锅,上海一恒科技有限公司;AB SCIEX 质谱仪 QTRAP®5500 LC/MS/MS 系统,AB SCIEX公司;气相色谱-质谱联用仪(Agilent 7890B GC system-5977A MSD),赛默飞世尔科技有限公司;色谱柱(HP-5毛细管柱 30 m×0.25 mm,0.25 μm),赛默飞世尔科技有限公司;手动固相微萃取(SPME)进样手柄(USA,SUP-ELCO),赛默飞世尔科技有限公司;陶瓷加热磁力搅拌器(Corning),美国 Agilent 公司。高效液相色谱仪(Ulimate3000)赛默飞世尔科技有限公司。
1.3 食用红甜菜酒中初生代谢物质的测定与分析
利用AB SciexQTRAPLC-MS/MS检测平台采集样本代谢物质谱信息,与初生代谢组数据库匹配,鉴定样本中代谢物。
通过ABSciexQTRAPLC-MS/MS检测平台,利用三重四级杆质谱的多反应监测模式(MRM)获得样本中代谢物峰面积数据,得到代谢物在不同样本中的相对含量。
1.4 食用红甜菜酒中挥发性代谢物质的测定与分析
利用 GC-MS/MS,对食用红甜菜汁与食用红甜菜酒的挥发性代谢物质进行定性定量检测与差异分析,通过主成分分析(PCA)确定样本间的分离情况、正交偏最小二乘法判别分析(OPLS-DA)确定样品的可行性,通过 VIP 值进行差异代谢物的筛选,对差异代谢物进行聚类分析。三组平行实验。发酵结束后测定其可溶性固形物含量和酒精度作为发酵结果的评定指标。
2 结果与分析
2.1 初生代谢物数据结果分析
2.1.1 基于主成分分析的初生代谢物差异性分析
本研究提取了 PC1 和 PC2 两个主成分,其贡献率分别为75.85%和 10.48%,累计贡献率达到 86.33%。在 PCA 记分图中,发酵组(FJ)和对照组(CK)被清楚地分开,重复的样本分布密集(图1a),说明本研究可靠并且具有较好的重复性。在 PCA 3D 图中(图1b),可以更直观地观察到样本的聚类。

图1 分组主成分分析图与三维图
表示第二主成分,Z 轴表示第三主成分。
前 5 个主成分可解释的变异见图 2,左图为累计可解释变异,从图中可以看出,前 5 个主成分总贡献率达到 100%,其中前两个主成分总贡献率接近 90%;右图为各个主成分的可解释变异,其中主成分 PCA1 和 PCA2 贡献率分别为 75.85%和 10.48%,PCA3、PCA4、PCA5 贡献率均低于 10%。
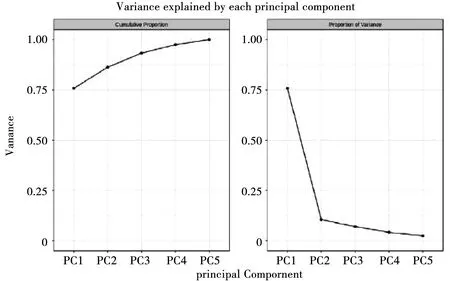
图2 分组主成分分析可解释变异图
2.1.2 正交偏最小二乘法判别分析(OPLS-DA)
与 PCA 相比,PLS-DA 可以使组间区分最大化,使差异代谢物更容易被寻找。OPLS-DA 将正交信号矫正(OSC)和 PLS-DA 方法互相检验,能够将 X 矩阵信息分成两类信息,即一类与 Y 相关,另一类与 Y 不相关,将不相关的差异信息去除,保留差异变量。
1)OPLS-DA 模型概要
OPLS-DA 建模时,X 矩阵信息会被分解成两类信息,即与 Y 相关和不相关的信息,其中与 Y 相关的变量信息为预测主成分,与 Y 不相关的变量信息为正交主成分。从 OPLS-DA 的分图(略)中可以看出发酵组(FJ)和对照组(CK)明显分离开,预测主成分贡献率达77.5%,说明两组之间差异较大;正交主成分贡献率仅为8.6%,说明组内差异较小。
2)OPLS-DA 模型验证
对 OPLS-DA 进行排列验证(n=200,即进行 200 次排列实验)。在模型验证图中,横线对应的是原始模型的 R2Y 和 Q2,红点和蓝点分别代表 Y 置换后模型的R2Y’和 Q2’。在本研究中,R2Y’和 Q2’均小于原始模型的 R2Y 和 Q2(图4),即相应的点都不超过相应的线,从而说明说明该模型有意义,并且 Q2>0.9,说明该模型是出色的模型,可根据 VIP 值分析筛选其差异代谢物。
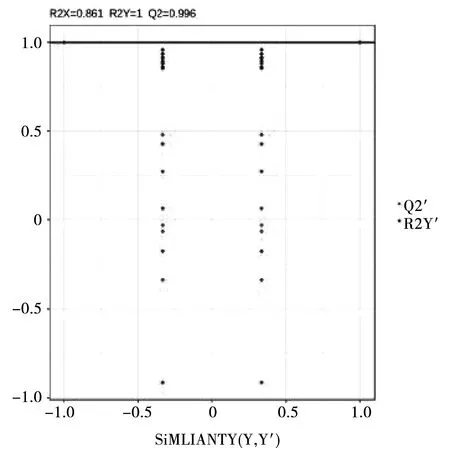
图3 OPLS-DA 验证图
3)OPLS-DA S-plot
图 4 为 OPLS-DA 的 S-plot 图,横坐标表示主成分与代谢物的协方差,纵坐标表示主成分与代谢物的相关系数,越靠近右上角和左下角的代谢物表示其差异越显著,红色的点表明这些代谢物的 VIP≥1,绿色的点表示这些代谢物的 VIP 值<1。

图4 OPLS-DA S-plot
2.1.3 差异代谢物筛选
在 OPLS-DA 的基础上,根据得到的多变量对 OPLS-DA 模型的变量重要性投影(VIP)进行分析,可以初步筛选出不同样品间的差异代谢物。综合分析差异倍数和 VIP 值来对差异表达代谢物进行筛选。筛选标准:
1、选取差异倍数大于等于 2 和差异倍数小于等于 0.5 的代谢物。
2、在上述的基础上,选取 VIP≥1 的代谢物。
1)差异代谢物火山图
图 5 为差异代谢物火山图。检测到的初生代谢产物中,上调表达的差异代谢物在图中用红色的点表示,下调表达的差异代谢物在图中用绿色的点表示,差异不显著的代谢物在图中用灰色的点表示。共检测到初生代谢物 229 种,其中磷脂酰胆碱 1 种、溶血磷脂酰胆碱 2 种、甘油酯 2 种、维生素 7 种、游离脂肪酸 12 种、糖及醇类 19 种、核苷酸及其衍生物 34 种、有机酸 38 种、酚酸类 43 种、氨基酸及其衍生物 71 种。基于 OPLS-DA 的结果,通过 VIP 值进行差异分析,得到差异显著的代谢物 140 种,上调 89 种,下调 51 种。其中,上调:磷脂酰胆碱 1 种、维生素 5 种;下调:甘油脂 1 种、游离脂肪酸 9 种。糖及醇类 12 种(5 种上调,7 种下调)、核酸及其衍生物 23 种(13 种上调,10 种下调)、酚酸类 24 种(18 种上调、6 种下调)、有机酸 26 种(23 种上调、3 种下调)、氨基酸及其衍生物 39 种(24种上调、15 种下调)。

图5 差异表达代谢物火山图
2)差异代谢物聚类热图
结果如图6。从左图中可以看出发酵组(FJ)高含量差异代谢物超过 50%,明显多于对照组(CK);从右图中可以看出各类差异代谢物在两组中的含量,其中发酵组中的氨基酸及其衍生物、有机酸、酚酸类物质含量均高于对照组,对照组中的脂类物质含量高于发酵组,核酸及其衍生物、其他类代谢物在两组中的含量差别不明显。

图6 差异代谢物聚类热图
由此可见,在发酵过程中酚酸与有机酸含量的增加是形成红甜菜酒独特风味与口感的重要原因。酚酸中没食子酸、丁香酸、龙胆酸(2,5-二羟基苯甲酸)、对-羟基苯乙酸、3-氨基水杨酸、3-(4-羟基苯基)丙酸、4-羟基苯甲醛、对羟基苯甲酸、咖啡酸、酪醇、芥子酸、丁香酸 O-葡萄糖苷、没食子酸甲酯、新绿原酸、1-O-[(E)-对香豆酰]-β-D-吡喃葡萄糖、葡萄糖没食子鞣苷、1-阿魏酰-sn-甘油、5-羟甲基糠醛上调,香兰素、肉桂酸、苯甲酸、苯甲酸甲酯、3,4,5-三甲氧基苯基 1-O-D-葡萄糖吡喃苷、4-咖啡酰奎宁酸下调(见附表Ⅱ),共注释到了 7 条 KEGG 通路。其中龙胆酸(2,5-二羟基苯甲酸)和对-羟基苯乙酸共同参与了酪氨酸代谢通路;对-羟基苯乙酸、肉桂酸和苯甲酸共同参与了苯丙氨酸代谢通路;对羟基苯甲酸和肉桂酸参与了泛醌和其他萜醌生物合成通路和叶酸生物合成通路;咖啡酸、芥子酸和肉桂 酸参与了苯丙素类生物合成;香兰素和肉桂酸参与了次生代谢生物合成通路中的辣椒素的生物合成。
2.1.4 差异代谢物 KEGG 分类及富集分析
1)差异代谢物 KEGG 分类
对初生代谢物 KEGG 的注释结果按照 KEGG 中通路类型进行分类(图 7)。

图7 差异代谢物 KEGG 分类图
初生代谢物 KEGG 通路分类及富集分析表明,共注释到代谢通路 67 个,其中代谢通路注释到代谢物 64 种,占注释到的代谢物总数 76.19%;次生代谢生物合成通路注释到代谢物 29 种,占注释到的代谢物总数 34.52%;氨基酸生物合成通路注释到代谢物 14 种,占注释到的代谢物总数 16.67%;ABC 转运蛋白注释到代谢物 13 种,占注释到的代谢物总数 15.48%;嘌呤代谢通路注释到代谢物 11 种,占注释到的代谢物总数 13.1%;氨基酰-t RNA 生物合成通路注释到代谢物 10 种,占注释到 的代谢物总数 11.9%;2-氧羧酸代谢通路注释到代谢物8种,占注释到的代谢物总数9.52%;嘧啶代谢通路、苯丙氨酸代谢通路、丙氨酸,天冬氨酸和谷氨酸代谢通路分别注释到代谢物 7 种,分别占注释到的代谢物总数 8.33%;半胱氨酸和蛋氨酸代谢通路注释到代谢物 6 种,占注释到的代谢物总数 7.14%;玉米素生物合成通路、酪氨酸代谢通路、碳代谢通路分别注释到代谢物 5 种,分别占注释到的代谢物总数 5.95%;苯丙素生物合成通路、烟酸盐和烟酰胺代谢通路、硫代葡萄糖苷的生物合成通路、氰 氨 酸 代 谢 通 路、丁 酸 代 谢 通 路、β-丙氨酸代谢通路、精氨酸生物合成通路、精氨酸和脯氨酸代谢通路分别注释到代谢物 4 种,分别占注释到的代谢物总数 4.76%;泛醌和其他萜醌生物合成通路、丙酸代谢通路、苯丙氨酸,酪氨酸和色氨酸的生物合成通路、泛酸与辅酶 A 生物合成通路、赖氨酸生物合成通路、组氨酸代谢通路、乙醛酸和二羧酸代谢通路、甘氨酸,丝氨酸和苏氨酸代谢通路、谷胱甘肽代谢通路、半 乳糖代谢通路、咖啡因代谢通路分别注释到代谢物 3种,分别占注释到的代谢物总数 3.57%;缬氨酸,亮氨酸和异亮氨酸的降解通路、色氨酸代谢通路、硫代谢通路、戊糖磷酸途径通路、氮代谢通路、单菌素生物合成通路、赖氨酸降解通路、缬氨酸,亮氨酸和异亮氨酸的生物合成通路、异喹啉生物碱 生物合成通路、吲哚生物碱生物 合成通路、C5-支二元酸代谢通路、氨基糖和核苷酸糖代谢通路分别注释到代谢物 2 种,分别占注释到的代谢物总数 2.38%;维生素 B6 代谢通路、托烷,哌啶和吡啶生物碱生物合成通路、硫胺代谢通路、牛磺酸和次牛磺酸代谢通路、淀粉和蔗糖代谢通路、核黄素代谢通路、丙酮酸代谢通路、卟啉与叶绿素代谢通路、戊糖与葡萄糖醛酸的相互转化通路、氧化磷酸化通路、磷酸肌醇代谢通路、糖酵解/糖异生通路、果糖和甘露糖代谢通路、叶酸生物合成通路、三羧酸循环、光合作用生物的固碳作用、碳青霉烯类生物合成通路、生物素代谢通路、甜菜素生物合成通路、抗坏血酸和醛酸代谢通路、糖尿病并发症中的 AGE-RAGE 信号通路、硫磺中继系统分别注释到代谢物 1 种,分别占注释到的代谢物总数 1.19%。
2)差异代谢物 KEGG 富集
根据差异代谢物结果,进行 KEGG 通路富集,其中 Rich factor 为差异表达的代谢物中在对应通路中的个数与该通路检测注释到的代谢物总数作比,该值的大小说明了富集程度的大小。Pvalue 为超几何检验 P 值。Pvalue 越接近于 0,表示富集越显著。图中点的大小代表富集到相应通路上的差异显著代谢物个数。结果如图8 所示。共注释到差异显著代谢通路 20 个,分别为玉米素生物合成通路、泛醌和其他萜醌生物合成通路、酪氨酸代谢通路、色氨酸代谢通路、嘌呤代谢通路、丙酸代谢通路、苯丙氨酸代谢通路、戊糖磷酸途径、泛酸与辅酶 A 生物合成通路、氮代谢通路、代谢通路、吲哚生物碱生物合成通路、半胱氨酸和蛋氨酸代谢通路、咖啡因代谢通路、C5-支二元酸代谢通路、丁酸代谢通路、次生代谢生物合成通路、β-丙氨酸代谢通路、氨基糖和核苷酸糖代谢通路、丙氨酸,天冬氨酸和谷氨酸代谢通路,其中玉米素生物合成通路最显著;代谢通路注释到差异代谢物最多,次生代谢物生物合成通路次之。
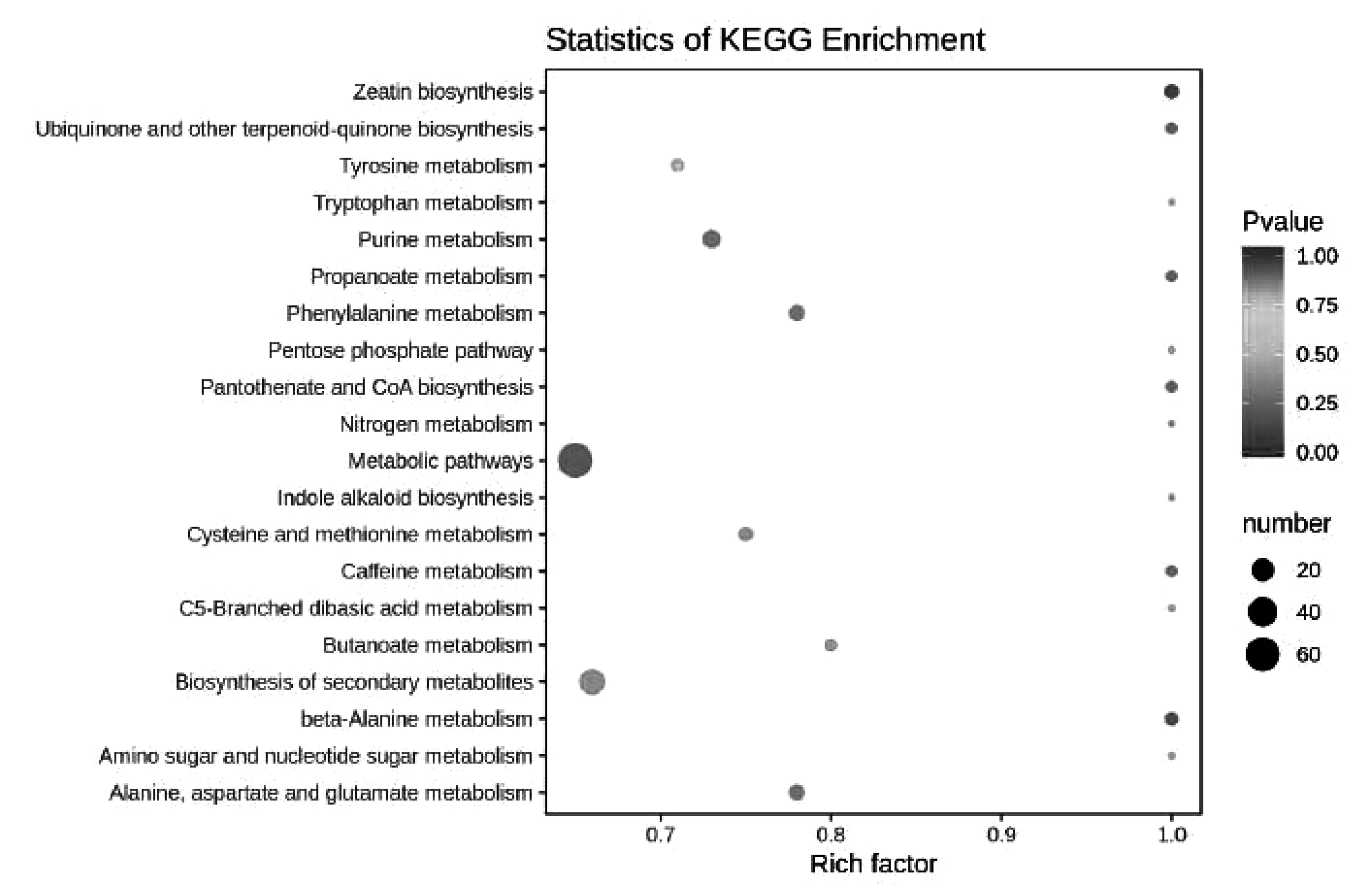
图8 差异代谢物 KEGG 富集图
2.2 挥发性代谢物数据结果分析
2.2.1 基于主成分分析的挥发性代谢物差异性分析
本研究提取了 PC1 和 PC2 两个主成分,其贡献率分别为 66.97%和 20.48%,累计贡献率达到 87.45%。在 PCA 记分图中(图9),发酵组(FJ)和对照组(CK)被清楚地分开,重复的样本在计分图中分布较紧密(图 9 a),从而说明本研究可靠且具有较好的重复性。在 PCA 3D 图中(图 9 b),可以更直观地看到样本的聚类。
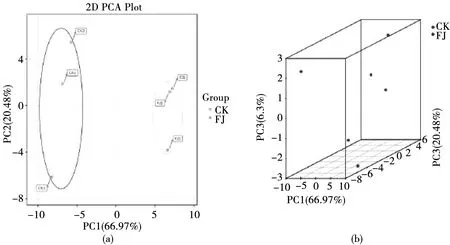
图9 分组主成分分析图与三维图
前 5 个主成分总贡献率达到 100%,其中前两个主成分总贡献率接近 90%;各个主成分的可解释变异表明,其中主成分 PCA1 和 PCA2 贡献率分别为 66.97%和 20.48%,PCA3、PCA4、PCA5 贡献率均低于 10%。
2.2.2 正交偏最小二乘法判别分析(OPLS-DA)
1)OPLS-DA 模型概要
从 OPLS-DA 得分图(图 10)中可以看出发酵组(FJ)和对照组(CK)明显分离开,预测主成分贡献率达69.2%,说明两组之间差异较大;正交主成分贡献率仅为18.1%,说明组内差异较小。

图10 OPLS-DA 得分图
2)OPLS-DA 模型验证
在本研究中,R2Y’和 Q2’均小于原始模型的R2Y 和 Q2,从而说明说明该模型有意义,并且 Q2>0.9,说明该模型是出色的模型,可根据 VIP 值分析筛选其差异代谢物。
3)OPLS-DA S-plot
从 OPLS-DA 的 S-plot 图(图11)可以看出,横坐标表示主成分与代谢物的协方差,纵坐标表示主成分与代谢物的相关系数,越靠近右上角和左下角的代谢物表示其差异越显著,红色的点表明这些代谢物的 VIP 值大于等于 1,绿色的点表示这些代谢物的VIP 值小于 1。本研究共检测到挥发性代谢物 87 种。

图11 OPLS-DA S-plot
2.2.3 差异代谢物筛选
1)差异代谢物火山图
利用 OPLS-DA 模型进行各分组比较,检测到的挥发代谢产物中,在检测到的 87 种挥发性代谢物中,上调 25 种,下调 8 种,差异不显著代谢物 54 种,其中酯类 13 种(11 种上调、2 种下调)、酸类 5 种(上调)、酮类 3 种(1 种上调、2 种下调)、烷类 3 种(2 种上调、1 种下调)、醛类 3 种(1 种上调、2 种下调)、酐类 1 种(上调)、吡嗪类 1 种(上调)、苯类 1 种(下调)、烯类 1 种(上调)、醇类 1 种(上调)、酚类 1 种(上调)。
2)差异代谢物聚类热图
利用挥发性差异代谢物聚类热图分析表明,发酵组中高含量差异代谢物明显多于对照组,说明食用红甜菜在发酵过程中,形成了更多的香气成分。挥发性差异代谢物见表1。

表1 挥发性差异代谢物
在检测到的挥发性差异代谢物中,1-氯-3-甲基-丁烷、甲乙酐、2-甲基-丁酸、乙酸异戊酯、丁内酯、2,5-二甲基吡嗪、己酸乙酯、苯乙醛、2-乙基己酸、苯乙醇、2-丁基-2-乙基-1,3-二氧戊环、甲酸-2-苯乙酯、辛酸、4-乙酰氧基丁酸乙酯、乙酸香茅酯、苯乙酸乙酯、N-甲基-正丙氧基羰基甘氨酸己酯、壬酸、壬酸乙酯、间叔丁基苯酚、双(1,3-二叔丁基环戊二烯基)钴、正癸酸、9-癸烯酸乙酯、癸酸乙酯、2,6-双(1,1-二甲基乙基)-2,5-环己二烯-1,4-二酮含量上调;邻苯二甲酸二乙酯、2-甲基-壬烷、1,2,4-三甲基苯、2,2,6-三甲基-4H-1,3-二英-4-酮、壬醛、反式-2-壬醛、2,4,4-三甲基-3-(3-甲基丁基)环己-2-烯酮、2-甲基-3-羟基-2,2,4-三甲基丙酸戊酯含量下调。其中酯类 13 种(11 种上调、2 种下调)、酮类 3 种(1 种上调、2 种下调)、烷类 3 种(2 种上调、1 种下调)、醛类 3 种(1 种上调、2 种下调)。酸类 5 种、酐类 1 种、吡嗪类 1 种、烯类 1 种、醇类 1 种、酚类 1 种上调。苯类 1 种(下调)。
在检测到的 33 种挥发性差异代谢物中,酯类占了 13 种,占比 39%,说明酯类物质是食用红甜菜果酒的主要呈香物质。其中乙酸异戊酯的香气类型与香蕉香气和梨的香气相似,可用于配置香精和溶剂等;丁内酯气味芳香且独特,通常应用于食用香料的配制和重要的医用中间体;己酸乙酯的香气比较像浓郁的酒香,并且具有曲香、菠萝香型的香气,工业上常用于配制食品用香精、烟草香精以及用于调整曲酒的香气;乙酸香茅酯的香气类型为柠檬果香,并与玫瑰、薰衣草香气相似,可用于调配各种花香型香精;苯乙酸乙酯的香气类型为浓郁的蜂蜜型香气,工业上主要用于制备各种花香型的日用香精;壬酸乙酯的香气类型为水果型香气以及玫瑰花香型的酒香,常用来制备食品香精和香水、化妆品等日用香精;癸酸乙酯的香气类型表现为酒香和椰子香,在工业上主要用于制备食品用香精。这些酯类物质与醇类、酮类、酸类等其他香气成分相互作用,共同形成了食用红甜菜酒的独特风味。
3 结论
初生代谢研究提取了 PC1 和 PC2 两个主成分,其贡献率分别为 75.85%和10.48%,累计贡献率达到 86.33%。在 PCA 记分图中,发酵组和对照组被清楚地分开,重复的样本在计分图中分布紧密,说明本实验可靠并且具有较好的重复性。
通过 OPLS-DA 验证,共检测到初生代谢物 229 种,其中磷脂酰胆碱 1 种、溶血磷脂酰胆碱 2 种、甘油酯 2 种、维生素 7 种、游离脂肪酸 12 种、糖及醇类 19种、核苷酸及其衍生物 34 种、有机酸 38 种、酚酸类 43 种、氨基酸及其衍生物 71种。基于 OPLS-DA 的结果,通过 VIP 值进行差异分析,得到差异显著的代谢物140 种,上调 89 种,下调 51 种。
初生差异代谢物聚类分析表明发酵组(FJ)高含量差异代谢物超过 50%,明显多于对照组(CK);其中发酵组中的氨基酸及其衍生物、有机酸、酚酸类物质含量均高于对照组,对照组中的脂类物质含量高于发酵组;核酸及其衍生物、其他类代谢物在两组中的含量差别不明显。
初生代谢物 KEGG 通路分类及富集分析表明,共注释到代谢通路 67 个,其中代谢通路注释到代谢物 64 种;次生代谢生物合成通路注释到代谢物 29 种;氨基酸生物合成通路注释到代谢物 14 种;ABC 转运通路注释到代谢物13 种;嘌呤代谢通路注释到代谢物 11 种;其他代谢通路注释到代谢物分别≤10 种。
初生代谢物 KEGG 富集注释到显著差异代谢物通路 20 个,其中玉米素生物合成通路最显著,代谢通路注释到差异代谢物最多,次生代谢物生物合成通路次之。挥发性代谢研究提取了 PC1 和 PC2 两个主成分,其贡献率分别为 66.97%和20.48%,累计贡献率达到 87.45%。
通过 OPLS-DA 验证,共检测到挥发性代谢物 87 种,基于 OPLS-DA 的结果,通过 VIP 值进行差异分析,得到差异显著的挥发性代谢物 33 种,上调 25 种,下调 8 种。
挥发性差异代谢物聚类分析表明,发酵组中高含量差异代谢物明显多于对照组,说明食用红甜菜在发酵过程中,形成了更多的香气成分,其中酯类物质占比最大,是食用红甜菜酒的主要呈香物质之一,食用红甜菜酒中的各种香气成分相互作用共同形成其独特的风味。

