β3 肾上腺素能受体活化抑制慢性间歇低氧诱导的动脉粥样硬化进展的机制
索旻,王越,刘梦如,刘倍倍,陈蕾蕾,王悦,王志强,张慧娜,吴小凡
阻塞性睡眠呼吸暂停综合征(OSA)被列为动脉粥样硬化性疾病的新危险因素[1-2],慢性间歇低氧(CIH)已被证实是OSA 的主要病理生理过程,并且可通过上调氧化应激反应促进动脉粥样硬化的进展[3]。CIH 下交感神经系统兴奋性显著升高,有研究表明持续兴奋的交感神经系统会使β3 肾上腺素能受体(β3 AR)出现脱敏现象,导致其活性下降[4];常氧下活化β3 AR 可抑制巨噬细胞内烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NOX)活性,进而减少活性氧产生[5],然而CIH 下β3 AR 活化对动脉粥样硬化的影响及具体机制尚不明确。p22phox作为NOX 的重要亚基[6],已被证明能够促进动脉粥样硬化进展[7],因此,CIH/β3 AR/氧化应激通路很可能是CIH 促进动脉粥样硬化进展的重要机制之一。本研究首先在载脂蛋白E 基因敲除(ApoE-/-)小鼠中观察活化β3 AR 对氧化应激反应和动脉粥样硬化进展的影响,进一步聚焦氧化应激反应发生的主要场所——巨噬细胞,观察CIH 下活化β3 AR 抑制氧化应激反应的可能机制。
1 材料与方法
主要试剂及材料:β3 AR 特异性激动剂米拉贝隆购自美国MedChemExpress 公司;苏木素-伊红(HE)染液、青霉素-链霉素混合溶液和胰蛋白酶购自北京索莱宝科技有限公司;CD68、p22phox 和β3 AR 抗体均购自美国Abcam 公司;超氧化物阴离子荧光探针购自上海碧云天生物技术有限公司;甘油醛-3-磷酸脱氢酶 (GAPDH)抗体购自北京普利莱基因技术有限公司;辣根过氧化物酶标记的羊抗兔二抗和二氨基联苯胺(DAB)显色剂均购于北京中杉金桥公司;羊抗兔荧光二抗和羊抗小鼠荧光二抗均购自美国Li-Cor 公司;总抗氧化能力检测试剂盒购自北京普利莱基因技术有限公司;胎牛血清和RPMI 1640 培养基均购自美国Gibco 公司。
实验动物及细胞:6~7 周龄,体质量(25±3)g,无特定病原体级,雄性ApoE-/-小鼠15 只,购自北京华阜康生物科技股份有限公司,小鼠质量合格编号11401500043662,在首都医科大学附属北京安贞医院实验动物房内饲养。以下动物实验已通过本院实验动物伦理委员会批准。小鼠单核巨噬细胞白血病细胞RAW264.7 源自Abelson 鼠科白血病病毒诱导的肿瘤,购自国家实验细胞资源共享平台(北京总部)。
实验分组及干预:ApoE-/-小鼠饲养:按照随机数表法将小鼠平均分为3 组:(1)常氧组给予高脂饲料(含21%脂肪、0.15%胆固醇)喂养12 周。(2)低氧组给予高脂饲料喂养的同时,于实验第4 周进入低氧动物箱,箱内循环充入氮气和压缩空气,主控板控制氮气和压缩空气的转换,使舱内氧浓度在5%~21%之间循环,每个循环180 s[8]。(3)低氧+米拉贝隆组小鼠给予高脂饲料喂养的同时,于实验第4 周进入低氧动物箱,同时每日以10 mg/kg 的米拉贝隆灌胃。常氧组和低氧组小鼠于实验第4 周每日接受相同体积的米拉贝隆溶剂(即含10%二甲基亚砜的生理盐水)灌胃,低氧组和低氧+米拉贝隆组小鼠每天在低氧动物箱内8 h,箱内温度、湿度与室内相同。
RAW264.7 细胞培养:RAW264.7 细胞置于二氧化碳培养箱中,在37℃、5%二氧化碳条件下,以含10%胎牛血清的RPMI 1640 培养基培养,取对数生长期细胞应用于实验。实验分为常氧组、低氧组和低氧+米拉贝隆组,将细胞接种于6 孔板中,每组6 孔,调整细胞浓度为1×106个/孔。低氧+米拉贝隆组细胞给予0.5 μmol/L 米拉贝隆处理。低氧组和低氧+米拉贝隆组细胞置于37℃低氧培养箱内,二氧化碳浓度5%,氧浓度在5%~21%之间循环,每个循环1 h[9]。48 h 后收取细胞。
小鼠标本采集与处理:小鼠夜间禁食水12 h 后以5%的戊巴比妥钠腹腔注射进行麻醉,自心尖抽取血液标本,置于-80℃冰箱中保存备用。留取小鼠心脏基底部,4%多聚甲醛固定,于4℃冰箱中保存备用[10];留取颈动脉,用包埋剂包埋后于-20℃冰箱中保存备用。
主动脉根部HE 染色:在主动脉3 个瓣叶水平以5 μm 厚度对组织蜡块进行连续切片,对主动脉根部组织进行HE 染色,显微镜拍照后利用NISELEMENT 软件测定粥样硬化斑块表面积与动脉壁表面积,计算斑块面积占动脉壁表面积的百分比[7]。
免疫组织化学染色:小鼠主动脉根部石蜡切片脱蜡后于柠檬酸钠修复液中进行抗原修复,以3%H2O2水溶液灭活内源性过氧化物酶,用5%牛血清白蛋白封闭后分别滴加CD68、p22phox 抗体,4℃孵育过夜,次日滴加二抗室温孵育1 h 后,滴加DAB 显色液进行显色。显微镜拍照,计算棕褐色阳性面积占组织面积的百分比[10]。
超氧化物阴离子荧光探针检测活性氧:对颈动脉组织进行冰冻切片,厚度约7 μm,将荧光探针(10 mmol/L)滴于组织上,37℃孵育30 min,50%甘油封片后立即在显微镜下观察、拍照,活性氧在激发光下呈红色荧光。计算红色荧光面积占血管组织总面积的百分比。
ABTS 法检测总抗氧化能力:根据试剂盒说明,倍比稀释标准品溶液用于标准曲线测定;于96 孔板中依次加入检测工作液、样品或标准品后,混匀,室温孵育5 min 后利用酶标仪测定734 nm 波长处吸光度。根据标准曲线,计算样品总抗氧化能力,细胞样品根据蛋白浓度计算每毫克蛋白中总抗氧化能力。
RNA 提取与转录组测序:取ApoE-/-小鼠整条主动脉,分离周围脂肪组织及筋膜,利用TRIzol 法提取总RNA,以BGISEQ500 平台进行转录组测序(RNA-seq)。每个基因的表达水平通过RSEM 标准化为FPKM。利用差异分析软件DEseq2 筛选三组间氧化应激相关的差异表达基因[11]。对差异表达基因进行基因本体论(GO)和京都基因与基因组百科全书(KEGG)富集分析,以P<0.05 为筛选条件。
蛋白免疫印迹(Western blot)检测:收取细胞进行蛋白定量后,进行蛋白变性[12],将蛋白样本等量上样至十二烷基硫酸钠聚丙烯酰胺凝胶进行电泳后,以200 mA电流冰上转膜至聚偏二氟乙烯(PVDF)膜上,10%脱脂奶粉封闭1 h 后,于4℃分别孵育β3 AR、p22phox 和GAPDH 一抗过夜,次日以荧光标记二抗室温避光孵育1 h,用Odyssey 双色红外激光成像系统扫描PVDF 膜检测灰度值。
统计学方法:采用SPSS 25.0 软件进行统计分析。正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,采用LSD 法进行多重比较。以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组小鼠动脉粥样硬化斑块情况及β3 AR、p22phox 表达
低氧组较常氧组和低氧+米拉贝隆组小鼠:主动脉根部HE 染色动脉粥样硬化斑块面积占动脉壁表面积的百分比更高[(27.88±5.83)%vs. (19.84±5.13)%; (27.88±5.83)% vs.(16.33±3.60)%,P均<0.05,n=5](图1A);斑块内CD68 阳性面积百分比更高[(10.63±3.18)% vs.(5.31±2.77)%;(10.63±3.18)% vs. (5.20±1.40)%,P均<0.05,n=5)(图1B);斑块内β3 AR 阳性面积百分比更高[(5.06±0.44)% vs. (2.99±1.56)%;(5.06±0.44)% vs. (2.61±0.95)%,P均<0.05,n=5](图1C);p22phox 阳性面积百分比更高[(4.82±0.85)%vs. (1.29±0.27)%;(4.82±0.85)% vs. (0.94±0.63)%,P均<0.05,n=5](图1D)。各组小鼠斑块内p22phox阳性面积百分比与β3 AR 的阳性面积百分比具有正性相关(r=0.90,P<0.05,图1E)。
2.2 各组小鼠氧化应激水平及血清总抗氧化能力
低氧组较常氧组和低氧+ 米拉贝隆组小鼠,颈动脉组织活性氧阳性面积百分比更高[(29.25±4.87)% vs. (12.58±1.73)%,(29.25±4.87)% vs. (6.00±2.08)%;P均<0.05],见图2A。低氧组较常氧组和低氧+米拉贝隆组小鼠,血清总抗氧化力水平降低[(2.09±0.11) mmol/L vs. (2.74±0.33) mmol/L; (2.09±0.11) mmol/L vs.(2.73±0.15) mmol/L,P均<0.05],见图2B。
进一步通过RNA-seq 对3 组小鼠的基因表达谱进行检测,发现与常氧组相比,低氧组小鼠存在796 种差异表达基因,其中437 种基因表达上调,359 种基因表达下调;与低氧组相比,低氧+米拉贝隆组小鼠存在474 种差异表达基因,其中130 种基因表达上调,344 种基因表达下调。上述两两比较后的差异表达基因有183 种重复,对这183 种差异表达基因进行分子功能(图2C)和生物过程(图2D)的GO 富集分析,筛选富集基因数前10 名的GO 号,发现3 组小鼠差异表达基因在氧化还原过程中具有明显富集。
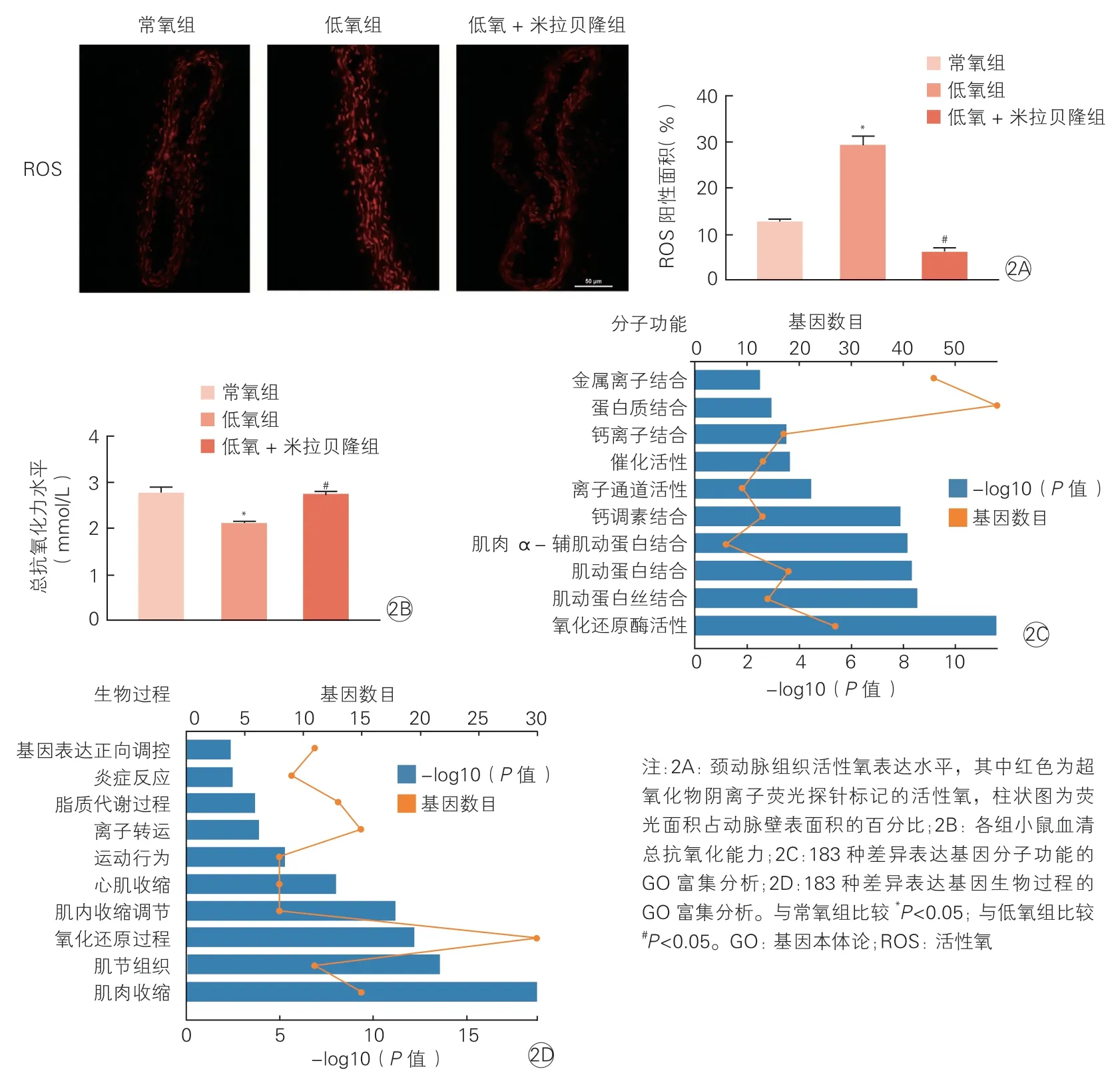
图2 小鼠动脉组织氧化应激水平及血清总抗氧化能力(n=5)
故进一步在183 个差异基因中筛选与氧化应激相关的基因,共发现36 个基因,其在各组小鼠中的表达水平如图3A 所示,在这些基因中,Hephl1、Marc1、Moxd1、Alox15、Hpdl、Th、Dbh、Sqle、Adh7、Nsdhl、Fasn、Gpd1、Sc5d、Sdr39u1、Hsd11b1、Dio2、Gmpr、Pdha1、Pdhb、Uqcrfs1、Etfdh、Sdhb、Idh3a、Hsd17b12、Gpd2、Dlat、Me1等基因主要起促进氧化的作用,与常氧组相比,其在低氧组的表达水平上调,给予米拉贝隆后,其表达水平降低,其中Fasn曾被报道可随p22phox 水平降低而降低[11]。Cyp2b10主要起抑制氧化应激的作用,与常氧组相比,其在低氧组的表达水平降低,给予米拉贝隆后,其表达水平上调。对这36 个差异基因进行KEGG 信号通路富集分析,共发现17 种有统计学意义的信号通路(图3B)。
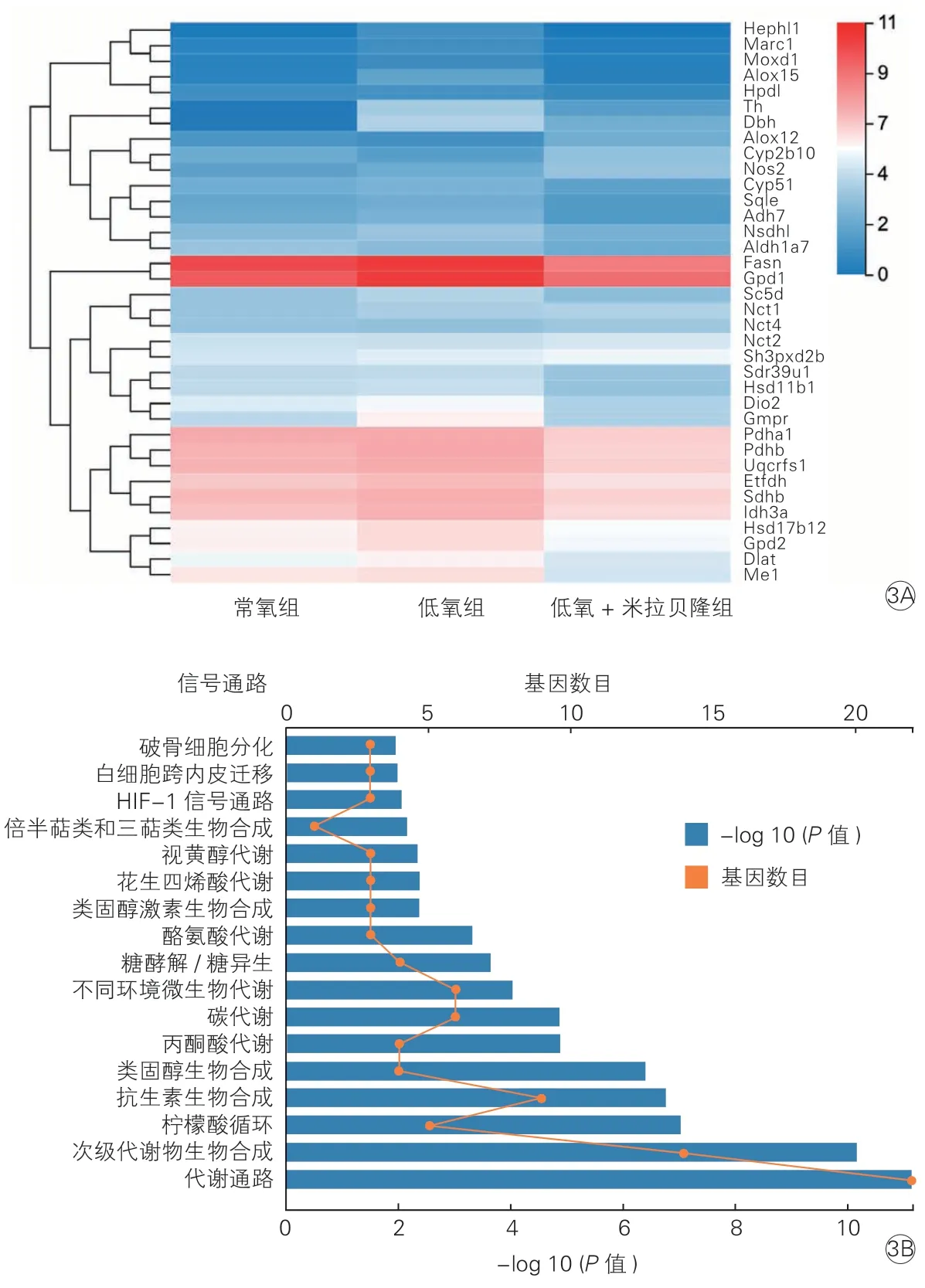
图3 各组小鼠主动脉组织36 个氧化应激相关基因的表达差异(3A)与KEGG 信号通路富集分析(3B)
2.3 RAW264.7 巨噬细胞β3 AR 及氧化应激水平
Western blot 检测结果显示,常氧组、低氧组和低氧+米拉贝隆组β3 AR 灰度值分别为0.40±0.03、0.51±0.04 和0.90±0.01,低氧组β3 AR 表达水平高于常氧组,但低于低氧+米拉贝隆,差异均有统计学意义(P均<0.05),见图4A、4B。常氧组、低氧组和低氧+米拉贝隆组p22phox 灰度值分别为0.70±0.05、0.86±0.07 和0.72±0.07,低氧组p22phox 表达水平高于常氧组和低氧+米拉贝隆组,差异均有统计学意义(P均<0.05),见图4A、4C。ABTS 法检测发现,低氧组总抗氧化力水平低于常氧组和低氧+米拉贝隆组细 胞[(116.39±88.33) μmol/mg vs.(287.11±65.43)μmol/mg;(116.39±88.33) μmol/mg vs.(470.86±197.05)μmol/mg,P均<0.05],见图4D。
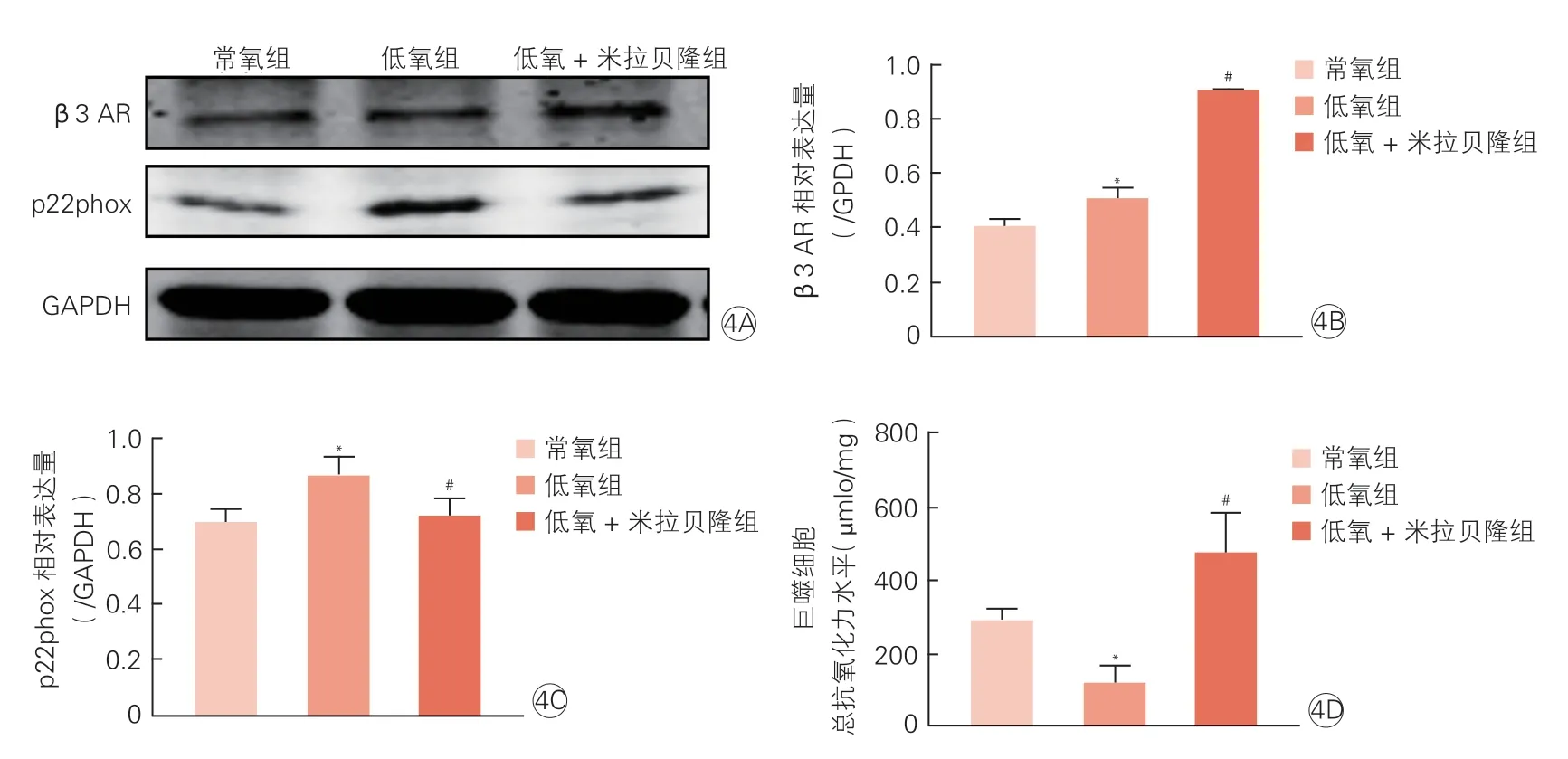
图4 RAW264.7 巨噬细胞β3 AR 及氧化应激水平(n=3)
3 讨论
既往有研究发现β3 AR 活化可减缓常氧环境下动脉粥样硬化的进展[4-6],本研究在CIH 环境下验证了β3 AR 活化对动脉粥样硬化的保护作用,特异性激动β3 AR 可减缓CIH 诱导的ApoE-/-小鼠动脉粥样硬化发生,其发生机制与抑制巨噬细胞氧化应激反应、增强巨噬细胞抗氧化能力密切相关。
CIH 促进动脉粥样硬化进展的过程可能涉及炎症反应、血管新生、氧化应激反应等多条通路。既往研究在C57BL/6J 小鼠[13]和ApoE-/-小鼠[14]中均发现CIH 可促进动脉粥样硬化进展,本研究选用ApoE-/-小鼠,通过8 周CIH 处理,快速诱导动脉粥样硬化模型,同样观察到CIH 对ApoE-/-小鼠动脉粥样硬化进展的促进作用。同时,通过检测粥样硬化斑块内细胞成分,发现CIH 可显著增加斑块内巨噬细胞数量。巨噬细胞在斑块进展和斑块破裂中均发挥重要作用[15],已有研究报道,CIH 可降低巨噬细胞吞噬脂质/胆固醇的功能,增加炎症因子的分泌[16]。在斑块进展过程中,氧化修饰的低密度脂蛋白(oxLDL)同样可降低巨噬细胞的吞噬功能,进而促进斑块内坏死细胞形成坏死核心[17]。oxLDL 影响巨噬细胞吞噬功能的机制之一是增强氧化应激反应、产生过量的活性氧[18],NOX 是合成活性氧的关键酶,p22phox 是其重要的亚基[19],本研究发现,在CIH 促进动脉粥样硬化进展的过程中,小鼠颈动脉组织活性氧升高,主动脉根部p22phox 表达水平显著升高,同时小鼠血清总抗氧化力下降,提示在CIH 促进ApoE-/-小鼠动脉粥样硬化进展的过程中,氧化应激反应加剧在其中发挥重要作用,抑制氧化应激反应有望减缓CIH 对动脉粥样硬化的促进作用。
β3 AR 已被证实广泛分布于棕色脂肪组织和血管等组织中[4],在既往研究中,β3 AR 通过调节棕色脂肪组织而发挥的抗动脉粥样硬化作用受到广泛关注,其在其他部位的作用机制尚不明确;另外,既往研究均是在常氧环境下形成动脉粥样硬化斑块,CIH 环境下,β3 AR 在动脉粥样硬化进展中发挥何种作用尚未可知。CIH 环境下交感神经系统兴奋性显著升高,有研究表明长期兴奋的交感神经系统会使β3 AR出现脱敏现象,即β3 AR活性下降[4];本研究在在体实验和体外实验中均发现,低氧组β3 AR 表达水平较常氧组明显上调,这可能是对脱敏现象的代偿性调节。与Nagai 等[20]报道的在CIH环境下大鼠肺组织中巨噬细胞β3 AR 表达水平上升的结果一致。给予米拉贝隆刺激后,小鼠粥样硬化斑块内β3 AR 表达水平显著下降,而RAW264.7巨噬细胞中β3 AR 表达水平呈增高,这种不一致的现象可能与在体实验和体外实验中米拉贝隆的药物浓度和刺激时间不同有关。在体实验中活化β3 AR后显著减缓CIH 诱导的动脉粥样硬化,同时减少斑块内巨噬细胞数量。进一步在巨噬细胞水平探讨β3 AR 活化改善CIH 诱导的动脉粥样硬化的可能机制,发现米拉贝隆激活巨噬细胞的β3 AR 后,可显著降低巨噬细胞p22phox 表达水平,同时增强细胞的总抗氧化力。Hadi 等[5]在子宫肌层的巨噬细胞中发现β3 AR 活化可抑制氧化酶2(NOX2)活性进而减少活性氧的产生。本研究在既往研究的基础上,结合转录组测序分析,进一步明确:与常氧环境相比,CIH 可上调促进氧化应激的相关基因表达,活化β3 AR 后可使上述基因表达下调。同时发现β3 AR 活性与NOX 的亚基p22phox 的表达之间具有重要联系,提示β3 AR 活化后抑制巨噬细胞氧化应激反应、增强总抗氧化力可能是其延缓CIH 诱导的动脉粥样硬化进展的机制,但β3 AR 与上述氧化应激相关基因之间的具体调节机制还有待于进一步探究。
综上所述,本研究在ApoE-/-小鼠中发现β3 AR活化可减缓CIH 诱导的动脉粥样硬化,其具体机制可能是降低巨噬细胞p22phox 表达、抑制氧化应激反应。β3 AR 有望成为OSA 患者防治动脉粥样硬化疾病的有效靶点。
利益冲突:所有作者均声明不存在利益冲突

