微小RNA-33a 对平滑肌细胞表型转化的调控机制研究
常峥峥,林飞,赵晖,李扬,刘懿,李东旭,赵国安
动脉粥样硬化(AS)是冠心病等疾病的病理基础,而冠心病等心脑血管疾病严重危及生命健康,每年导致大量患者死亡[1]。平滑肌细胞(SMC)表型转化是AS 发生、发展的重要环节。正常情况下,SMC 位于血管中膜,起着收缩血管和保持血管弹性的功能,此时的SMC 为收缩表型,细胞高度分化,特点是低增殖率、低迁移率和分泌少量细胞外基质,标志物有平滑肌肌动蛋白α(ACTA2)、平滑肌22α(TAGLN)、肌球蛋白重链11(MYH11)、钙调蛋白1(CNN1)等。而血小板衍生生长因子-BB(PDGF-BB)可诱导SMC 去分化,从收缩表型向合成表型转化,SMC 增殖能力、迁移能力及合成细胞外基质能力升高,具有部分“干细胞”潜质,其标志物骨桥蛋白(OPN)表达升高,从而促进AS 的进展[2]。因此,探究SMC 表型转化相关调节机制可以为AS的诊疗提供新的观点。
微小RNA(miRNA)是一类保守的、小的(22~24个核苷酸)非编码RNA,位于基因组内或基因序列中。miRNA 是转录后基因调控的关键调控因子,通过与靶基因信使RNA(mRNA)结合,以降解并抑制翻译来发挥作用,单个miRNA 可能同时影响数百甚至数千个基因[3],或数个miRNA 同时调节一个基因。而miRNA 在SMC 表型转化中是否发挥重要调控作用,目前尚不明确。因此,寻找未在SMC 表型转化中研究或研究较少的miRNA 具有重要意义。
miR-33a 在AS 中的作用主要是通过介导三磷酸腺苷(ATP)结合盒转运蛋白A1(ABCA1)的表达来影响巨噬细胞胆固醇代谢[4],在肿瘤方面还可通过周期蛋白依赖性激酶-6(CDK-6)来影响细胞增殖[5]。而miR-33a 是否对SMC 具有调控作用,能否参与其表型转化,文献报道较少。磷脂酰肌醇3 激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)通路作为经典通路具有多种功能:是细胞内重要的信号传导通路,影响缺氧诱导因子1的表达[6],影响细胞的增殖、凋亡、自噬等过程[7]。本研究旨在探究miR-33a 是否通过PI3K/Akt/mTOR通路调控SMC 表型转化,为AS 的机制研究提供可参数据。
1 材料与方法
主要材料:原代人主动脉SMC(HASMC)及SMC 培养基(SMCM)购于美国Sciencell 公司,PDGF-BB 购于美国R&D 公司,噻唑蓝(MTT)、二奎啉甲酸(BCA)试剂盒购于上海碧云天生物技术有限公司,多聚赖氨酸(PLL)购于北京索莱宝科技有 限 公 司,miR-33a、ACTA2、TAGLN、OPN 及甘油醛-3-磷酸脱氢酶(GAPDH)引物合成于苏州金唯智生物科技有限公司,miRNA 及mRNA 反转录及实时荧光定量PCR(RT-qPCR)试剂盒购于TaKaRa 公司,miRNA 沉默(inhibitor)、过表达(mimics)、无义序列(NC)、沉默NC(inhibitor NC)由上海吉玛基因生物有限公司合成,脂质体Lipofectamine RNAiMAX Reagent 购买于美国赛默飞世尔科技公司,放射免疫沉淀测定(RIPA)蛋白裂解液购于上海雅酶生物科技有限公司,磷酸化兔抗p-PI3K、p-Akt、p-mTOR 购 于 美 国Cell Signaling Technology 公司,鼠抗β 肌动蛋白(β-actin)购于美国Proteintech 生物公司。
细胞培养:首先PLL 包被培养瓶(皿),用含5%胎牛血清及含有SMC 生长因子的SMCM 于37℃、5%CO2饱和湿度培养箱中常规培育、传代,第3~7 代用于实验。
细胞处理:HASMC 接种于96 孔板,分别给予不同浓度(10、20、50、80、100 ng/ml)PDGF-BB处理24 h、48 h。HASMC 接种于60 mm 培养皿,加入20 ng/ml PDGF-BB 处理48 h。
实验分组:确定用药浓度后分为对照组、PDGF-BB 组(20 ng/ml PDGF-BB 诱 导HASMC);转染细胞48 h 后分为NC 对照组、miRNA 过表达组(miR-33a mimics)、沉默NC+诱导组(inhibitor NC+PDGF-BB 诱导HASMC)、miRNA 沉默+诱导组(miR-33a 敲减inhibitor+PDGF-BB 诱导HASMC)。
细胞增殖检测:PDGF-BB 分别处理细胞24 h 及48 h 加入MTT(20 μl/孔),37℃培养箱中孵育4 h,加二甲基亚砜150 μl 溶解蓝紫色结晶甲臜,酶联免疫检测仪测A490 nm 波长吸收值。计算细胞活力公式为:细胞活力=(处理组A 值-空白组A 值)/(对照组A 值-空白组A 值)×100%。
细胞迁移能力检测(细胞划痕实验):细胞接种于背后划线的6 孔板,待第二天贴壁后用枪头划线,磷酸缓冲盐溶液(PBS)清洗3 次,分别加入不同 浓 度(10、20、50、80、100 ng/ml)PDGF-BB,放入37℃、5% CO2培养箱培养,在0、24、48 h 取样拍照。
miRNA 筛选:为寻找可能在SMC 表型转化中具有调控作用的miRNA,将建立好的模型细胞送做RNA 测序,根据测序结果挑选在模型中表达存在差异的miRNA,并进行验证。
验证miR-33a 功能:细胞传代至6 孔板(2×105个/孔),生长至70%~80%融合时进行转染。按照Lipofectamine®RNAiMAXReagent 转染试剂说明书操作,应用无血清的SMCM 分别稀释miR-33a inhibitor、inhibitor NC、miR-33a mimics、NC(转染混合液A)及 转 染 试 剂Lipofectamine®RNAiMAX Reagent(转 染混合液B),转染混合液A 及转染混合液B 按1:1 体积充分混匀,室温孵育5 min 后滴入6 孔板,轻摇均匀,放入细胞培养箱。NC 对照组、miRNA 过表达组给予更换新鲜培养基继续培养48 h;沉默NC+诱导组、miRNA 沉默+诱导组更换含PDGF-BB 终浓度为20 ng/ml 的新鲜培养基温箱孵育48 h。
RT-qPCR 检 测:PBS 清 洗 细 胞2 遍, 加 入RNAisoplus 试剂裂解细胞,混匀震荡后冰上裂解10 min;加入三氯甲烷200 μl,冰上静置15 min 后,4℃离心机12 000 转/min,离心15 min;加入异丙醇500 μl,冰 上 静 置10 min,4 ℃离 心 机,12 000 转/min,离心10 min,弃上清保留沉淀,75%乙醇清洗沉淀后应用焦碳酸二乙酯(DEPC)水溶解。超微量分光光度仪检测RNA 浓度及纯度(A260/A280 比值在1.8~2.0)。TaKaRa 反转录试剂盒进行miRNA 及mRNA 反转录,扩增试剂盒进行RT-qPCR,检测miRNA、mRNA 表达情况,采用2-ΔΔCt法计算目的基因的相对表达量。
蛋白免疫印迹(Western blot)分析:RIPA 法提取总蛋白,BCA 试剂盒检测蛋白浓度。等量上样,用10%和12% SDSPAGE 聚丙烯酰胺凝胶,电泳上层胶60 V 40 min,下层胶100 V 90 min,转膜[聚偏二氟乙烯(PVDF)膜]300 mA 90 min,5%脱脂牛奶室温封闭1 h,一抗4℃孵育过夜,次日TBST 缓冲液洗膜后,二抗室温孵育1 h,化学发光凝胶成像分析系统成像显影,ImageJ 软件进行灰度值分析。
统计学方法:采用SPSS 25.0 软件进行统计分析、GraphPad Prism 8 绘图。计量资料采取均数±标准差(±s)表示,多组分析采用单因素方差分析,组间比较采取LSD 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 平滑肌细胞表型转化模型建立
细胞增殖率检测:MTT 检测结果显示,与不处理相比,使用不同浓度(10、20、50、80、100 ng/ml)PDGF-BB 分别诱导24 h、48 h 后,HASMC 的增殖率均明显升高(P均<0.01),其中以20 ng/ml 浓度处理48 h 后增值率[(183.607±6.188)%]升高最为明显[不处理时为(100.000±3.756)%,P<0.0001]。
细胞迁移能力检测:细胞划痕实验显示,与不处理相比,使用不同浓度(10、20、50、80、100 ng/ml)PDGF-BB 分别诱导24 h、48 h 后,HASMC的迁移率均明显升高,其中以20 ng/ml 处理48 h时迁移率升高最明显。因此,结合MTT 检测与细胞划痕实验结果后,最终选择PDGF-BB 浓度为20 ng/ml处理48 h作为SMC表型转化模型建立的浓度。
SMC 标志物表达量检测:RT-qPCR 检测结果显 示,PDGF-BB 组HASMC 经 诱 导 后,ACTA2、TAGLN mRNA 表 达 水 平( 分 别 为0.081±0.004、0.235±0.010)较对照组(1.003±0.095、1.001±0.054)均明显下降(P均<0.0001),OPN mRNA 表达水平(3.472±0.227)较对照组(1.017±0.235)则明显升高(P<0.001)。Western blot 结果也显示,与对照组相比,PDGF-BB 组HASMC 经 诱 导 后,ACTA2、MYH11、CNN1 蛋白表达量均下降,OPN 蛋白表达量则升高(P均<0.05),见图1。

图1 Western blot 检测PDGF-BB 诱导对HASMC 表型转化相关标志物蛋白表达量的影响(n=3)
PI3K/Akt/mTOR 通路检测(图2):Western blot 结果显示,与对照组比较,PDGF-BB组HASMC经诱导后,p-PI3K(1.00±0.02 vs. 1.11±0.01)、p-Akt(1.00±0.04 vs. 1.90±0.01)、p-mTOR(1.00±0.03 vs. 1.12±0.01)蛋白表达量均升高(P均<0.05),说明PDGF-BB 诱导可激活PI3K/Akt/mTOR 通路,影响SMC 表型转化。

图2 Western blot 检测PDGF-BB 诱导对HASMC 中PI3K/Akt/mTOR 蛋白表达量的影响(n=3)
2.2 miRNA 筛选及验证
从测序结果中挑选表达量具有差异的miRNA进行验证,结果发现,miR-33a 差异最明显。
2.3 验证miR-33a 在平滑肌细胞表型转化中的功能
与NC 对照组相比,miRNA 过表达组细胞中miR-33a 表达量显著升高(P<0.001),ABCA1、ACTA2、TAGLN mRNA 表达水平显著降低(P分别<0.001、<0.01、<0.05),见图3。
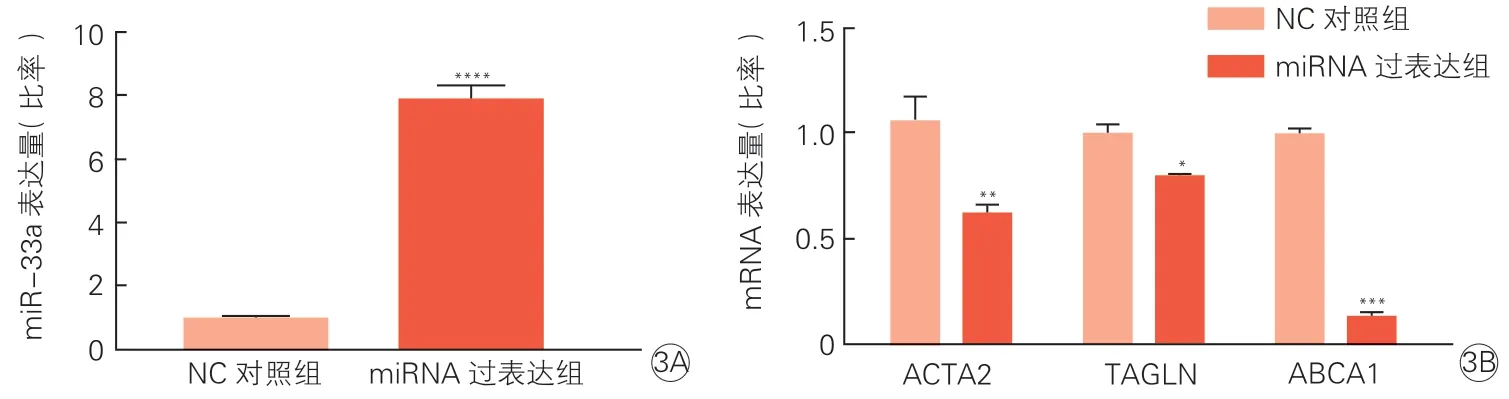
图3 RT-qPCR 检测过表达miR-33a 对HASMC 中miR-33a(3A)及各标志物mRNA(3B)表达量的影响(n=3)
与 沉 默NC+ 诱 导 组 相 比,miRNA 沉 默+ 诱导组细胞中miR-33a 表达量显著降低,ABCA1、ACTA2 mRNA 表达水平均显著升高,OPN mRNA 表达水平显著降低(P均<0.01),见图4。
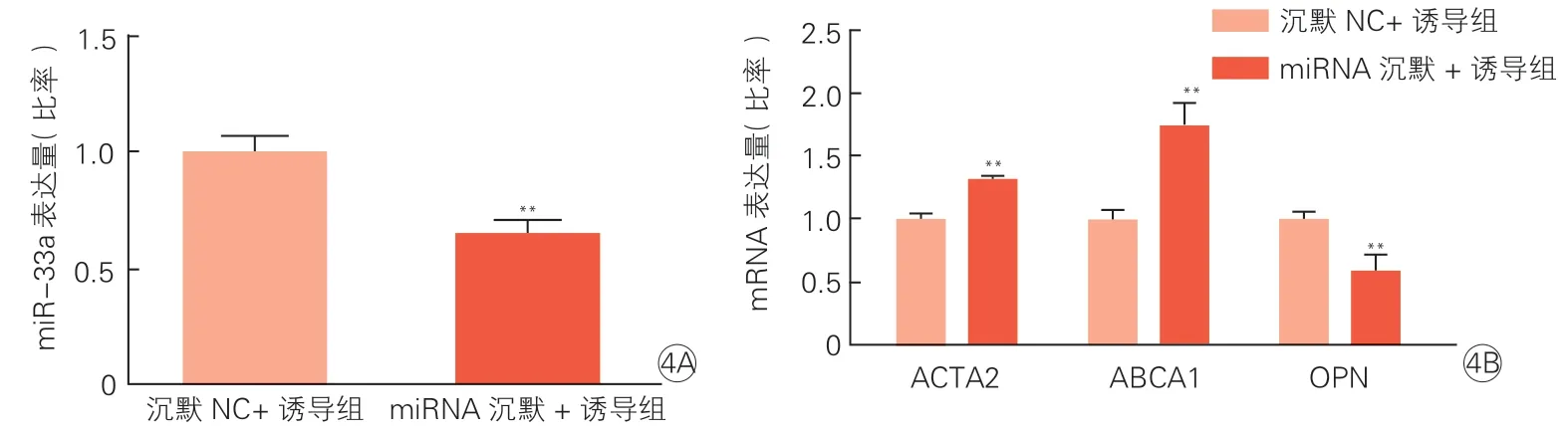
图4 RT-qPCR检测沉默miR-33a+PDGF-BB诱导对HASMC中miR-33a(4A)及各标志物mRNA(4B)表达量的影响(n=3)
Western blot 结果显示,与NC 对照组相比,PDGF-BB 组HASMC 经 诱 导 后,ACTA2、CNN1 蛋白表达量均下降(P均<0.001),OPN 蛋白表达量升高(P<0.01);miRNA 过表达组ACTA2、CNN1 蛋白表达量下降(P分别<0.01 和<0.05),OPN 蛋白表达量升高(P<0.001);与miRNA 过表达组相比,miRNA 沉默+诱导组ACTA2、CNN1 蛋白表达量均升高(P<0.05 和<0.01),OPN 蛋白表达量下降(P<0.01),见图5。

图5 Western blot 检测转染miR-33a 对HASMC 各标志物蛋白表达量的影响(n=3)
划痕实验结果显示,与NC 对照组相比,miRNA 过表达组细胞迁移能力升高,而miRNA 沉默+诱导组细胞迁移能力降低,见图6。

图6 细胞划痕实验检测转染miR-33a±PDGF-BB 处理后对HASMC 细胞迁移能力的影响(×4)
2.4 验证miR-33a 对PI3K/Akt/mTOR 通路的影响(图7)
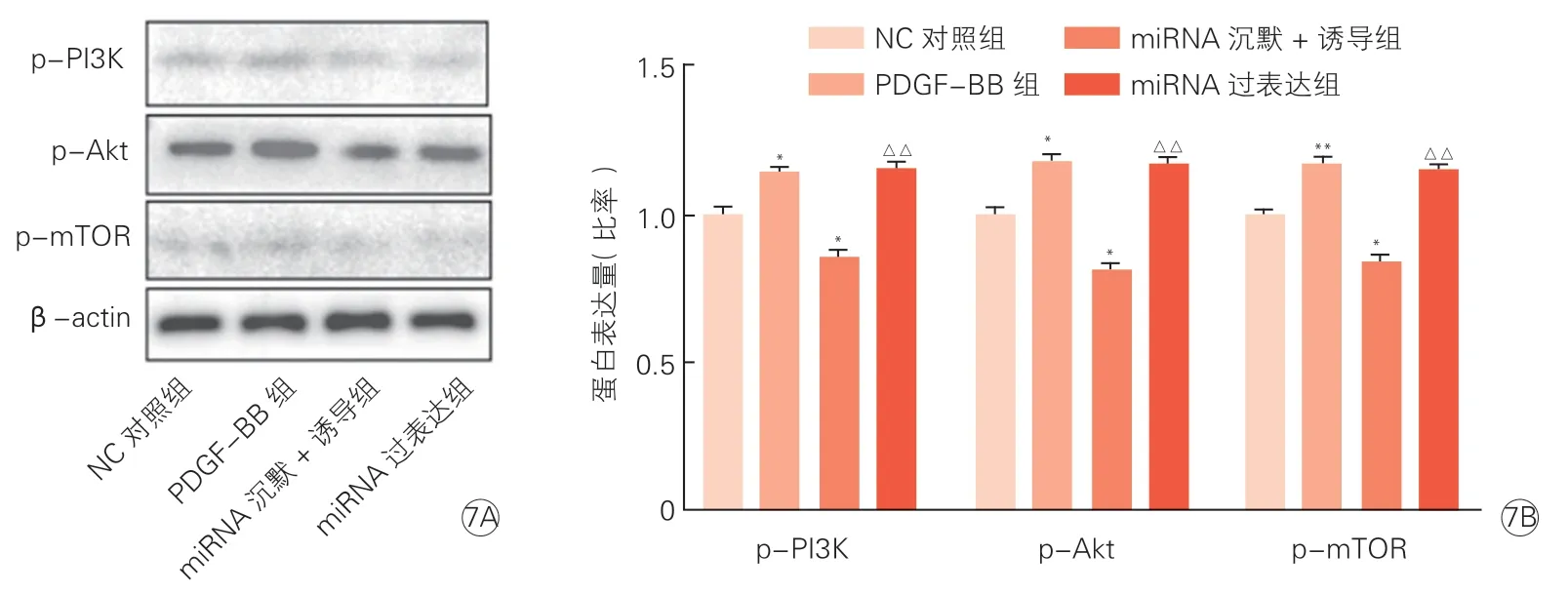
图7 Western blot 检测转染miR-33a 对HASMC 中PI3K/Akt/mTOR 通路蛋白表达量的影响(n=3)
Western blot 结果显示,与NC 对照组相比,PDGF-BB 组HASMC 的PI3K/Akt/mTOR 通路被激活;miRNA 沉默+诱导组p-PI3K、p-Akt、p-mTOR 蛋白表达量下降(P均<0.05);miRNA 过表达组p-PI3K、p-Akt、p-mTOR 蛋白表达量明显高于miRNA 沉默+诱导组(P均<0.01)。
3 讨论
SMC 是血管的重要组成部分,正常情况下位于血管中膜,起到维持血管张力和收缩血管的功能。当内皮损伤、存在血脂异常或慢性炎症时,SMC 会被诱导去分化,从“收缩表型”转化为“合成表型”,表现为收缩标志蛋白表达下降、细胞增殖和迁移能力升高[8]。本研究使用PDGF-BB 诱导HASMC 构建表型转化细胞模型,使SMC 从收缩表型向合成表型转化,其增殖、迁移能力升高,收缩表型标志物ACTA2、TAGLN、CNN1 及MYH11 等表达降低,合成表型标志物OPN 表达升高,该过程参与AS 斑块的发生和发展[9],因此,探究SMC 表型转化可以为AS 机制研究和治疗靶点提供可参数据。
近年来的研究表明,很多miRNA 参与AS 的发生、发展。miR-22-3p[10]、miR-214-3p[11]调控SMC分 化;miR-302a 促 进SMC 的 增 殖 和 迁 移[12];miR-34a 促进SMC 钙化[13];let-7 miRNA 家族可抑制SMC的炎症反应[14],miR-155 影响SMC 的表型转化[15],27nt-miRNA 可抑制SMC 凋亡[16],均调控SMC 的功能,影响AS 的发生和发展。本研究旨在寻找在SMC 表型转化中具有调控作用的miRNA,因此通过对正常SMC 和加PDGF-BB 诱导的SMC 进行测序分析,筛选表达有差异的miRNA 进行验证,发现miR-33a 异常增高。miR-33a 是miR-33 家族(包括miR-33a 和miR-33b)一员,miR-33a 位于22 号染色体上SREBP-2 基因的第15 内含子中,miR-33b 存在于17 号染色体上SREBP-1 基因的第17 内含子中[17]。miR-33a 最重要的靶蛋白是ABCA1,而ABCA1 是细胞内胆固醇从肝脏流出到载脂蛋白A1以产生高密度脂蛋白的关键介质,因此miR-33a 主要与胆固醇代谢相关[18]。本研究通过沉默或过表达miR-33a 后检测SMC 表型转化相关指标,发现单纯过表达miR-33a 后收缩表型标志物表达降低、合成表型标志物表达升高、SMC 的迁移能力得到提升,这提示miR-33a 有可能参与SMC 表型转化;而PDGF-BB 诱导的同时沉默miR-33a 可逆转PDGFBB 引起的表型转化。由此,我们确定miR-33a 对SMC 表型转化具有显著的调控作用。
同时,使用PDGF-BB 诱导后SMC 发生表型转化时,PI3K/Akt/mTOR 信号通路被激活。在AS 中,氧化型低密度脂蛋白诱导的巨噬细胞源性泡沫细胞即是通过PI3K/Akt/mTOR 信号传导实现的[19],当PI3K/Akt/mTOR 信号通路中的p-Akt 和p-mTOR 表达降低时,还可促进巨噬细胞自噬[20]。而且,PI3K/Akt/mTOR 信号通路的激活不仅可刺激内皮细胞损伤[21],还影响SMC 的增殖[22]和凋亡[23]。本研究在验证miR-33a 对SMC 表型转化的调控作用的同时,还发现沉默或过表达miR-33a 可影响PI3K/Akt/mTOR 信号通路的激活状态,说明miR-33a 可能通过PI3K/Akt/mTOR 信号通路来发挥其对SMC 表型转化的调控作用。
综上所述,本研究显示,miR-33a 可激活PI3K/Akt/mTOR 信号通路,促进SMC 表型转化,加快AS 的发生和发展,提示miR-33a 有成为AS 新治疗靶点的可能,但其发挥作用的具体靶向与机制尚需进一步研究。
利益冲突:所有作者均声明不存在利益冲突

