钙结合蛋白S100A16在胰腺癌中的表达及临床意义
赵素月,张玲,郑莹,姚丽,王乾合,李迅,3,朱克祥,3
0 引言
胰腺癌是具有强侵袭性的恶性肿瘤[1]。胰腺癌患者临床症状不易发现,转移率高,死亡率高,患者五年生存期短,生活质量差[2-3]。全球范围内,胰腺癌是男性和女性癌症第七大死亡原因[4]。因此迫切希望寻找到与胰腺癌相关基因,此基因具有早期诊断胰腺癌以及未来作为胰腺癌治疗的靶标等功能。为胰腺癌患者找到新的治疗希望。S100蛋白家族是一个多基因的钙结合家族,由25个成员组成,每个成员由一个单独的基因编码[5]。S100蛋白家族是一个低分子量的酸性钙调节蛋白家族[6]。S100蛋白家族特征是存在两个Ca2+调控的EF-hand型基序,c端是所有EF-hand蛋白的共同特征,另一个是n端S100家族特有。在c末端EF-hand区域之后是一段被称为c末端延伸的氨基酸。在两个EF-hand域之间的区域称为铰链。在不同的蛋白质中,c端延伸和铰链区域的可变性最大,因此它们决定了蛋白质的特定生物学特性[7]。S100蛋白通过与靶蛋白相互作用,参与细胞生长、分化、运动、收缩、转录、信号转导、蛋白磷酸化、细胞存活、细胞凋亡以及细胞周期调控等生物学过程[8]。S100蛋白与炎性反应、神经退行性疾病、抑郁症、唐氏综合征、囊性纤维化和癌症等许多疾病相关并参与其中[9]。S100A16是S100家族蛋白之一,从星形细胞瘤中分离出来,位于人类染色体1q21区域。S100A16在特定组织类型中广泛表达,如脂肪组织和大脑[10]。S100A16还被发现与多种肿瘤密切相关。S100A16在膀胱癌、肺癌、胃癌和卵巢癌等多种癌症中表达上调[11-14]。此外,S100A16的高表达与肺癌、前列腺癌和乳腺癌的不良预后显著相关[15]。本研究通过免疫组织化学实验探讨S100A16在胰腺癌中的表达及其临床意义。利用PPI预测等预测S100A16相互作用基因,揭示 S100A16与胰腺癌的相关性。
1 资料与方法
1.1 研究对象及数据收集
收集2015年6月—2019年12月于兰州大学第一医院普通外科确诊为胰腺癌且已行胰腺癌根治术的65例患者的胰腺癌组织病理切片(其中包括胰腺癌及癌旁组织)。由我院病理科医师采集标本及制作蜡块,所有的肿瘤标本由病理科医师确诊为胰腺癌,且所取癌旁组织也经证实为非肿瘤组织。纳入的标准:(1)术后病理学诊断为胰腺导管腺癌;(2)手术达到R0切除的标准。排除标准:(1)术后病理学诊断为非胰腺导管腺癌的其他类型胰腺癌;(2)术前曾接受放疗、化疗等相关抗肿瘤治疗。我们同时收集了所纳入的65例胰腺导管腺癌患者相关临床病理数据。纳入内容包括:性别、年龄、肿瘤的分化、TNM分期、血管侵犯、肿瘤部位、糖尿病病史、术前血清CA199水平、中位生存期。本研究经兰州大学第一医院伦理委员会批准,纳入研究患者均已知情同意。
1.2 实验试剂
兔抗人S100A16单克隆抗体,购自美国SAB公司,免疫组织化学实验工作滴度最终适合浓度为1:100;UltraSensitive TM S-P超敏试剂盒,DAB 显色剂盒均从福州迈新生物技术开发有限公司购得;二甲苯试剂、无水酒精试剂、不同浓度梯度配置的乙醇、苏木精染液,实验于兰州大学第一医院东岗病理科完成。
1.3 S100A16的免疫组织化学染色及判定
制作好的组织蜡块进行切片,二甲苯脱蜡,柠檬酸抗原修复,阻断内源性过氧化物酶,动物非免疫血清,一抗孵育:S100A16抗体使用一抗稀释液稀释至1:400,在2组玻片上分别滴加S100A16抗体和PBS(阴性对照),滴加生物素标记的IgG聚合物,滴加链霉素抗生素蛋白-过氧化物酶,最后显色和苏木精对比染色。由两位病理科老师单独进行阅片,阅片采用双盲法。免疫组织化学染色结果判断方法:阳性结果由染色指数所决定,染色指数SI=染色强度×染色范围。染色强度的判断:无色为0分,淡黄色1分,棕黄色2分,棕褐色3分;细胞的染色范围判定:阳性细胞数占所有细胞总数的百分比,1%~25%为1分,>25%~50%为2分,>50%则为3分[16]。
1.4 随访
患者治疗出院后采用电话随访方式进行随访,随访时间由2015年6月截至2021年12月,出院后1月、3月、6月、12月,以后每半年随访一次。随访率为100%。
1.5 生物信息学分析方法
通过生物信息学方法,使用GeneMANIA数据库对S100A16基因进行单基因预测分析,分析与S100A16相互作用蛋白。分子相互作用网络图展示了与目的基因有直接相互作用的所有分子之间的相互作用关系网络。使用Cytoscape的MCODE插件对S100A16蛋白相互作用网络进行关键子网络分析,得到与S100A16具有重要作用的蛋白。
1.6 统计学方法
采用SPSS26.0统计软件进行数据分析。用χ2检验比较S100A16蛋白的表达及与临床病理参数间的相关性。用Kaplan-Meier生存分析计算S100A16不同表达情况下的生存率,并绘制生存曲线。然后通过Log rank检验法验证S100A16的表达与预后的相关性。运用Cox比例风险模型进行预后的单因素及多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 S100A16在胰腺癌与癌旁组织中的表达
免疫组织化学结果表明S100A16主要在胰腺癌细胞膜中呈阳性表达,并且胞质同时表达,胰腺癌组织中的S100A16阳性表达率明显高于相应癌旁组织,差异有统计学意义(χ2=10.901,P=0.001),见表1、图1。

表1 胰腺癌与相应癌旁组织中S100A16的表达Table 1 Expression of S100A16 in pancreatic cancer and corresponding adjacent tissues
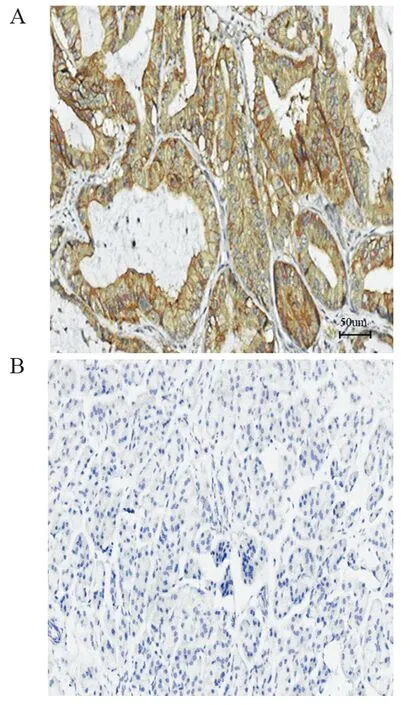
图1 S100A16在胰腺癌(A,×400)和癌旁组织(B,×400)中的免疫组织化学结果Figure 1 Immunohistochemical results of S100A16 expression in pancreatic cancer(A,×400) and adjacent tissues(B,×400)
2.2 S100A16的表达与胰腺癌患者临床病理参数之间的相关性
S100A16蛋白的表达与胰腺癌临床病理参数中的血管浸润和淋巴结转移有关,而与其中的性别、发病年龄、肿瘤的发生部位、是否具有糖尿病史、术前CA199水平、肿瘤的分化程度、肿瘤大小和TNM分期无关,见表2。
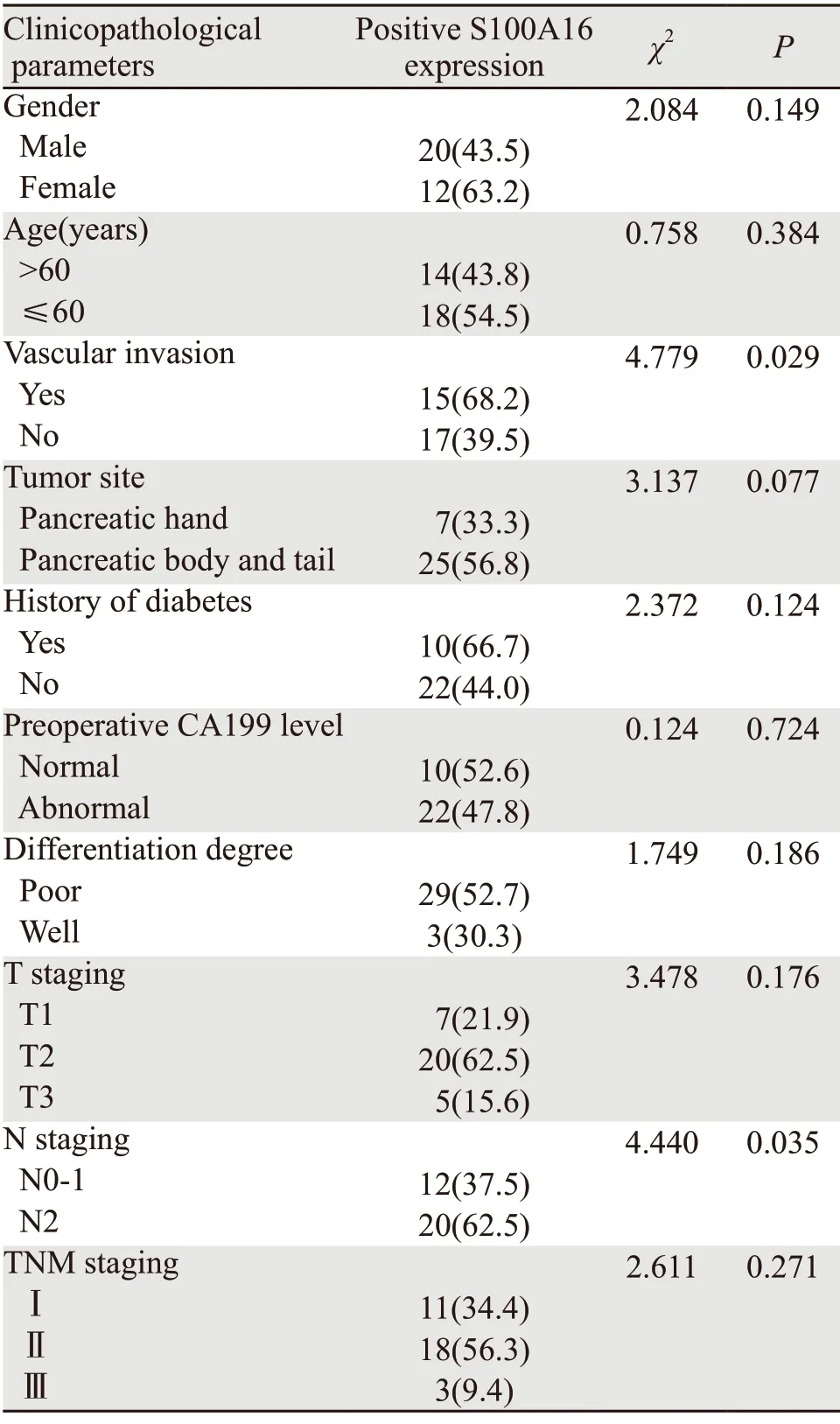
表2 S100A16的表达与胰腺癌患者的临床病理参数之间的相关性(n(%))Table 2 Correlation between S100A16 expression and clinicopathological parameters of pancreatic patients (n(%))
2.3 S100A16蛋白表达水平及临床病理参数与胰腺癌患者总体生存时间的相关性
截至2021年12月,65例胰腺癌患者仅有5名患者生存。生存分析结果显示S100A16表达水平是胰腺癌患者预后的独立预后因素,并且S100A16蛋白表达阳性是S100A16蛋白表达阴性患者死亡风险的1.528倍,见表3。

表3 S100A16蛋白表达水平及临床病理参数与胰腺癌患者总生存时间的单因素和多因素分析Table 3 Univariate and multivariate analyses of S100A16 protein expression level,clinicopathological parameters and overall survival time of patients with pancreatic cancer
2.4 S100A16表达水平与胰腺癌患者生存时间的相关性
Kaplan-Meier生存曲线、Log rank检验结果显示S100A16蛋白阳性表达组的中位生存时间为8月,S100A16蛋白表达阴性的中位生存时间为19月。S100A16蛋白阳性表达预后较阴性表达差异有统计学意义(P=0.037),见图2。
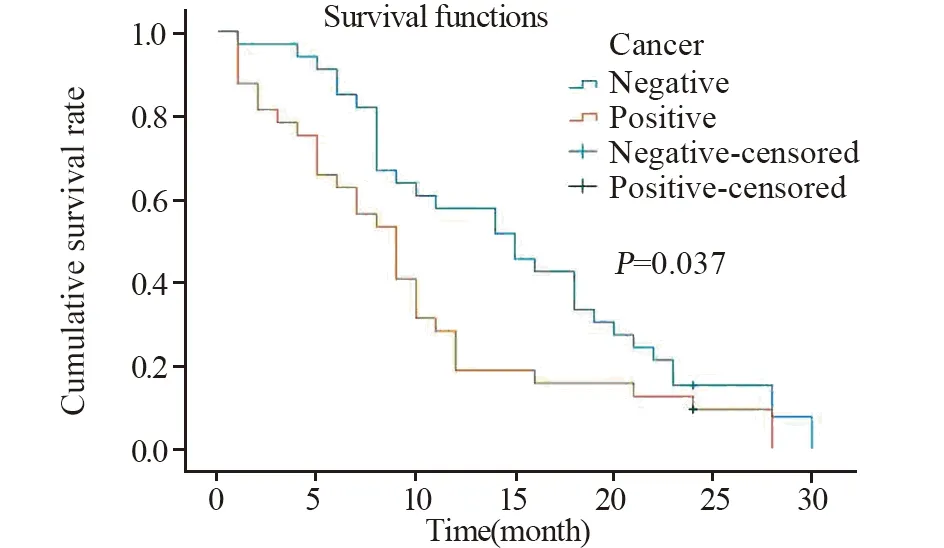
图2 胰腺癌组织中S100A16蛋白阳性表达与阴性表达的Kaplan-Meier生存曲线Figure 2 Kaplan-Meier survival curves of pancreatic cancer patients with positive and negative expression of S100A16 protein
2.5 S100A16基因与其他相互作用基因预测
数据库预测分析分子相互作用网络图,展示了与目的基因有直接相互作用的所有分子之间的相互作用关系网络,见图3。PPI预测S100A16相互作用蛋白包括S100A14、CPNE2、UBAC2、IDH3A、MDM2、STIM1、MSN、UCHL5、S100A13、SGSH、PERP、ESRRB、MPZL3、STMN1、PRDM1、PITX1、TMED10、TMEM9、IL36G、EPSTI1。使用Cytoscape的MCODE插件进行关键子网络分析,其中S100A14、IL36G、PITX1、PERP在相互作用网络中具有重要作用。
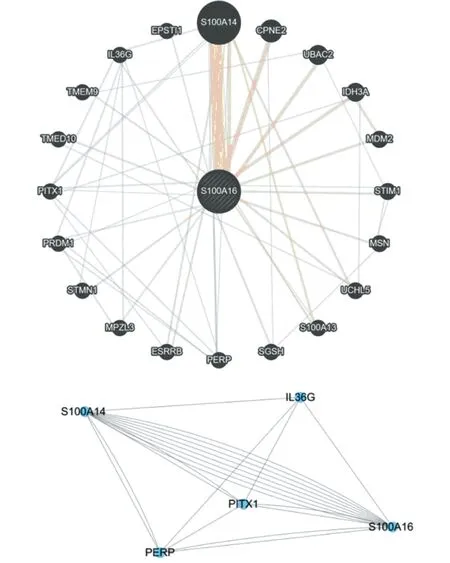
图3 钙结合蛋白S100A16 PPI分析结果和Cytoscape对PPI网络进行关键子网络分析图(引自GeneMANIA数据库)Figure 3 PPI analysis results of S100A16 and Cytoscape key sub-network analysis of PPI network (cited from GeneMANIA database)
3 讨论
S100A16与肿瘤关系密切,在膀胱癌、肺癌、甲状腺癌和卵巢癌等多种癌症中表达上调。并且S100A16的高表达与肺癌、前列腺癌和乳腺癌的不良预后显著相关[17-18]。本研究首先通过生物信息学方法得到S100A16基因在胰腺癌患者中高表达,高表达的患者具有较差预后。在癌症大数据的支持下进行了免疫组织化学实验。该观点在随后的免疫组织化学实验中得到证明,S100A16表达水平是胰腺癌患者预后的独立预后因素,并且S100A16蛋白表达阳性是S100A16蛋白表达阴性患者死亡风险的1.528倍。通过分析S100A16共表达基因与其相互作用蛋白,我们可以得到S100A16与S100A14密切相关。Sapkota等[19]研究S100A16和S100A14在口腔鳞状细胞癌中的相互作用,发现S100A14的过表达和敲低会导致细胞系中S100A16蛋白的上调和下调。然而,在S100A14过表达时,S100A16 mRNA没有上调,这表明对S100A16表达的调节不是由于增强的转录活性,而是由于转录后的调节。与之相反,S100A16过表达与S100A14蛋白表达无相关性,提示S100A14与S100A16之间存在单向调控。用蛋白合成抑制剂环己酰亚胺处理细胞时,细胞内S100A16和S100A14蛋白降解呈时间依赖性[19]。此外,该研究还发现,S100A16和S100A14降解的调控不依赖于蛋白质降解的经典蛋白酶体和溶酶体途径[19]。日本学者Tanaka研究S100A14、S100A16的表达与乳腺癌相关性,结果显示两个蛋白的共表达比单个蛋白表达更能预测乳腺癌的不良预后。并且S100A14和S100A16可通过与细胞骨架动力学的相互作用促进乳腺癌细胞的侵袭活性[20]。S100A16与S100A14两者是S100家族成员,位于同一染色体上。因此S100A16与S100A14关系并不明确,需要进一步的研究。
我们使用生物信息学分析S100A16与胰腺癌的相关性,不仅获得该基因特点,更为以后实验提供参考和指导。本研究认为S100A16与胰腺癌关系密切,有望成为胰腺癌新的诊断、预后标志物和治疗的靶点。

