核桃JrMYB44基因的结构与表达分析
代文强,李瑶玲,刘凯,李林晴,赵悦平,赵书岗
(1河北农业大学 现代科技学院,河北 保定 071001;2河北农业大学 生命科学学院, 河北 保定 071001; 3河北省山区农业工程技术研究中心,国家北方山区农业工程技术研究中心,河北 保定 071001; 4河北农业大学 园艺学院, 河北 保定 071001)
核桃(JuglansregiaL.)是世界著名的“四大坚果”之一,具有悠久的栽培历史,丰富的营养和良好的保健作用,是我国重要经济树种[1-2]。低温是影响植物生长发育的重要因素之一,全球每年因低温伤害造成的农林作物的经济损失高达数10亿[3-4]。核桃已在我国北方及西南地区广泛种植,但近年来频发的冻害和冷害,严重影响核桃的产量和品质。
1987年在玉米(ZeamaysL.)中发现首个与玉米糊粉层花青素形成有关的MYB转录因子COLORED1(C1),研究人员开始逐渐挖掘这类转录因子在植物中的各种作用[5]。在植物中,MYB类转录因子主要分为3个亚类:R1MYB、R2R3-MYB和R1R2R3-MYB,其中R2R3-MYB型转录因子是数量最多的MYB转录因子[6],目前在不同物种中共发现100~250个MYB家族基因[7-8],其中拟南芥[Arabidopsisthaliana(L.)Heynh.)]中至少有126个,除此之外葡萄(VitisviniferaL.)、玉米(Zeamays)、水稻(OryzasativaL.)、大豆[Glycinemax(L.)Merr.]中该类转录因子的数量分别为117个、157个、102个和224个[9]。MYB家族的转录因子是一个庞大的家族,参与复杂的调控系统,并在植物逆境功能中有着重要的功能[10]。已有研究表明,R2R3-MYB亚家族许多成员响应生物及非生物胁迫,如拟南芥AtMYB44通过调节气孔运动参与对干旱的应答过程[11-13],番茄(LycopersiconesculentumMiller)SlCMYB1在水稻中异源表达后使水稻在苗期抗冷性显著提高[14],甘蔗(SaccharumofficinarumL.)ScMYBAS1过表达后能提高植株耐盐胁迫能力[15]。MYB家族的转录因子在植物抵御低温胁迫的过程中发挥了重要的作用,研究人员将OsMYB4在拟南芥内过表达,发现其可通过提高细胞的抗氧化的能力来提高抗寒性[16-18]。张宇等人对白桦(BetulaplatyphyllaSuk.)BpMYB4基因在低温胁迫应答反应的研究中发现,过表达BpMYB4基因能使SOD、POD、CAT等物质的活性增强,减少植物因胁迫受到的氧化伤害,进而提高白桦抵御低温的能力[19]。
目前核桃的研究多集中在栽培技术和产量及品质形成等方面,对核桃响应逆境胁迫的调控机制鲜有报道。本研究以“辽宁8号”和“清香”为试材[20],采用生物信息学方法,对JrMYB44基因及其编码的蛋白的结构特点、保守结构域以及跨膜结构、蛋白互作预测等进行研究,分析其在低温胁迫下的转录表达情况,旨在为进一步解析MYB响应胁迫反应的调控机制奠定基础。
1 材料与方法
1.1 试验材料
试验材料取自河北农业大学标本园栽植的“清香”和“辽宁8号”盆栽苗,树龄2 a,树高0.5 m,长势好,无病虫害。将整株核桃幼苗放入恒温培养箱内,进行活体0.5 ℃低温胁迫处理,并设置对照。48 h后对“清香”、“辽宁8号”及对照组叶片进行采集,立即放入液氮,于超低温冰箱(零下80 ℃)保存备用。对“清香”的幼茎(4月15日)、幼叶(4月15日)、雌花、雄花、根、老叶(7月15日)、芽进行采集,立即放入液氮,于超低温冰箱(零下80 ℃)保存备用。
1.2 试验方法
1.2.1JrMYB44生物信息学分析 以拟南芥AtMYB44为参考基因,通过NCBI数据库比对获得核桃JrMYB44(GeneID:109009120)基因序列。利用ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)工具查找最长开放阅读框,并翻译得到氨基酸序列后;利用在线分析网站ExPASy(https://web.expasy.org/protparam/)分析核桃JrMYB44蛋白理化性质;利用TMHMM Serverv.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测其跨膜结构;利用PSIPRED V4.0 (http://bioinf.cs.ucl.ac.uk/psipred/)、SWISS-MODEL(https://swissmodel.expasy.org/interactive)对蛋白质二级结构、三级结构进行预测分析;利用在线工具SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)分析蛋白信号肽结构;利用NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白磷酸化位点;利用MEME(http://meme-suite.org/tools/meme)工具对保守基序进行分析;利用Plant-mPLoc、Plant CARE和DNAMAN进行亚细胞定位预测、启动子分析和多序列比对;利用MEGA7软件构建系统进化树(neighbor-joining,bootstrap值设为1 000),用于系统进化分析的拟南芥和其他物种的蛋白序列来自NCBI和TAIR数据库。
1.2.2 转录表达分析 将超低温冰箱中保存的经低温胁迫处理48 h的“清香”和“辽宁8号”叶片样本及保存的“清香”不同组织样本(雌花、果、老叶、幼茎、幼叶、雄花、芽)送至北京诺禾致源有限公司进行转录组测定,重复3次。
2 结果与分析
2.1 核桃JrMYB44 DNA 序列及编码氨基酸序列分析
根据所得核桃JrMYB44基因序列进行分析,结果显示JrMYB44基因全长为1 362 bp,开放阅读框的长度为966 bp,共编码321个氨基酸(图1)。
2.2 核桃JrMYB44基因编码氨基酸的理化性质、保守结构域及结构分析
利用在线分析工具ProtParam tool对核桃Jr-MYB44编码氨基酸进行分析预测,结果显示其分子量为34.798 kD,理论等电点为7.600,带负电荷残基总数(Asp+Glu)为35,带正电荷残基总数(Arg+Lys)为36,分子式为C1494H2409N445O480S16,原子总数为4 844,不稳定系数为57.470,脂肪族氨基酸指数为72.310,平均总亲水性为-0.505,属于不稳定亲水蛋白。预测其包含19种氨基酸,丙氨酸(Ala)含量最高,苯丙氨酸(Phe)含量最少。保守结构域分析发现其存在MYB家族的功能域(图2-a)。JrMYB44蛋白的二级结构分析显示存在许多螺旋、β-折叠、延伸链和卷曲结构,其中α螺旋占33.64%,不规则卷曲等其余结构共占66.36%(图2-b)。分析JrMYB44蛋白的三级结构,结果显示存在螺旋结构(图2-c)。

注:*是终止密码子。
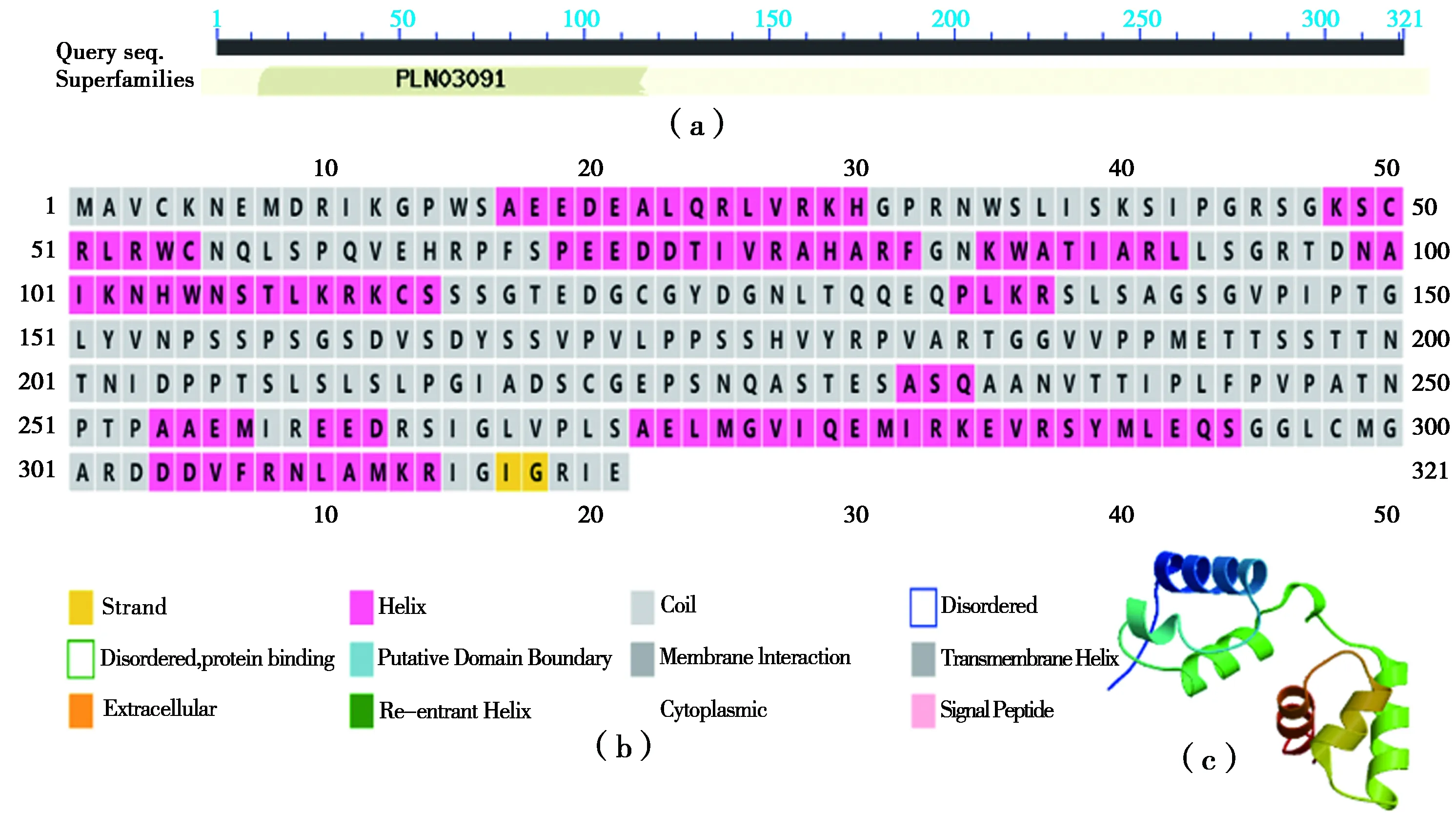
注: (a)是JrMYB44保守结构域预测; (b)是JrMYB44二级结构预测; (c)是JrMYB44三级结构预测。
2.3 核桃JrMYB44蛋白磷酸化位点和跨膜结构分析预测
JrMYB44蛋白磷酸化位点分析结果显示其氨基酸序列有可能发生磷酸化的氨基酸位点共有46个,酪氨酸磷酸位点3个,苏氨酸磷酸化位点12个,丝氨酸磷酸化位点31个(图3-a),推测其主要是通过丝氨酸磷酸化影响相关功能。采用TMHMM Serverv.2.0进行分析预测结果显示JrMYB44不存在跨膜蛋白结构(图3-b)。

注:(a)中横坐标为所提交蛋白序列对应氨基酸残基序号,纵坐标为发生磷酸化可能性;(b)中横坐标为所提交蛋白序列对应氨基酸残基序号,纵坐标为横轴上每个氨基酸位于膜内测(inside)、膜外侧(outside)和跨膜螺旋区概率值。
2.4 核桃JrMYB44蛋白的信号肽、亚细胞定位、蛋白互作预测与启动子分析
JrMYB44蛋白中不存在信号肽,蛋白定位于细胞核中。采用Plant CARE在线网址分析JrMYB44基因的启动子区的顺式作用元件,发现存在光响应调节元件ACE、G-Box、厌氧诱导调节元件ARE、启动子和增强子元件CAAT-Box和多个启动子增强元件(图4)。通过比对获得核桃MYB44蛋白与拟南芥MYBR1(又名MYB44)蛋白为高度同源蛋白(图5),以其为参考进行蛋白互作预测,结果表明在互作蛋白中,部分参与响应低温胁迫途径[21-23]。

注:方框里为顺式作用元件的序列及名称。
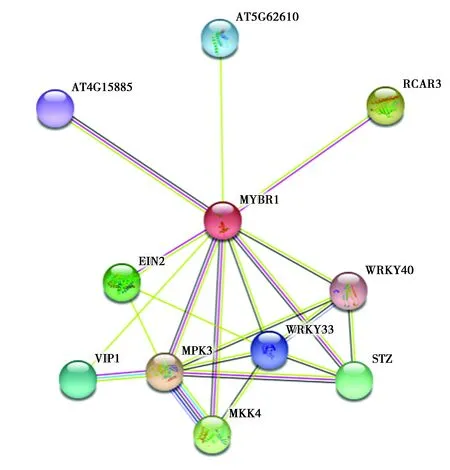
图5 JrMYB44蛋白互作预测
2.5 不同植物间的JrMYB44的同源性比对及进化分析
利用DNAMAN对JrMYB44及与其同源性较高的序列进行多序列比对,结果显示,核桃JrMYB44蛋白与其他植物一样有R2R3-MYB功能域(图6)。
将JrMYB44序列提交到NCBI蛋白质数据库中进行比对,JrMYB44与胡杨PeMYB44-like(PopuluseuphraticaOliv.,XP_011006987.1)、毛果杨PtMYB44(Populustrichocarpasubsp.hastata,XP_024451715.1)、枣ZjMYB44(ZiziphusjujubaMill.,XP_015865918.1)、葡萄 VrMYB44(VitisviniferaL.,XP_034691187.1)、野大豆GsMYB44-like(Glycinemax(L.) Merr.,XP_028210829.1)、甜樱桃PaMYB44-like(Prunusavium,XP_021829741.1)、橡胶树HbMYB44(Heveabrasiliensis, XP_021654680.1)、桃PpMYB44(Prunuspersica,XP_020421556.1)、阿月浑子PvMYB44-like(Pistaciavera,XP_031253628.1)、欧洲栓皮栎QsMYB 44-like(Quercussuber,XP_023910544.1)、南瓜CmMYB44-like(Cucurbitamoschata,XP_022950120.1)、陆地棉GhMYB44-like(GossypiumhirsutumL.,XP_016731006.1)、树棉GaMYB44-like(GossypiumarboretumL., XP_017603005.1)、苹果MdMYB44-like(MalusMill.,XP_028963833.1)、白梨PbMYB44(Pyrus
bretschneideri,XP_009367 649.1)进行同源性分析,相似性分别为62.88%、65.07%、61.38%、63.88%、60.24%、61.88%、62.39%、59.94%、62.01%、57.85%、63.73%、55.59%、56.93%、61.56%、62.73%,与毛果杨PtMYB44的同源性最高。采用MEME分析核桃JrMYB44和与其亲缘性较高的MYB蛋白序列,预测了10个motif且标注了其在相应序列的位置(图7)。系统进化分析与核桃JrMYB44同源性较高蛋白,结果显示,JrMYB44与毛果杨PtMYB44亲缘关系最近。
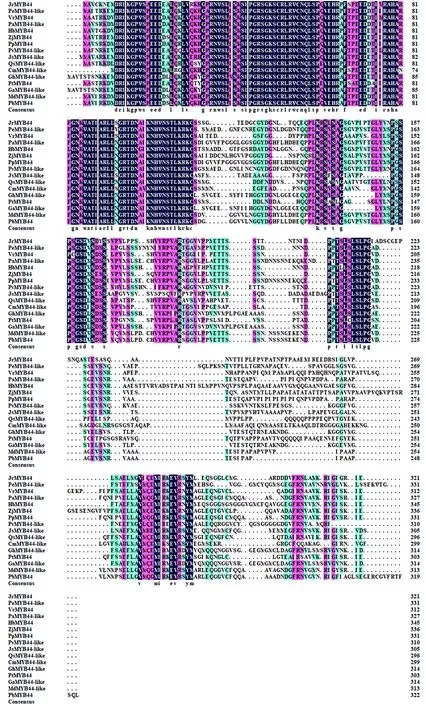
图6 JrMYB44与其他植物MYB44蛋白序列多重对比,方框标记星号氨基酸是HER基序
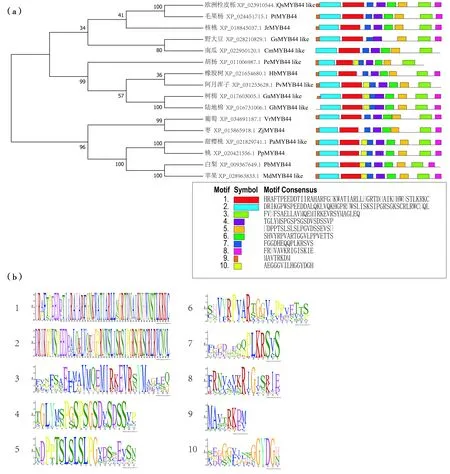
注:(a)是JrMYB44与其他物种进化关系; (b)是保守基序
2.6 JrMYB44在不同组织与低温胁迫下的表达分析
利用核桃转录组中的数据分析低温胁迫48 h下在“清香”和“辽宁8号”品种的JrMYB44转录表达规律。结果显示在对“清香”和“辽宁8号”核桃盆栽苗0 ℃低温胁迫处理0 h、48 h后,JrMYB44转录水平显著升高,“辽宁8号”是对照组的4.00倍,“清香”是对照组的3.03倍(图8)。结合“清香”不同组织转录组数据分析,JrMYB44在“清香”芽中表达量最多,在“清香”老叶中转录表达量最少(图9)。
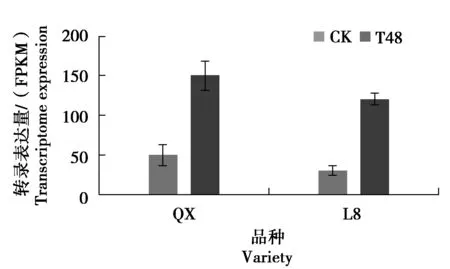
注:QX是清香;L8是辽宁8号。
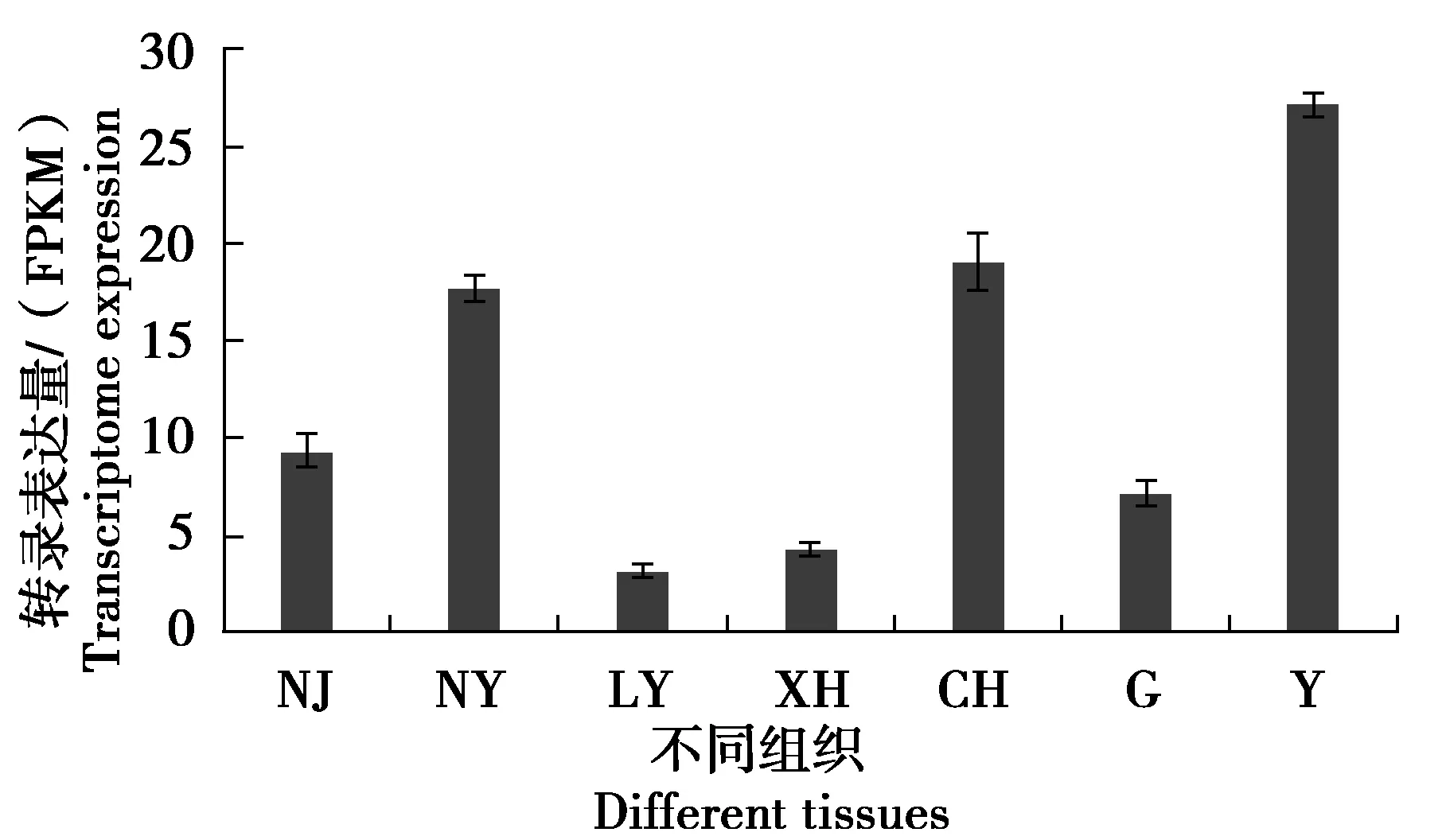
注:CH是雌花;G是根;LY是老叶;NJ是幼茎;NY是幼叶;XH是雄花;Y是芽。
3 讨论与结论
MYB转录因子家族是一类含有高度保守的DNA结构域的转录因子,其在草本植物(番茄、马铃薯、水稻等)、木本植物(杨树、苹果、核桃等)中广泛存在[24]。MYB家族转录因子与植物的逆境响应有着很密切的关系,在调节植物生长发育、抵御不利生长条件等方面上有着重要的作用[25]。李思芸等对铁皮石斛的R2R3-MYB转录因子全基因组进行了鉴定及生物信息学分析,对不同的R2R3-MYB进行归类,其中铁皮石斛DoMYB44归为S22亚类,该亚类参与非生物胁迫调控反应以及生长发育调控[26];李颖等对番茄SlMYB44基因进行研究,结果显示SlMYB44基因对番茄冷害有响应,可能影响番茄御冷机制[27]。李敏等人将拟南芥AtMYB44基因成功转入水稻中后,诱导其过表达,结果得出,在干旱、低温、或同一浓度的NaCl和ABA处理1.5~3 h的条件下AtMYB44的表达量明显提高,且达到最大值,这与本研究中,对“辽宁8号”和“清香”的叶片进行0 ℃低温胁迫处理48 h后的结果相一致[21]。已有研究报道,在刺葡萄、杨树等植物中,MYB转录因子通过调控植物类黄酮的合成,进而介导逆境响应机制[28-29]。
本研究利用生物信息学方法对JrMYB44基因结构及进化关系等进行分析预测,结果显示,JrMYB44含有R2R3-MYB结构域,JrMYB44与毛果杨PtMYB44亲缘关系最近。通过对JrMYB44基因的启动子顺式作用元件分析,推测JrMYB44可能是具有多种环境响应能力的转录因子。蛋白互作分析显示部分互作蛋白参与响应低温胁迫途径,由于JrMYB44含有保守的R2R3-MYB结构域,并根据前人对相关基因的研究,结合低温胁迫后基因表达量的结果,可以推断得出,JrMYB44基因与核桃的抗低温胁迫存在着一定的关系,推测JrMYB44可能通过影响类黄酮的合成从而参与调控核桃的耐低温胁迫机制。此外,本研究通过JrMYB44在不同组织表达水平分析,JrMYB44在茎、叶、芽等幼嫩器官中高表达,预期同源的拟南芥MYB转录因子AtMYB44属S22亚类,该亚类参与生长发育调控相一致,说明核桃JrMYB44可能在幼嫩器官的生长发育过程中参与调控[30]。
JrMYB44基因长1 362 bp,最大开放阅读框966 bp,与毛果杨PtMYB44进化关系较近,转录水平上能够响应低温胁迫诱导升高;并且在“清香”芽、幼叶和雌花中转录表达水平较高。本研究为进一步探究核桃JrMYB44的相关功能提供了理论基础。

