急性低氧应激对鲫鱼血液生化指标的影响
王雪芹,阳 涛
(1 水产健康养殖四川省重点实验室,四川 成都 610041;2通威股份有限公司动物保健研究所,四川 成都 610041)
随着人们对鲜活水产品需求的日渐增大[1],水产动物运输量也不断增大,运输过程中环境胁迫所引起的水产动物应激反应问题日渐突出,尤其是长时间运输造成水体的溶氧不断消耗,会引起鱼类强烈的应激反应甚至死亡。适宜的溶氧水平对鱼类的生物活动会起到积极作用,当水体低氧时,会造成机体血液生化指标的变化,引起鱼类应激反应[2-3]。
应激作用下,鱼类机体大量分泌皮质醇(COR),可调节糖原、脂肪和蛋白质的代谢[4-6],加速糖异生,为机体提供能量,对抗应激[7-8]。因此血清COR和葡萄糖(GLU)含量常被作为检测鱼体应激的敏感指标[9]。低氧环境下,鱼体血液摄取和携带氧气的能力会发生改变,引起血红蛋白(Hb)和高铁血红蛋白(MetHb)等指标的变化[10];体内热休克蛋白70(Hsp70)基因的表达量会显著上调[11],同时,机体超氧化物歧化酶(SOD)等的活力上升,用以清除过量的活性氧自由基(ROS)[14],维持正常的生理活动。因此,研究血液相关生化指标的变化,综合评价鱼类在持续低氧状态下的应激水平,对水产动物运输策略有重大的理论和实践指导意义。
鲫鱼(Carassiusauratus)是中国主要的淡水经济鱼类之一,可作为低氧应激研究的理想鱼类对象[15]。本研究在急性低氧条件下,研究鲫鱼血液生化指标的变化,以期为鲫鱼的科学养殖和运输提供理论指导。
1 材料与方法
1.1 材料
鲫鱼购买自成都市新津县金华镇养殖户塘口,鱼体质量为(54.24±5.65)g,体长为(14.82±0.41)cm,为同一批次,且健康无病。鲫鱼购进后,使用1%食盐水浸浴5 min,然后将100尾鲫鱼暂养于规格为150 cm×60 cm×70 cm的玻璃缸中(养殖用水体积500 L)。暂养期间保持水体温度(20.0±0.5)℃,水中溶氧>5 mg/L,pH 7.2~7.6,氨氮≤0.1 mg/L,每天上午使用曝气自来水换水一次,每次换水量约为养殖水体的1/2。每天投喂饲料两次,时间分别为9:00和16:30,投饲率约1.5%,饲料为通威饲料152#,2.0 mm粒径膨化料。暂养10 d后待试验鱼状态及摄食稳定后开始进行低氧应激试验。试验开始前禁食24 h。
1.2 试验设计
挑选体质健康,质量均匀的鲫鱼25尾,放置在150 L的玻璃缸中。低氧水平的设置参考相关文献[16-18]的研究,溶氧设置为0.6 mg/L。试验前,完成常氧组(记为0 h,即对照组)的取样,随机取5尾,此时的溶氧含量为6.54 mg/L,水温为20.1℃。随后往鱼缸中持续注入氮气,并开始计时,待溶氧下降到0.6 mg/L左右后,调节氮气和空气的注入流量来稳定水中的溶氧。分别在试验进行到3 h、6 h、12 h和24 h时进行采样。每个时间点从缸中随机取样5尾。低氧胁迫期间水体溶氧(0.61±0.23)mg/L,水温(20.1±0.3)℃。整个试验期间每1 h用哈希溶氧测定仪对水体溶氧进行监测一次。重复试验3次。
1.3 血液采集
取样时将鱼迅速捞起并立即投入200 mg/L MS-222(间氨基苯甲酸乙酯甲磺酸盐,Sigma)中快速深度麻醉,用1 mL注射器尾静脉采血。其中一部分新鲜血液吸入提前准备好的肝素抗凝管中,用于血液血红蛋白和高铁血红蛋白的测定。剩余血液放入无菌离心管中4℃静置待其血清析出,4 000 r/min,离心10 min制备血清,血清置于-80℃中保存,用于其他生化指标测定。
1.4 生化指标的测定
血液及血清生化指标测定使用多功能酶标仪(型号:Bio Tek Epoch)和紫外分光光度计(型号:MAPADA UV-1100),试剂盒采购自南京建成生物工程研究所。检测指标包括血红蛋白(Hb)和高铁血红蛋白(MetHb);血清激素指标皮质醇(COR);血清生化指标葡萄糖(GLU);血清功能性蛋白指标热休克蛋白70(Hsp70);抗氧化指标超氧化物歧化酶(SOD)。
1.5 数据分析
数据以平均值±标准差(Mean±SD)表示,试验结果用 SPSS 17.0 软件进行单因素方差分析(ANOVA),当差异显著时(P<0.05),进行Ducan多重比较。
2 结果
2.1 Hb和MetHb的含量
急性低氧应激对Hb含量的影响见图1 A。在急性低氧应激过程中,Hb含量呈现先下降后上升的变化趋势,低氧应激3 h、6 h时,Hb含量与0 h均无显著性差异(P>0.05),12 h时Hb含量显著降低(P<0.05),24 h时,Hb含量又恢复至0 h水平。
由图1 B可知,急性低氧应激过程中,MetHb含量呈现先微微上升,后快速下降的变化趋势。低氧应激3 h、6 h,MetHb含量与0 h均无显著性差异(P>0.05),12 h和24 h的MetHb含量较0 h显著下降,24 h的MetHb含量与0 h有极显著差异(P<0.01)。

图1 急性低氧应激对鲫鱼血红蛋白(A)和高铁血红蛋白(B)含量的影响Fig.1 Effects of acute hypoxia stress on hemoglobin(A)and methemoglobin(B)concentrations in Carassius auratus
2.2 血清COR和GLU含量
急性低氧应激对血清COR含量的影响见图2 A。COR含量变化受低氧应激影响显著,在低氧应激过程中,COR含量在应激3 h时含量显著性升高(P<0.05),3 h后便开始迅速下降,应激6 h时COR含量降低至0 h水平,12 h和24 h的COR含量继续降低,且这两个时间点与0 h存在显著性差异(P<0.05)。
由图2 B可知,GLU含量随着低氧应激时间的延长呈现先升高后降低的变化趋势。低氧应激过程中,GLU含量快速升高,3 h、6 h、12 h、24 h时,GLU 含量全部高于0 h水平,且存在显著性差异(P<0.05),12 h时GLU含量达到最高峰。24 h时含量降低至6 h的含量水平,与0 h血糖含量相比仍然存在极显著差异(P<0.01)。

图2 急性低氧应激对鲫鱼血清皮质醇激素(A)和葡萄糖(B)含量的影响Fig.2 Effects of acute hypoxia stress on serum cortisol(A)and glucose(B)concentrations in carassius auratus
2.3 Hsp70含量
急性低氧应激对血清Hsp70含量的影响见图3 A。血清Hsp70含量随着低氧应激时间的延长呈现明显的先升高后降低的变化趋势。应激3 h血清Hsp70含量显著性升高(P<0.05),6 h含量达到最高峰,之后呈现下降趋势,应激12 h血清Hsp70含量降至3 h含量水平,之后Hsp70含量继续下降,24 h时Hsp70含量显著低于0 h水平(P<0.05)。
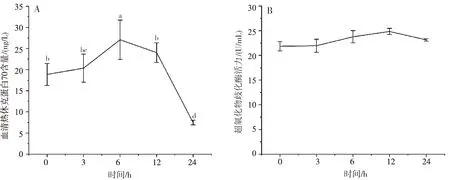
图3 急性低氧应激对鲫鱼血清热休克蛋白70含量(A)和超氧化物歧化酶活力(B)的影响Fig.3 Effects of acute hypoxia stress on serum heat shock protein70(A)concentrations and superoxide dismutase activity(B)in Carassius auratus
2.4 血清SOD酶活力
由图3B可知,鲫鱼血清SOD活力在急性低氧3~12 h持续缓慢升高,24 h又有所下降,总体呈现先升后降的变化趋势,但各个时间点上SOD酶活力的变化差异不显著(P>0.05)。
3 讨论
3.1 急性低氧应激对Hb和MetHb的影响
本研究结果显示,低氧应激12 h鲫鱼血清Hb含量较应激前水平降低约25%,24 h又恢复到应激前水平。这与王晓雯[19]的研究结果基本一致,西伯利亚鲟鱼(Acipenserbaerii)Hb含量在低氧处理3 h含量降低31.3%。Hb含量代表机体携带和运输氧气的能力。鲫鱼的Hb在低氧应激后呈现先降低后升高的变化趋势,可能是随着氧气的消耗及机体缺氧程度的增加,血红蛋白含量下降,以降低血氧亲和力,使更多的氧气供其他身体组织使用,后期机体逐渐由有氧呼吸转为无氧呼吸方式,因此Hb含量又恢复至应激前水平。另有研究发现试验鱼血液Hb含量与溶氧水平呈负相关,张曦等[20]研究发现鲫鱼幼鱼在急性低氧条件下处理3 h,Hb含量增加58%。董晓煜等[21]、黄国强等[22]也得到类似结论。此类研究认为血红蛋白与氧气结合的程度受到PO2的影响,当PO2较低,血红蛋白与氧结合能力降低,机体血红蛋白的增加可以补偿由于水体溶氧较低造成的机体缺氧[23]。
MetHb是Hb的氧化产物,不能携带氧。本研究中,随着低氧时间的延长,试验鱼缺氧的程度不断加强,MetHb含量降低,意味着血红蛋白更多的是以可与氧结合的形式存在于血液中,更加有利于机体对氧气的充分利用,这可能与机体自身的防御性机制有关。一般研究显示,MetHb含量受水体亚硝酸盐含量影响较大,而有关低氧对其含量影响的研究较少[24]。
3.2 急性低氧应激对血清COR和GLU含量的影响
本研究结果显示,鲫鱼血清COR在低氧应激后呈现短时间内快速大量分泌,用以促进葡萄糖的大量产生,为机体供能。另有大量研究发现,运输应激[25]、拥挤应激[26]、温度应激[27]、氨氮应激[28]都会使试验鱼血清COR含量在一定时间内迅速升高。低氧处理后期COR含量又迅速降低,这可能与COR的负反馈调节有关。
鲫鱼在急性低氧应激后,血清GLU含量快速升高,与齐明等[3]、陈德举等[29]、黄建盛等[30]、刘旭佳等[31]、王慧娟等[32]的研究结果一致。说明急性低氧胁迫导致鱼体出现应激性血糖升高,为机体提供能量并应对和适应应激胁迫,是一种机体自我保护机制的体现。随着能量的大量消耗,应激反应后期,GLU水平就随之下降。这也与试验过程中观察到的试验鱼状态相吻合,随着低氧时间的延长,能量消耗严重,试验鱼活力减弱,出现静止不动,昏迷,失衡等情况。除了低氧应激,鱼类受到的其他大多数应激也伴随着血糖的升高,如水温变化[33]、氨氮胁迫[34]、拥挤胁迫[35]和干露胁迫[36]等。
3.3 急性低氧应激对血清Hsp70含量的影响
本研究中,鲫鱼在急性低氧应激后血清Hsp70含量先显著性升高,24 h时又大幅度下降。王晓阳[37]研究发现,低氧条件下,鲢(Hypophthalmichthysmolitrix)的心脏、脑、肝脏、脾等不同组织中,Hsp70基因表达在不同时间点均有不同程度的上调。崔彦婷等[38]、王晓雯等[39]研究高温应激后试验鱼肝脏Hsp70基因表达呈现先升高后降低的变化趋势,与本研究结果一致。HSPs表达被认为是生物细胞抵抗有害刺激,维持内环境稳定最原始的机制之一,当然,如果应激强度过大,造成细胞的膜结构损伤和蛋白质结构改变,就会使HSPs的表达合成降低[11]。
3.4 急性低氧应激对血清SOD活力的影响
本研究中,鲫鱼血清SOD活力总体呈现先升后降的变化趋势,但各个时间点酶活力均稍高于应激前水平。这与陈世喜等[40]和王维政等[41]对试验鱼在低氧环境下肝脏SOD活力的研究结果一致。熊向英等[42]研究同样显示,鲻鱼(Mugilcephalus)血浆中的总超氧化物歧化酶(T-SOD)活力在低氧条件下有所升高。但在有些情况下,低氧应激会导致抗氧化相关酶活性被抑制,如王晓雯等[19]和郭志雄等[43]研究发现,低氧处理后试验鱼肝脏SOD活力明显降低,认为低氧应激后肝脏中产生了过多的活性氧自由基(ROS),从而抑制了酶活性。另有研究发现[44-45],低氧处理后,不同组织中的SOD活性变化趋势不同,这可能与不同组织在受到胁迫后的损伤程度不同,或是组织内SOD酶活对环境因子的敏感程度和调节机制不同导致。
4 结论
急性低氧应激条件下,鲫鱼的血液生化指标Hb、MetHb、COR、GLU、Hsp70会随着应激时间的延长和低氧程度的增加产生显著性的变化,暗示低氧应激对水产动物激素分泌、血细胞水平、能量利用和机体抗应激相关酶的活力等方面产生重要影响。因此,在水产动物运输过程中,注重水体溶氧监测及其他水质指标的调控,谨防由于低氧引起的鱼类应激反应的发生,降低运输损伤、提高运输存活率。此外,Hb、COR、GLU、Hsp70等指标在用于水产动物机体应激水平的评价方面具有重要指导意义。
□

