当归多糖对造血干细胞SIRT1、p53和p21表达的影响*
李红辉, 唐石欢, 张先平△, 龙婷, 彭露, 张慧, 吴沁园, 张红梅, 王亚平
娄底市中心医院 1中医科, 2生殖中心(湖南娄底 417000); 3重庆医科大学干细胞与组织工程研究室(重庆 400016)
目前人们在对衰老有关机制深入研究的同时,对抗衰老药物的研发也正在逐步深入。中医药博大精深、抗衰老在我国历史悠久,鉴于其是整体均衡调节且不良反应较少等优势在延缓衰老进程当中发挥独特的作用。当归中最主要的活性成分之一就是当归多糖(angelica sinensis polysaccharide,ASP),ASP具有抗辐射、抗氧化、调节免疫、促进造血、抗肿瘤等作用[1-5]。沉默信息调节因子2相关酶1(silent information regulator factor 2-related enzyme 1,SIRT1)作为依赖烟酰胺腺嘌呤二核苷酸(NAD+)的Ⅲ型组蛋白/蛋白质脱乙酰基酶中的一员,在细胞寿命延长和衰老、炎症以及抗氧化应激中起关键作用[6]。2017年1月至2020年4月,本研究拟在课题组前期已构建的衰老造血干细胞(HSCs)模型的基础上[7],观察ASP对X线辐射致小鼠衰老HSCs SIRT1、p53及p21蛋白表达的影响,探讨ASP基于调控HSCs衰老的可能机制,为预防衰老以及抗衰老治疗提供更为可靠的实验依据。
1 材料与方法
1.1 主要药物与试剂 ASP由陕西慈缘生物技术有限公司提供(纯度≥95%);Anti-Sca-1 MicroBead Kit购于Miltenyi公司;SA-β-Gal Staining Kit购于Cell Signaling公司;淋巴细胞分离液购于Axis-Shield公司;MethoCult GF M3434购于Stem Cell Technologies公司;SIRT1兔抗羊抗体购于Abcam公司,p53、p21兔抗鼠多克隆抗体购于Bioworld Technology公司;BCA蛋白相关试剂盒购于Pierce公司;辣根过氧化物酶标记的二抗试剂盒、内参GAPDH抗体购于Jackson公司。
1.2 动物分组及处理 72只由重庆医科大学动物中心[合格证号:SCXK(渝)2007-0001]提供的SPF级C57BL/6J小鼠,6~8周龄、16~20 g/只,雌∶雄为1∶1。将小鼠随机纳入对照组、模型组和ASP组,每组24只。ASP组和模型组均用3.0 Gy X线照射全身(照射能量为6 MeV,时间1 min,高度100 cm,面积25 cm×25 cm),每10 d 1次,共照射8次,总计24 Gy,照射当天分别给予200 mg/kg ASP和等容量生理盐水灌胃,隔天1次,共灌胃40次[7],对照组予生理盐水。在末次照射后的第10天予拖颈法处死小鼠。
1.3 HSCs分离与纯化 处死小鼠后在无菌条件下分别取出股骨、胫骨,1640培养基冲洗骨髓,制单细胞悬液,通过淋巴细胞分离液分离出骨髓单个核细胞。采用干细胞抗原(Sca-1)鉴定、分选HSCs,通过流式细胞术检测Sca-1+细胞比值,即HSCs纯度[7]。
1.4 流式细胞仪分析细胞周期 分别收集3组小鼠Sca-1+HSCs,PBS洗涤、冰乙醇固定过夜,离心、留取沉淀,再次PBS洗涤,加牛胰核糖核酸酶,于37℃准确反应30 min,再予碘化丙啶(PI)避光孵育30 min后经流式细胞术检测,通过Multicycle分析软件了解细胞周期分布情况。
1.5 HSCs混合集落培养 分别收集3组小鼠Sca-1+HSCs,经培养基洗涤后离心弃上清,加入1 mL甲基纤维素半固体培养基并充分混匀,随后接种96孔板,置于5% CO2、37℃培养箱孵育11~12 d,按照接种HSCs与混合集落形成单位(colony forming unity-mixture,CFU-Mix)的数量评价HSCs的多向分化潜能。
1.6 SA-β-Gal染色检测衰老细胞 分别收集3组小鼠Sca-1+HSCs,经洗涤后离心弃上清,加入固定液震荡混匀,于室温固定10 min,再次洗涤并离心后弃上清,加入固定液充分混匀,置于无CO2条件下37℃孵育染色12~16 h,涂片(细胞数约为1×104个/张),甘油封片后镜检。随机检测400个细胞,观察阳性细胞形态、计算阳性细胞率。SA-β-Gal染色阳性细胞率(%)=(观察阳性细胞数/观察细胞总数)×100%。
1.7 Western blot法检测SIRT1、p53、p21蛋白表达 收集各组小鼠Sca-1+HSCs,分别提取蛋白样品,按照BCA蛋白定量试剂盒测定蛋白浓度,聚丙烯酰胺凝胶电泳分离后转膜、5%脱脂奶粉封闭。SIRT1一抗(1∶400)、p53一抗(1∶500)、p21一抗(1∶500)及GAPDH抗体(1∶500)4℃孵育过夜,加入二抗孵育1 h,经ECL发光显色,Quantity-One软件分析蛋白表达情况(目的条带同GAPDH条带吸光度的比值即为目的蛋白表达量)。

2 结果
2.1 HSCs分离与纯化 分选前骨髓单个核细胞中Sca-1+细胞百分比为(11.45±1.87)%,经分离纯化后Sca-1+细胞纯度达(86.21±6.17)%,提示经流式细胞仪测定分选的小鼠Sca-1+HSCs可能具有较高纯度。
2.2 HSCs 细胞周期比例 与对照组比较,模型组HSCs G1期比例显著增加、S期比例显著减少(P<0.01)。与模型组比较,ASP组HSCs G1期比例减少及S期比例增加(P<0.05)。见表1、图1。

表1HSCs 细胞周期分布与CFU-Mix数量
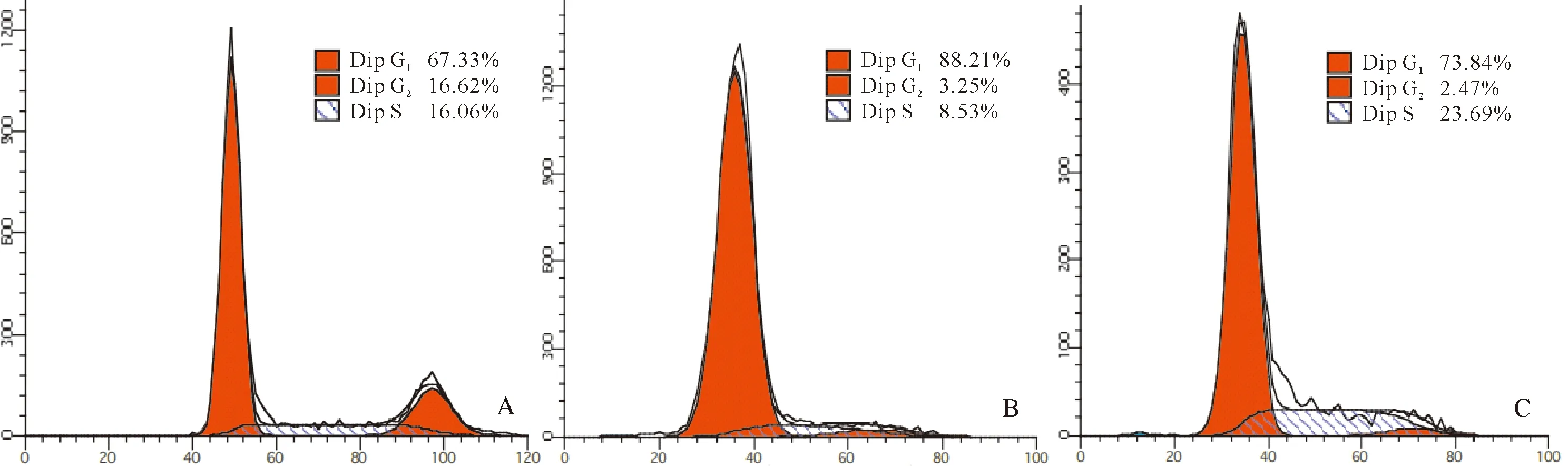
注:A:对照组;B:模型组;C:ASP组
2.3 HSCs CFU-Mix形成能力 与对照组比较,模型组HSCs 形成的CFU-Mix数量减少(P<0.05);与模型组比较,ASP能抑制HSCs形成CFU-Mix数量减少(P<0.05)。见表1、图2。

注:A:对照组;B:模型组;C:ASP组
2.4 HSCs SA-β-Gal染色 SA-β-Gal染色显示:阳性细胞(衰老细胞)体积较大、胞质呈蓝色,而阴性细胞未着色。与对照组[(9.91±1.08)%]比较,模型组HSCs SA-β-Gal染色阳性率为(54.14±5.58)%,明显升高(P<0.01);与模型组比较,ASP组HSCs SA-β-Gal染色阳性率为(11.42±1.07)%,明显降低(P<0.05)。见图3。

注:A:对照组;B:模型组;C:ASP组
2.5 HSCs SIRT1、p53、p21蛋白表达 Western blot结果显示:与对照组比较,模型组HSCs SIRT1蛋白表达减少(P<0.01)、p53和p21蛋白表达均显著升高(P<0.01)。与模型组比较,ASP组HSCs SIRT1蛋白表达上调(P<0.05)、p53和p21蛋白表达均下调(P<0.05)。见表2、图4。

表2 HSCs SIRT1、p53、p21蛋白表达
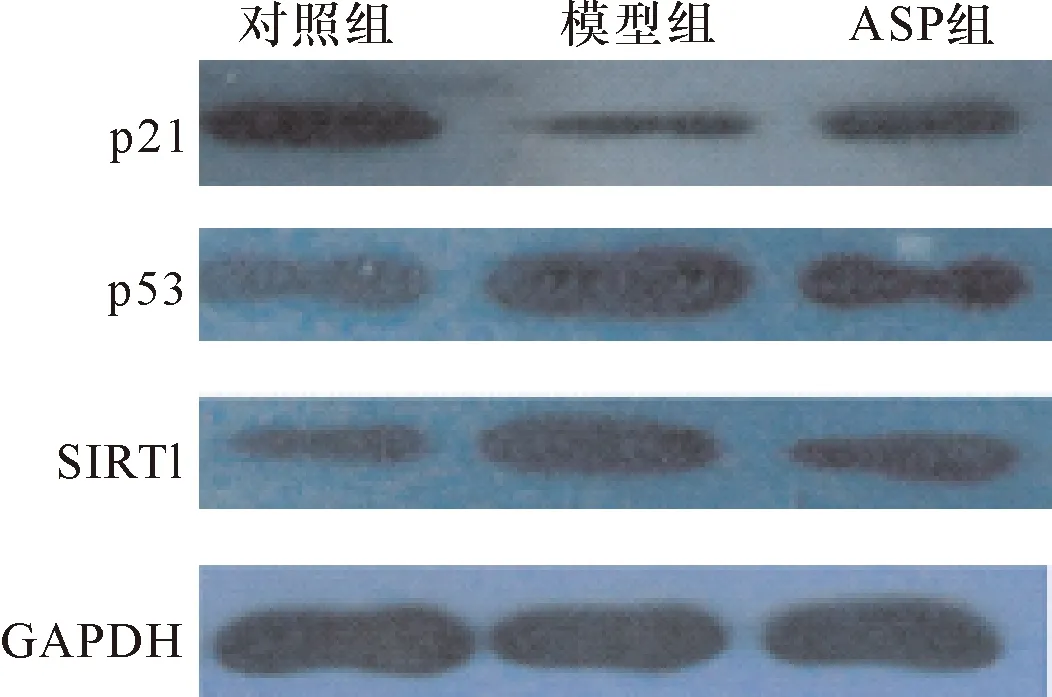
图4 HSCs SIRT1、p53、p21蛋白表达水平
3 讨论
随着人口出生率的下降及平均寿命的增加,伴随衰老相关疾病的发病率亦逐年升高[8-9]。目前衰老与抗衰老相关研究已日益成为各领域关注的热点和焦点。衰老涉及多器官、细胞参与,与多种信号通路触发紧密相关。SIRT1是目前衰老研究中较为热门、广泛的蛋白,其可能会通过抑制细胞凋亡、调控新陈代谢以及抑制炎症等来延缓细胞衰老[10]。已有研究报道SIRT1可能参与调控p53、叉头转录因子1(FOX1)、炎性小体3(NLRP3)、核因子E2相关因子2(Nrf2)等信号通路[11-12]。SIRT1涉及的氧化还原相关靶分子主要为p53和FOX,而p53在调节SIRT1氧化还原相关反应中发挥着重要的作用。p53是SIRT1的重要下游信号通路,活性形式为乙酰化p53蛋白,可能具有促进细胞衰老的作用[13]。SIRT1和p53的活性可能存在相互调节作用,在SIRT1启动子区域中可能存在p53结合位点,SIRT1通过使p53去乙酰化来抑制p53依赖性转录和凋亡,从而修复因应激引起的DNA损伤,可能减少细胞凋亡[14]。此外,近几十年来研究发现,中药的活性成分可能治疗多种衰老相关疾病动物模型[15]。故本研究在前期已经构建小鼠HSCs衰老模型的基础上选用中药ASP干预[7],探索ASP的干预作用及其延缓衰老的潜在作用机制。
p53/p21信号通路是较为经典的与细胞衰老有关的信号通路,但是它涉及的上游与下游的具体调控基因尚不明确。p53蛋白可特异性结合DNA,通过泛素化、乙酰化等翻译后修饰调控细胞周期的启动[16],在某些细胞应激状态时(譬如存在癌基因及DNA损伤)时被激活。正常情况的“分子警察”p53可在G1期对DNA损伤点进行检查、并对各种信号进行整合,以判断基因组是否完整,如发现DNA损伤将阻止DNA进行复制,并会提供足够的时间修复,若不能成功修复损伤DNA时可能通过调节不同靶蛋白如:还原型烟酰胺腺嘌呤双核苷酸磷酸(NADPH)的胞质亚单位嗜中性粒细胞胞浆因子(NCF2/p67phox)、p53诱导蛋白、衔接蛋白(p66Shc)、凋亡基因(Bax)等促进氧化应激损伤,诱导细胞凋亡[17]。本研究中,模型组HSCs G1期比例、p53、p21蛋白表达及SA-β-Gal染色阳性率均显著增加,但予以ASP干预后HSCs G1期比例、p53、p21蛋白表达及SA-β-Gal染色阳性率均显著降低、且S期及CFU-Mix数量增加。故认为小鼠p53蛋白的激活可促使p21蛋白的转录增加,进而将细胞周期阻滞在G1期,负性调控细胞周期、促进细胞衰老[13];这进一步证实了前期研究:经ASP干预后可能显著改善HSCs G1期阻滞及SA-β-Gal染色阳性率的增加,下调p53、p21蛋白表达,进而延缓细胞衰老进程[18]。
新近研究表明,p53蛋白是SIRT1的重要下游信号通路,可能被SIRT1调控[11-12,19]。SIRT1作为一种脱乙酰酶,可能导致某些衰老蛋白(如p53、p21蛋白)去乙酰化失活延缓细胞衰老、降低核因子-κB(NF-κB)的表达,从而直接或间接地参与衰老信号通路的调控[20-22]。在细胞DNA损伤等应激状态下,p53蛋白的表达和积累增加,若SIRT1激活则可使p53蛋白C端的第382位赖氨酸残基处于去乙酰化状态,降低p53作为转录激活因子的活性,可能阻止p53途径诱导的细胞凋亡和(或)生长抑制,从而延长细胞寿命[23]。本研究中模型组HSCs衰老染色阳性率、G1期比例、p53和p21表达增加的同时SIRT1表达反而降低;但经ASP干预后HSCs SIRT1表达增加、且衰老染色阳性率、G1期比例、p53和p21表达均降低,这与上述研究报道相吻合。推测ASP干预后可能使HSCs中SIRT1的表达增加、使p53去乙酰化失活,从而减少活性p53的含量,致下游基因p21转录的活性降低,直接或间接地影响p53/p21通路,进而调控细胞衰老[24-26]。
综上所述,ASP可能通过增加SIRT1表达、下调p53及p21蛋白的表达调控细胞周期,以延缓衰老。但本研究中未据ASP干预行剂量-效应分析,结合目前SIRT1具体调控机制尚不明确,课题组后续将进一步完善并探索ASP最佳给药剂量、更深入地探索SIRT1延缓衰老的具体分子机制。

