Hippo信号通路调节牙周膜干细胞生物学行为的研究进展
王钰静,王惠宁,2
1.温州医科大学 口腔医学院,浙江 温州 325035;2.温州医科大学附属口腔医院 牙周科,浙江 温州325027
牙周炎是口腔常见病之一,发病率高达80%以上,可导致牙周附着丧失、牙槽骨吸收、牙齿松动等,已成为成人牙齿脱落的主要原因,同时,其作为心脑血管疾病、糖尿病等全身性疾病的影响因素,危害全身健康[1-2]。此外,修复治疗和正畸矫治过程中的不良因素亦可导致牙槽骨吸收、牙龈退缩等牙周组织完整性破坏现象[3-4]。目前临床上以去除病因、牙周洁治术、刮治术及口腔卫生指导等基础治疗作为牙周疾病的主要治疗方法,但对于重度牙周炎患者牙周支持组织的过度丧失尚缺乏有效的治疗手段。
牙周膜干细胞(periodontal ligament stem cells, PDLSCs)是存在于牙周组织中一种具有间充质干细胞特性的多能性干细胞,具有成骨、成脂、成纤维、成牙骨质等多向分化的潜能[5-6]。此外,其具有增殖与分化能力,近年来已成为牙周组织重建、再生和骨组织工程的潜在种子细胞[6]。因此,探讨PDLSCs增殖、凋亡、衰老、分化等生物学功能及其影响因素和具体机制可丰富牙周再生临床应用的理论基础,为牙周疾病所致牙周支持组织破坏的治疗提供新思路。
1 Hippo信号通路
Hippo信号通路最初是在果蝇体内发现的一条对组织器官生长有重要调控作用的激酶链,因其关键基因hpo突变所致的河马样器官增大的表型而得名[7]。科学研究陆续证实,果蝇中该通路的核心分子具有进化保守的调控功能,在哺乳动物体内表现为功能相似的同源物[8-10]。Hippo信号通路由一系列蛋白激酶和转录因子组成,其中哺乳动物体内该通路的核心蛋白激酶包括:①MST1/2(mammalian sterile 20-like 1/2 kinases)或STK4/3(serine/threonine kinase 4),通过磷酸化其下游的蛋白激酶发挥作用;②SAV1(Salvador 1),通过与MST1/2形成复合物促进其下游蛋白磷酸化;③LATS1/2(large tumor suppressor homolog 1/2),通过磷酸化和抑制下游效应因子发挥作用;④MOB1A/B(MOB kinase activator 1A/B),与LATS1/2形成复合物促进下游效应因子磷酸化。转录因子则主要包括:①YAP/TAZ,为果蝇中Yki的同源基因,是Hippo通路下游关键效应因子。YAP在哺乳动物中表现为YAP1和YAP2两种亚型,其中YAP1为细胞内连接蛋白和转录辅助激活因子,通过基因的转录激活和表达在促进组织再生、维持干细胞更新等各种生物效能中发挥作用[11-13]。TAZ则为具有PDZ基序的转录共激活因子;②TEAD1-4(TEA domain family transcription factors 1-4),其中TEAD-2位于细胞核内,可通过与YAP形成复合物,共同激活参与促进增殖及抑制凋亡的基因表达。
Hippo信号通路以其调节器官大小的功能而闻名,研究证实Hippo激酶级联或上游调节因子的失活导致各种器官的过度生长[14]。随着研究逐步深入,不少关于Hippo信号通路在组织再生、干细胞功能等方面发挥重要调控作用的报道引起了广泛关注[15]。越来越多的证据表明,Hippo信号通路广泛表达于各类干细胞谱系中,且在牙周膜细胞中也存在特异性表达。PDLSCs作为上述两类细胞的“交集”,在其增殖、凋亡、分化等生物学过程中Hippo也扮演了重要角色(见表1)。生理状态下,Hippo信号沉默时,细胞内YAP处于激活状态,可进入细胞核与核因子TEAD结合共同激活细胞增殖相关基因的表达。而来自细胞微环境中的机械信号、氧化应激、其他调节因子等各类应激状态可条件性激活MST1/2,进而募集SAV1逐级磷酸化LATS1/2及MOB1A/B,形成复合体最终在转录水平上多位点磷酸化下游效应因子YAP/TAZ,进而使其局限在细胞质中泛素化降解(见图1),从而在转录水平上调控细胞增殖及成骨相关基因表达、抑制成脂基因表达[16-18]。
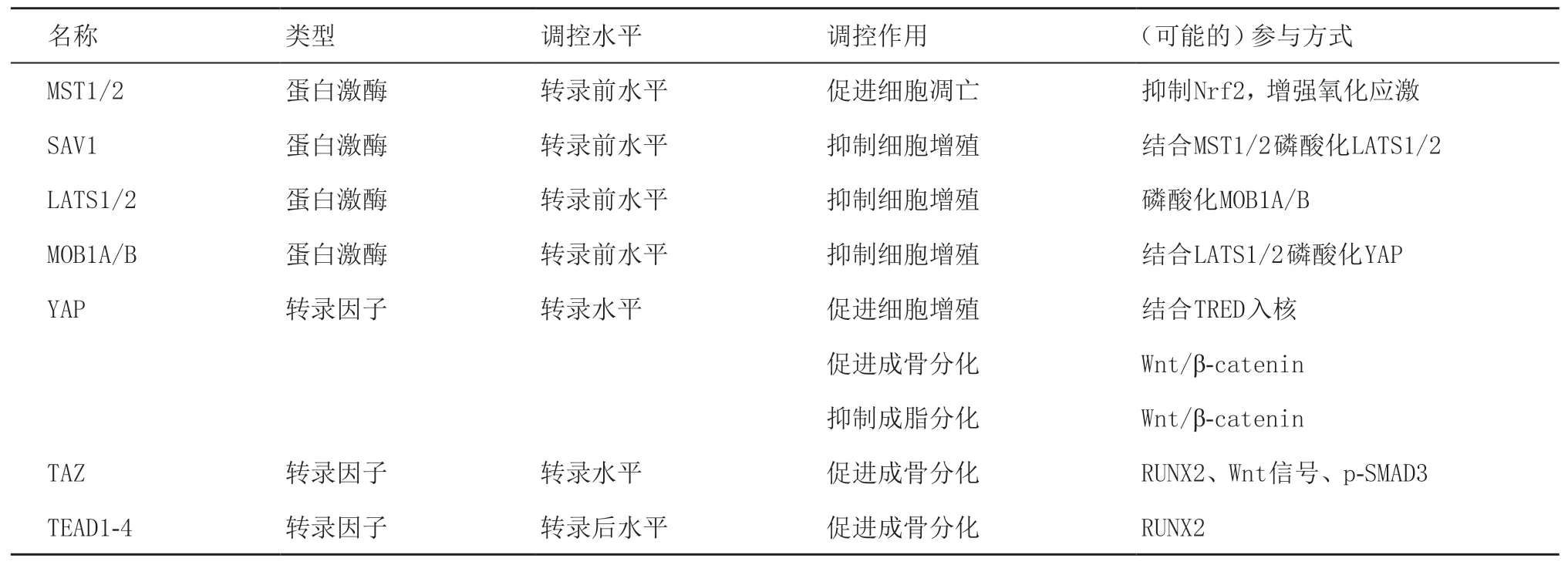
表1 Hippo信号通路相关组分参与牙周膜干细胞生物学功能调控

图1 经典Hippo信号通路作用机制简图
2 Hippo信号通路与PDLSCs增殖-凋亡平衡
研究证实,PDLSCs在体内外均有一定的增殖能力,且其体外克隆增殖能力较牙髓干细胞和骨髓间充质干细胞更强[19]。已有证据表明其增殖能力与多种因素相关,主要包括机械负荷、白细胞介素10(interleukin-10, IL-10)及白细胞介素11(interleukin-11, IL-11)、缺氧、生长因子的参与等[20-23]。近年研究显示Hippo信号通路中多种组分的沉默和激活在其中参与了各类干细胞增殖活性的调节[24],包括MST1/2、LATS1/2、MOB1等。然而,目前对于PDLSCs的研究则集中于转录因子YAP/TAZ。
WEN等[25]通过构建增强绿色荧光蛋白慢病毒载体下调人PDLSCs中YAP的表达水平,流式细胞术结果表明YAP的下调可使细胞滞留于G1期从而抑制人PDLSCs的增殖活性。同时,JIA等[26]通过激活人PDLSCs中YAP过表达,证实过表达YAP可使细胞增殖活力提高,细胞凋亡率显著降低,提示YAP在人PDLSCs的增殖-凋亡平衡中具有调控作用。此外,YAP的下调抑制Erk、Bcl-2信号通路相关因子表达,而其上调则对上述通路有促进作用。已有研究证实Erk及Bcl-2信号通路参与细胞增殖的调节[27],提示二者可与Hippo信号通路互相作用共同调节人PDLSCs的增殖,但具体机制尚未见相关研究阐述。此前,HÜLTER-HASSLER等[28]对生物力学应变下的人牙周膜成纤维细胞增殖进行了研究,证实该进程中YAP核向转移,且抑制Erk1/2所致YAP活性下调的现象亦揭示了YAP是一种通过MAPK非依赖性途径调节增殖的因子。以上研究提示YAP的表达可能受到包括Hippo信号通路在内的多种信号通路的共同调节。
此外,MST1/2已被证明是促凋亡激酶,可在凋亡信号下活化,通过参与细胞氧化应激途径诱导细胞凋亡[29],但目前尚未见相关研究报道其在PDLSCs中的调节作用。
3 Hippo信号通路与PDLSCs衰老
目前Hippo在PDLSCs衰老方面的研究多为表型研究,WEN等[25]下调人PDLSCs中YAP表达水平后,衰老特异性染色实验证实其衰老程度加重。为增加人PDLSCs的利用来源,已有研究就其永生化细胞系的建立和机制进行了探索。CHEN等[30]通过转染含有端粒酶反转录酶基因(telomerase reverse transcriptase, TERT)的慢病毒建立了可多次传代的人牙周膜永生化干细胞系(TERT-hPDLSCs),同时对YAP在其中的作用进行了探讨,发现加入抑制YAP与TEAD结合的抑制剂Verteporfin时,TERThPDLSCs的增殖率减少,凋亡率和衰老率明显增加,提示YAP在介导永生化PDLSCs中可能发挥作用,但其具体机制尚缺乏进一步探究。
4 Hippo信号通路与PDLSCs多向分化
在生理条件下,PDLSCs处于静息状态,以维持牙周膜细胞的更替和稳定的功能,当牙周膜、牙槽骨、牙骨质等牙周支持组织发生破坏和丧失时,PDLSCs可分化为成纤维细胞、成骨细胞、成牙骨质细胞等参与缺损修复,其分化方向受到多种转录因子、信号通路及干细胞巢微环境的调控。目前研究显示,Hippo信号通路主要通过调节成骨分化和成脂分化参与PDLSCs的分化过程,在成纤维及成牙骨质方向尚未见相关研究。
LIN等[31]通过构建慢病毒载体转染α-降钙素基因相关肽(α-calcitonin gene related peptide,α-CGRP)在人PDLSCs中过表达,发现其成骨表型ALP、Col-1及RUNX2的上调趋势与YAP相一致,促进牙周膜细胞成骨。此前已有研究[32-34]证实α-CGRP可刺激成骨细胞和骨髓间充质基质细胞的增殖、分化和成熟,且Hippo信号通路在CGRP过表达的小鼠骨髓间充质干细胞成骨分化中起作用,提示CGRP可能通过Hippo-YAP信号介导人PDLSCs的成骨分化,但具体调控水平和机制尚待研究。TAO等[35]通过建立TNF-α诱导的牙周炎模型并进行体外实验,发现YAP1的过表达可改善TNF-α诱导的人PDLSCs凋亡,并促进PDLSCs的分化,尤其是成骨分化,提示YAP可能是牙周炎治疗的潜在靶点。JIA等[36]对YAP调节人PDLSCs的多向分化能力机制进行了研究,发现YAP可能通过调节LRP6和DVL3等Wnt信号通路上游蛋白促进细胞成骨分化,同时抑制成脂分化。此前,Wnt/β-catenin信号通路已被证实可增强干细胞的成骨分化,抑制干细胞的成脂分化,其潜在蛋白结合位点为MOB1[37-38],提示YAP在调控PDLSCs的分化方向过程中受多种机制的调节作用。
此外,目前也有部分研究证实Hippo信号通路在机械应力诱导的PDLSCs成骨分化中发挥调节作用,为正畸矫治过程中的生物学基础及导致的牙周损伤提供了新的见解。近期,WU等[39]通过高通量测序检测PDLSCs受拉伸应力组和非拉伸应力组牙周膜细胞中miRNA的表达谱,预测Hippo信号通路中YAP1、TEAD2、LATS1、TEAD1等为差异表达的miRNAs的靶基因。SUN等[40]在体内实验中发现,经正畸移动牙齿14 d后,大鼠骨细胞、骨基质及PDLSCs中可见YAP和TAZ,其表达量与正畸力呈正比,且通过双标记荧光染色发现TAZ可通过RUNX2调节骨组织重塑,提示Hippo-TAZ-RUNX2在牙槽骨改建中可能发挥重要作用[41-42]。YANG等[43]通过施加循环拉伸应力模仿正畸力处理牙周膜细胞,检测发现YAP核易位明显增加,且敲除YAP基因及加入YAP抑制剂均可抑制成骨作用,提示YAP在拉伸应力过程中被激活且调控PDLSCs的成骨分化。同时,研究通过体外建立小鼠正畸牙齿移动模型证明YAP在张力侧牙周膜细胞中上调,表明Hippo-YAP信号通路可能在牙周膜重建中发挥重要作用。此外,有研究表明,miR-135b-5p可通过控制Hippo信号通路的关键负调节因子LATS1和MOB1B的表达水平,调节人间充质干细胞的成骨分化,从而导致Hippo信号通路的激活[44],但在PDLSCs中的作用尚待进一步研究。
4 总结与展望
目前临床上在牙周疾病的治疗过程中,对于严重的上皮附着丧失、牙槽骨吸收的病例尚缺乏有效的治疗手段,被逐步破坏的牙周组织将对患者生活质量、全身健康造成影响。因此,探索一种能够修复和重建损失的牙周组织的治疗手段应为目前值得关注的研究方向。PDLSCs作为牙周膜细胞中少量能够分化为成骨细胞、成纤维细胞、成牙骨质细胞等细胞的成体干细胞,对于牙周组织的再生具有重要意义,但调控其增殖、凋亡及多向分化的机制较为复杂,目前尚未被完全阐明,且体外传代培养的细胞质量受到衰老的限制,目前在临床应用方面具有一定限制。
虽然存在挑战,但Hippo信号通路关键蛋白激酶和转录因子在其中的应用和研究具有广阔的发展前景,已有研究表明Hippo信号通路在促进PDLSCs的成骨分化及增殖中发挥重要调控作用,且体外研究证实Hippo-YAP的表达可改善牙周炎诱导的大量细胞凋亡。因此,进一步加强Hippo信号通路对PDLSCs生物学功能的研究可在细胞和组织层面为修复缺损牙周结缔组织和骨组织的治疗提供新的思路和理论依据。

