COX-2/PGE2激活JAK/STAT3信号通路调控人口腔癌KB细胞增殖侵袭和转移
周 涛, 钱 永, 刘韦淞, 邓 达, 赵方腾, 姜垂广
(海南省肿瘤医院头颈外科, 海南 海口 570312)
口腔上皮癌是世界上第六大最常见的癌症,其预后很差,每年有超过50%的病例被诊断为口腔上皮癌[1]。研究发现口腔上皮癌的侵袭潜能与预后不良密切相关[2]。一些研究者已经证实深部浸润前的高恶性分级对口腔上皮癌的颈部区域淋巴结转移和预后具有预测价值。因此,为了改善口腔上皮癌患者的预后,必须阐明其潜在的侵袭机制和新的治疗策略。近些年越来越多的研究发现COX-2在喉部鳞状细胞癌、乳腺癌、肺癌、胃癌、食道癌、结肠癌、卵巢癌、肝癌等多种癌症中均有过表达,且生存率低、预后差[3]。此外,研究发现COX-2可促进细胞增殖、血管生成、肿瘤侵袭和转移[4]。据报道COX-2可抑制细胞凋亡和免疫反应。吲哚美辛通过下调COX-2抑制人胰腺星状细胞的增殖和活化[5]。另外,在胃癌和乳腺癌中,COX-2的表达与VEGF-C和淋巴管密切相关,提示COX-2与肿瘤转移有关[6]。COX-2介导肿瘤间质催乳素信号以启动肿瘤发生。但是有关COX-2具体调控口腔上皮癌发展的机制尚不明了。本研究主要通过分析COX-2调控口腔上皮癌KB细胞增殖、侵袭和EMT的作用机制,进一步阐明COX-2在口腔上皮癌发展过程中发挥的关键作用。
1 材料与方法
1.1主要材料:人口腔上皮癌组织和癌旁正常组织均来自本医院,样本的采取经过了患者和家属的同意,并保存在-20℃备用。人口腔上皮癌细胞(KB细胞)及其人永生化口腔上皮细胞(HIOEC细胞)来自中国科学院上海细胞库;DMEM(Dulbecco's-modified Eagle's medium)培养基、胎牛血清、青霉素、链霉素和胰蛋白酶来自购自Gibco公司;BCA蛋白定量试剂盒、CCK-8试剂盒和SDA-PAGE试剂盒来自上海碧云天生物科技有限公司;荧光定量PCR试剂盒购自日本Takara;Trizol来自美国Invitrogen公司;塞来昔布(celecoxib)和AH6809来自美国APExBIO公司;E-cadherin、N-cadherin、p-JAK、p-STAT3抗体购自Abcam;DAB显色试剂盒来自北京中杉金桥生物科技有限公司;COX-2抗体来自Cell Signaling Technology公司。
1.2方 法
1.2.1细胞培养和细胞转染:取KB细胞和HIOEC细胞,用加入10% FBS、1%青霉素及链霉素的DMEM培养基培养,细胞放在37℃、5% CO2、饱和湿度的恒温培养箱中生长,待细胞融合度达90%左右时,用0.25%胰酶进行消化和传代培养。传代的细胞铺于细胞培养板中,待细胞汇合达75%时,用Turbofect试剂按照说明书转染质粒。
1.2.2慢病毒转染:取长满后的KB细胞,用0.25%胰酶进行消化,将稀释后的细胞接种于24孔板中,加入含10%FBS的DMEM培养基,待细胞汇合至75%时。用辅助质粒(GAG、REV、VSV-G)和目的基因转染细胞,培养24 h,去上清,将2 mL Advanced DMEM,40μL血清,40μL L-Glu,20μL 1×chemically defined lipid concentrate,2μL 0.01 mmoL/L胆固醇和2μL 0.01 mmoL/L蛋黄卵磷脂混匀后加入细胞,48 h后收集上清液。将收集的慢病毒和500μL含100 mL/L FBS的DMEM培养基混合,添加到KB细胞中,加入浓度为6μg/mL的聚凝胺,显微镜观察细胞出现绿色荧光,添加终浓度为5μg/mL的嘌呤,观察细胞发光数量达到90%以上,收取细胞系进行检测。
1.2.3细胞增殖测定:取长满后的KB稳转细胞系,用0.25%胰酶进行消化,将稀释后的KB细胞铺于96孔板,每孔100μL,96孔板细胞置于常规培养箱中培养,细胞分为处理组和未处理组,皿底细胞观察为70%~80%时,分别用celecoxib、AH6809或AG490处理细胞,于37℃、饱和湿度和5% CO2培养箱静置48h,将10μL CCK-8工作液加入细胞中,慢慢晃匀后置于细胞培养箱持续培养2 h,取出细胞培养板,在酶标仪上读取各孔细胞在450 nm处的吸光值。
1.2.4细胞侵袭实验:取长满后的KB稳转细胞系,用0.25%胰酶进行消化,将稀释后的KB细胞铺于12孔板,观察密度为70%~80%时,分别用celecoxib、AH6809或AG490处理细胞,长满后进行消化制成细胞悬液,将100μL融化的Matrigel基质加入Transwell上室,上室中加入1×105个的细胞悬液,下室中加入600μL完全DMEM培养基,置于培养箱中培养24h,取出小室,加入4%多聚甲醛进行固定,取PBS加入其中进行洗涤,再加入0.1%结晶紫染色,20min后随机选取5个视野中的细胞进行观察和计数。
1.2.5ELISA检测细胞培养液中PGE2表达:将长满后的KB稳转细胞系用0.25%胰酶消化,铺于96孔板,在常规培养箱中培养,皿底细胞观察为70%~80%时,用celecoxib处理细胞,同时设置未处理组作为对照,于37℃、饱和湿度和5% CO2培养箱静置48h,用ELISA试剂盒检测细胞培养液中PGE2表达。
1.2.6qRT-PCR:收取分别用celecoxib、AH6809或AG490处理后处于对数期的KB稳转细胞系,加入Trizol提取细胞总RNA,在紫外风光光度计下读取RNA浓度和纯度,取A260/280值在1.8~2.0范围内的RNA样品,根据反转录二步法将RNA反转为cDNA。以cDNA为模板,使用SYBR Real-Time试剂盒进行qRT-PCR,重复3个复孔,以GAPDH为内参,使用2-△△Ct法分析结果。引物见表1。
1.2.7Western blot:收取分别用celecoxib、AH6809或AG490处理后处于对数期的KB稳转细胞系,加入裂解液在冰上充分裂解,用BCA试剂盒定量上清蛋白的浓度,每孔取50μg蛋白进行点SDS-PAGE凝胶电泳,蛋白分离后通过湿转仪器将蛋白转移到PVDF膜上。加入5%的脱脂奶粉进行过夜封闭,封闭完成后PVDF膜在相应的的一抗中过夜孵育,加入TBST清洗5次,再和二抗在室温条件下孵育2h,加入TBST清洗,清洗干净后用ECL试剂盒进行蛋白曝光。
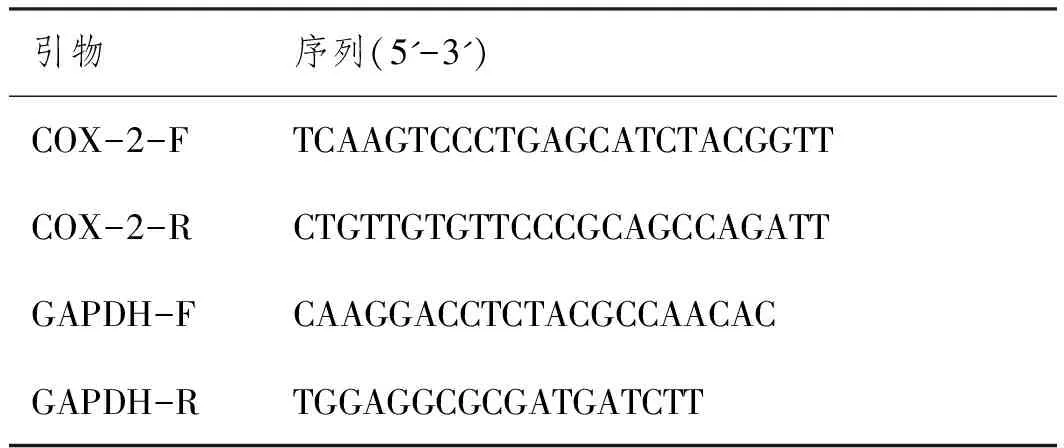
表1 引物序列
1.3统计学分析:用SPSS 16.0软件进行统计分析。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05时,表示差异显著或极显著。
2 结 果
2.1COX-2在口腔上皮癌组织和口腔上皮癌KB细胞中表达上调:由图1A和1B结果可知,和癌旁正常组织相比,口腔上皮癌组织中COX-2的基因和蛋白表达量明显上升(P<0.05)。由图1C和1D结果可知,和HIOEC细胞相比,KB细胞中COX-2基因和蛋白表达量明显升高(P<0.01)。以上结果表明COX-2在口腔上皮癌组织和口腔上皮癌KB细胞中表达上调。
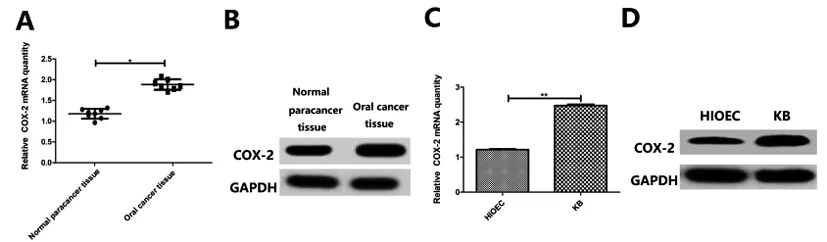
图1 COX-2在口腔上皮癌组织和口腔上皮癌KB细胞中表达上调
2.2过表达COX-2促进KB细胞增殖、侵袭和EMT:由图2A 可知,Lenti-COX-2细胞中COX-2的基因表达量明显高于Lenti-GFP细胞(P<0.01)。由图2B-2C可知,Lenti-COX-2细胞中COX-2的蛋白表达量明显高于Lenti-GFP细胞(P<0.01),说明过表达COX-2的KB稳转细胞系构建成功。由图2D -2H结果可知,和Lenti-GFP细胞相比,Lenti-COX-2细胞增殖能力明显提高(P<0.05),细胞侵袭数目明显增加(P<0.01),N-cadherin蛋白表达量明显上升(P<0.01),E-cadherin蛋白表达量明显下降(P<0.01)。和Lenti-COX-2细胞相比,Lenti-COX-2+celecoxib细胞增殖能力明显降低(P<0.05),细胞侵袭数目明显减少(P<0.01),E-cadherin蛋白表达量明显上升(P<0.01),N-cadherin蛋白表达量明显下降(P<0.01)。表明COX-2能够增强KB细胞的增殖、侵袭和EMT。

图2 过表达COX-2促进KB细胞增殖、侵袭和EMT
2.3COX-2上调KB细胞内PGE2表达和激活JAK/STAT3通路:由图3A-3C 可知,和Lenti-GFP细胞相比,Lenti-COX-2细胞内PGE2表达明显提高(P<0.001),p-JAK/JAK比值明显增加(P<0.01),p-STAT3/STAT3比值明显上升(P<0.01),和Lenti-COX-2细胞相比,Lenti-COX-2+celecoxib细胞内PGE2表达明显降低(P<0.001),p-JAK/JAK比值明显降低(P<0.01),p-STAT3/STAT3比值明显降低(P<0.01)。表明COX-2能够上调KB细胞内PGE2表达和激活JAK/STAT3通路。

图3 COX-2上调KB细胞内PGE2表达和激活JAK/STAT3通路
2.4AH6809或AG490作用细胞明显抑制了KB细胞增殖、侵袭和EMT:由图4A-4E结果可知,和Lenti-GFP细胞相比,Lenti-COX-2细胞增殖能力明显提高(P<0.05),细胞侵袭数目明显增加(P<0.01),N-cadherin蛋白表达量明显上升(P<0.01),E-cadherin蛋白表达量明显下降(P<0.01)。和Lenti-COX-2细胞相比,Lenti-COX-2+AH6809细胞增殖能力明显降低(P<0.05),细胞侵袭数目明显减少(P<0.01),E-cadherin蛋白表达量明显上升(P<0.01),N-cadherin蛋白表达量明显下降(P<0.01),Lenti-COX-2+AG490细胞增殖能力明显降低(P<0.05),细胞侵袭数目明显减少(P<0.01),E-cadherin蛋白表达量明显上升(P<0.01),N-cadherin蛋白表达量明显下降(P<0.01)。表明AH6809或AG490作用细胞明显抑制了KB细胞增殖、侵袭和EMT。

图4 AH6809或AG490作用细胞明显抑制了KB细胞增殖、侵袭和EMT
3 讨 论
口腔上皮癌是世界上最常见的肿瘤之一,其发病率和死亡率都在迅速上升,但其预后仍不理想。然而,口腔癌相关蛋白和基因的调控网络尚不清楚,限制了临床治疗的改进,充分地了解参与恶性行为的蛋白可能有助于改善口腔癌的治疗。近些年的研究表明COX-2能够作为人类疾病的关键调节因子。如通过抑制COX-2过表达的癌细胞中的delta-5去饱和酶来抑制癌细胞的迁移和侵袭。本研究首先发现COX-2在口腔癌组织和KB细胞中表达上调,与上述研究结果一致,COX-2在口腔癌KB细胞中作为癌基因发挥作用。我们建立了COX-2的稳转细胞系,进一步研究表明过表达COX-2促进了KB细胞的增殖、侵袭和EMT,而用塞来西布抑制COX-2后,明显下调了COX-2对KB细胞增殖、侵袭和EMT的促进作用。研究结果提示COX-2在口腔癌发展中具有重要作用,有望成为肿瘤治疗的新靶点。
后续研究发现COX-2上调KB细胞内PGE2表达和激活JAK/STAT3通路。PGE2作为花生四烯酸COX-2的主要催化产物,是COX-2的下游产物,且COX-2/PGE2通路在肿瘤发生中起关键作用。有文献报道乙型肝炎病毒X蛋白可通过COX-2/PGE2信号通路促进了乙肝相关性肝细胞癌发展和转移。研究发现PGE2具有4中受体,而其中PTGER2在PGE2参与的肿瘤发展中具有关键作用,抑制剂作用PTGER2能够下调PGE2对肿瘤发展的调控作用。我们研究发现COX-2能够上调KB细胞内PGE2表达,塞来西布抑制COX-2表达后,发现细胞培养液中PGE2表达量明显降低。
考虑到COX-2/PGE2轴在肿瘤发展中的关键作用,我们用AH6809抑制了PGE2受体PTGER2的表达,进一步探讨了KB细胞系的生物学功能,结果发现COX-2对KB细胞增殖、侵袭和EMT的促进作用明显受到抑制。这些年的研究发现JAK/STAT3通路在癌症增殖、侵袭和转移过程中发挥了关键作用,如丹参酮I通过抑制JAK/STAT3信号通路抑制骨肉瘤的生长和转移[7]。癌相关成纤维细胞通过分泌IL-11靶向JAK/STAT3/Bcl2途径促进胃癌化疗耐药[8]。而且研究表明在肝癌细胞中,COX-2和JAK/STAT通路密切联系,抑制COX-2的过度表达可能影响JAK/STAT细胞信号转导通路的活性[9]。此外还发现小檗碱通过COX-2/PGE2介导的JAK2/STAT3信号通路抑制结直肠癌细胞的侵袭和转移[10]。此外文献报道在肝细胞癌(HCC)中,TLR4信号促进COX-2/PGE2/STAT3正反馈环路,参与HCC进展[11]。ATPγS通过/JAK2/STAT3/cpl(2)信号通路诱导A549细胞中COX-2的表达和PGE(2)的产生。考虑到COX-2/PGE2与JAK2/STAT3信号通路在肺癌、直肠癌等癌症中发挥的关键作用,我们猜想在口腔癌KB细胞中,COX-2/PGE2也可能通过JAK2/STAT3信号通路发挥作用。因此我们用AG490抑制了KB细胞内JAK/STAT3通路,发现能够过表达COX-2后,KB细胞的增殖、侵袭和EMT能力明显下调。研究结果表明COX-2/PEGE/JAK-STAT3轴在口腔癌KB细胞发展中发挥了关键作用,值得进一步深入的研究。
综上所述,该研究表明COX-2在口腔癌KB细胞中高表达,COX-2/PGE2激活JAK/STAT3信号通路促进人口腔癌KB细胞增殖、侵袭和EMT。本研究结果为口腔癌患者的靶向治疗提供了新的研究方向。

